2020届一轮复习人教版物质的制备实验方案的设计与评价作业
第十章 化学实验基础
第31讲 物质的制备 实验方案的设计与评价
A组 基础必做题
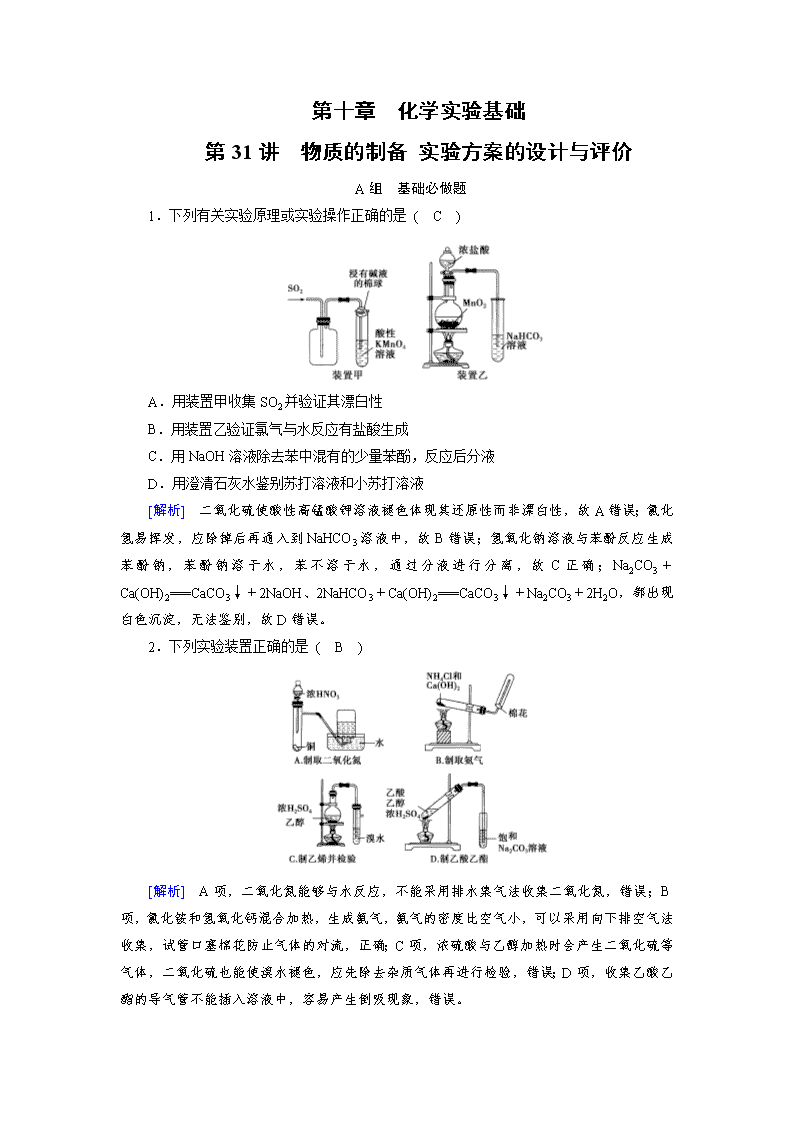
1.下列有关实验原理或实验操作正确的是 ( C )
A.用装置甲收集SO2并验证其漂白性
B.用装置乙验证氯气与水反应有盐酸生成
C.用NaOH溶液除去苯中混有的少量苯酚,反应后分液
D.用澄清石灰水鉴别苏打溶液和小苏打溶液
[解析] 二氧化硫使酸性高锰酸钾溶液褪色体现其还原性而非漂白性,故A错误;氯化氢易挥发,应除掉后再通入到NaHCO3溶液中,故B错误;氢氧化钠溶液与苯酚反应生成苯酚钠,苯酚钠溶于水,苯不溶于水,通过分液进行分离,故C正确;Na2CO3+Ca(OH)2===CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,都出现白色沉淀,无法鉴别,故D错误。
2.下列实验装置正确的是 ( B )
[解析] A项,二氧化氮能够与水反应,不能采用排水集气法收集二氧化氮,错误;B项,氯化铵和氢氧化钙混合加热,生成氨气,氨气的密度比空气小,可以采用向下排空气法收集,试管口塞棉花防止气体的对流,正确;C项,浓硫酸与乙醇加热时会产生二氧化硫等气体,二氧化硫也能使溴水褪色,应先除去杂质气体再进行检验,错误;D项,收集乙酸乙酯的导气管不能插入溶液中,容易产生倒吸现象,错误。
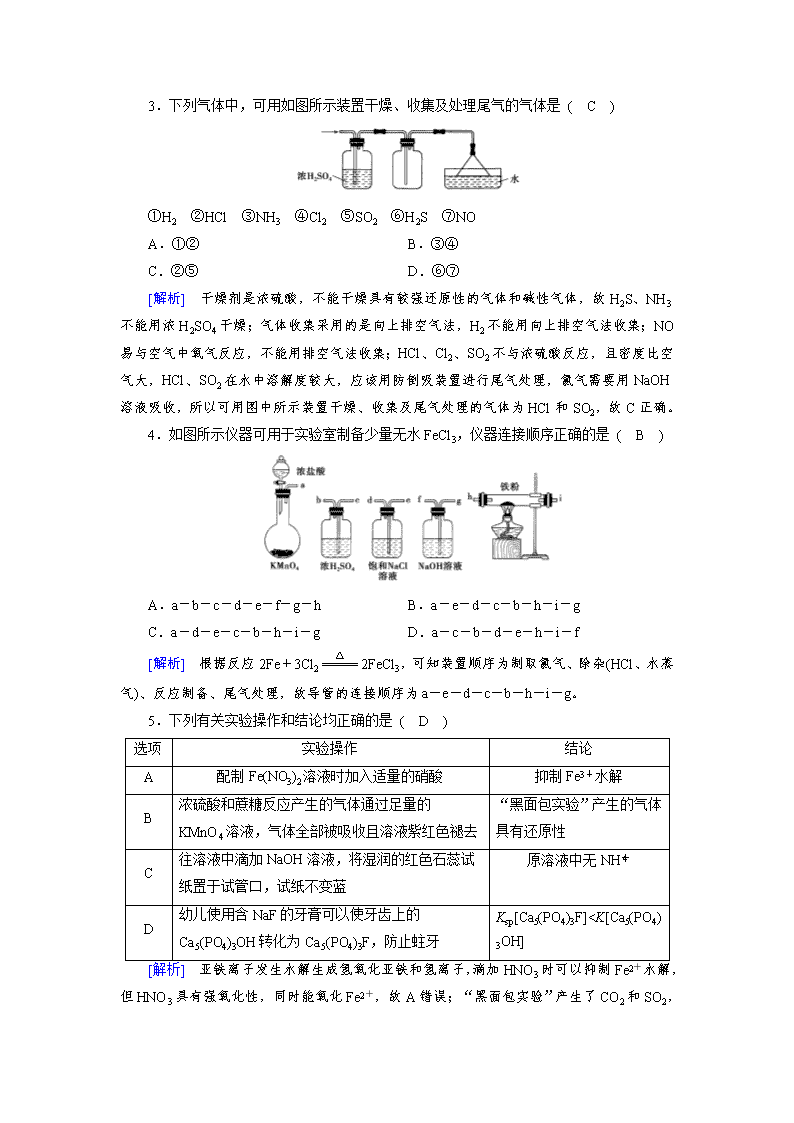
3.下列气体中,可用如图所示装置干燥、收集及处理尾气的气体是 ( C )
①H2 ②HCl ③NH3 ④Cl2 ⑤SO2 ⑥H2S ⑦NO
A.①② B.③④
C.②⑤ D.⑥⑦
[解析] 干燥剂是浓硫酸,不能干燥具有较强还原性的气体和碱性气体,故H2S、NH3不能用浓H2SO4干燥;气体收集采用的是向上排空气法,H2不能用向上排空气法收集;NO易与空气中氧气反应,不能用排空气法收集;HCl、Cl2、SO2不与浓硫酸反应,且密度比空气大,HCl、SO2在水中溶解度较大,应该用防倒吸装置进行尾气处理,氯气需要用NaOH溶液吸收,所以可用图中所示装置干燥、收集及尾气处理的气体为HCl和SO2,故C正确。
4.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是 ( B )
A.a-b-c-d-e-f-g-h B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g D.a-c-b-d-e-h-i-f
[解析] 根据反应2Fe+3Cl22FeCl3,可知装置顺序为制取氯气、除杂(HCl、水蒸气)、反应制备、尾气处理,故导管的连接顺序为a-e-d-c-b-h-i-g。
5.下列有关实验操作和结论均正确的是 ( D )
选项
实验操作
结论
A
配制Fe(NO3)2溶液时加入适量的硝酸
抑制Fe3+水解
B
浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去
“黑面包实验”产生的气体具有还原性
C
往溶液中滴加NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
原溶液中无NH
D
幼儿使用含NaF的牙膏可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙
Ksp[Ca5(PO4)3F]
H3BO3
向Na2CO3溶液中滴入过量H3BO3溶液,无气泡冒出
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没,产生气泡
[解析] 分离胶体与溶液应该用半透膜渗析,A项错误;ZnCl2与Na2S反应后Na2S有剩余,加入CuSO4溶液,剩余的Na2S和CuSO4反应产生黑色沉淀,不能比较两者溶度积的大小,B项错误;根据强酸制弱酸原理,向Na2CO3溶液中滴入H3BO3溶液,无气泡冒出,说明H3BO3不能与Na2CO3溶液反应生成H2CO3,因而不能产生二氧化碳气体,所以能够证明酸性:H2CO3>H3BO3,C项正确;吸氧腐蚀发生在弱酸性或中性条件下,在酸性条件下发生的是析氢腐蚀或化学腐蚀,D项错误。
8.某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行氯化亚铁与氧气反应的探究。已知氯化亚铁的熔点为674 ℃、沸点为1023 ℃;三氯化铁在300 ℃以上易升华,易溶于水并且有强烈的吸水性。在500 ℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为12FeCl2+3O22Fe2O3+8FeCl3。回答下列问题:
(1)仪器C的名称是__干燥管__,连接好装置后,加入药品前的操作为__检验装置的气密性__。
(2)E装置的作用是__冷凝FeCl3并收集__。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色反应,生成该气体的化学方程式为__4FeCl2+3O22Fe2O3+4Cl2__。
(4)待B中充分反应后,停止加热,仍继续通入氧气直至反应管冷却。
则停止加热前是否需要先将D中导管口移出水面,为什么?__不需要;因为O2还在继续通入,不会引起倒吸__。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱:__取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性__(简述方法)。
②利用E装置U形管里的固体配成溶液,制得某种胶体,写出制备该胶体的化学方程式:__FeCl3+3H2OFe(OH)3(胶体)+3HCl__。
[解析] (1)仪器C是干燥管;本实验是涉及气体的实验,连接好装置后,加入药品前要检验装置的气密性。
(2)三氯化铁在300 ℃以上易升华,E装置盛放的是冰盐水,作用是冷凝FeCl3并收集。
(3)装置B中生成红棕色的氧化铁和黄绿色的氯气,生成氯气的化学方程式为4FeCl2+3O22Fe2O3+4Cl2。
(4)待B中充分反应后,停止加热,因为继续通入氧气直至反应管冷却,所以停止加热前不需要先将D中导管口移出水面。
(5)①E装置U形管中收集的物质是氯化铁,取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,证明氯化铁是强酸弱碱盐,即证明Fe(OH)3是弱碱。
②在沸水中加入饱和氯化铁溶液并加热,可制备氢氧化铁胶体,化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl。
B组 能力提升题
9.下列气体的制备和性质实验中,由现象得出的结论错误的是 ( D )
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
[解析] A项,NH3可以用浓氨水和生石灰制取,可用红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,正确;B项,可以制取HCl气体,pH试纸变红,则说明HCl为酸性气体,正确;C项,浓盐酸和二氧化锰加热可以制取Cl2,Cl2可以用湿润的淀粉碘化钾试液检验,试液变蓝,说明KI转化为I2,则说明Cl2有强氧化性,正确;D项,SO2使品红试液褪色体现的是SO2的漂白性,错误。
10.利用如图装置可以进行实验并能达到实验目的的是 ( D )
选项
实验目的
X中试剂
Y中试剂
A
用MnO2和浓盐酸制取并收集纯净干燥的Cl2
饱和食盐水
浓硫酸
B
用Cu与稀硝酸制取并收集纯净干燥的NO
水
浓硫酸
C
用CaO与浓氨水制取并收集纯净干燥的NH3
NaOH溶液
碱石灰
D
CaCO3和稀盐酸制取并收集纯净干燥的CO2
饱和NaHCO3溶液
浓硫酸
[解析] 用MnO2和浓盐酸制取Cl2需要加热,故A错误;由于NO易被空气中的氧气氧化,所以不能使用排空气法收集NO,故B错误;碱石灰呈固态,不能使用Y装置盛放碱石灰,且NH3密度比空气小,集气瓶的导气管应“长进短出”,故C错误;CaCO3和稀盐酸制取的CO2含有HCl和水蒸气,饱和NaHCO3溶液可以除去HCl,浓硫酸可以干燥CO2,所以可以制取并收集纯净干燥的CO2,故D正确。
11.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是 ( C )
选项
实验目的
操作、现象
结论或原因
A
探究FeCl3溶液对H2O2的分解是否有催化作用
将2 mL 5%的H2O2溶液分别放在两支相同的试管中,其中一支浸入热水中,且加入2滴FeCl3溶液,浸入热水中的试管冒出气泡的速率快
FeCl3溶液对H2O2的分解有催化作用
B
分离乙酸(沸点117.9 ℃)和乙醇(沸点78 ℃)的混合物
蒸馏,分别收集78 ℃和117.9 ℃的馏分
沸点不同,且相差较大
C
确定碳、硅两元素的非金属性强弱
常温下测相同浓度的Na2CO3溶液和Na2SiO3溶液的pH,后者pH大
碳的非金属性强于硅的非金属性
D
探究电解池中铁作阳极时铁是否为活性电极
以铁棒作阳极,石墨棒作阴极电解稀硫酸,向阳极区滴加KSCN溶液,溶液出现红色
铁为活性电极
[解析] 验证FeCl3对H2O2分解反应有催化作用时,应保持温度相同,A项错误。乙酸在温度低于117.9 ℃也具有挥发性,收集的乙醇中会含有乙酸,正确的分离方法应是先加入足量的生石灰,然后蒸馏,收集78 ℃的馏分;向残留物中再加入浓硫酸蒸馏,收集117.9 ℃的馏分,B项错误。同浓度的Na2CO3溶液和Na2SiO3
溶液的pH后者大,说明硅酸的水解程度大于碳酸水解程度,则硅酸的酸性弱于碳酸,故可得出碳的非金属性强于硅的结论,C项正确。电解池中铁作阳极时的电极反应为Fe-2e-===Fe2+,向阳极区滴加KSCN溶液,溶液不会出现红色,D项错误。
12.某同学设计了三种制备方案:①用KI晶体与浓硫酸反应制HI ②用浓度均为0.1 mol·L-1的氯化铁和氢氧化钠混合制备氢氧化铁胶体 ③用纯碱和石灰水制烧碱,可用的方案是 ( B )
A.① B.③
C.②③ D.全部
[解析] KI中的I-具有强还原性,不可用氧化性物质浓硫酸制取HI;制备氢氧化铁胶体应把饱和氯化铁溶液滴入沸水中至液体呈红褐色;用纯碱和石灰水反应除去沉淀制烧碱,只有B项正确。
13.利用如图所示装置进行下列实验,能得出相应实验结论的是 ( C )
选项
①
②
③
实验结论
A.
浓盐酸
MnO2
NaBr溶液
氧化性Cl2>Br2
B.
浓氨水
碱石灰
AgNO3溶液
AgOH具有两性
C.
浓硫酸
Na2SO3
FeCl3溶液
SO2具有还原性
D.
稀盐酸
Na2CO3
Na2SiO3
非金属性:
Cl>C>Si
[解析] A项,浓盐酸和二氧化锰反应是在加热的条件下发生的,故不能完成实验;B项,本实验中只在硝酸银溶液中通入了氨气这一种碱性的气体,没有加入酸性的物质,故不能说明AgOH具有两性;C项,可以根据本实验得到实验的结论;D项,稀盐酸和Na2CO3反应生成的CO2中含有氯化氢气杂质,故与Na2SiO3反应生成沉淀的不知道是哪一种气体且应比较HClO4与H2CO3酸性强弱来比较非金属性,得不到正确的结论。
14.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹K1~K4,从两侧通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)A中发生反应的离子方程式为__MnO2+4H++2Cl-Mn2++Cl2↑+2H2O__。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__70%的硫酸中的氢离子比98%的硫酸中的氢离子浓度大__。
(3)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是__乙、丙__(填“甲”“乙”或“丙”)。
过程ⅣB溶液中含有的离子
过程ⅥB溶液中含有的离子
甲
有Fe3+无Fe2+
有SO
乙
既有Fe3+又有Fe2+
有SO
丙
有Fe3+无Fe2+
有Fe2+
(4)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资源:Fe2+(aq)+SO(aq)FeSO3(s)(墨绿色)
提出假设:FeCl3与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为__Na2SO3__、__FeCl3__。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因__Fe3+消耗SO,c(SO)减小,平衡Fe2+(aq)+SO(aq)FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色__。
15.在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。查阅资源知SO3的熔点为16.83 ℃,沸点为44.8℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
请根据要求回答下列问题:
(1)各装置接口的连接顺序是a→__h→i→b→c→f→g→d→e__。
(2)装置Ⅳ烧杯中盛放冰水的作用是__使SO3冷凝以便从气相中分离出来__。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是__硫酸浓度过大时主要以分子形式存在,反应较慢;硫酸浓度过小时生成的SO2会部分溶解在稀硫酸中__。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间。继续通入O2的目的是__将装置中的SO2全部赶入装置Ⅱ中发生反应,将SO3全部赶入装置Ⅳ中冷凝为固体__。
(5)称量a g Na2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重b g,列式表示该实验中SO2的转化率__×100%__。
[解析] (1)各装置接口的连接顺序为:a→h→i→b→c→f→g→d→e,装置Ⅰ的作用是制取SO2并与O2混合,装置Ⅴ的作用是干燥气体,装置Ⅱ中发生SO2的催化氧化反应,装置Ⅳ中收集SO3,装置Ⅲ的作用是吸收尾气。
(2)根据SO3的熔沸点知,装置Ⅳ烧杯中盛放冰水可使SO3冷凝以便从气相中分离出来。
(4)反应过程中装置Ⅰ中会残留SO2,装置Ⅱ中会残留SO3,反应结束后,继续通入氧气一段时间,可以将装置中的SO2全部赶入装置Ⅱ中发生反应,将SO3全部赶入装置Ⅳ中冷凝为固体,避免影响SO2转化率的测定。
(5)n(SO3)= mol,SO2的转化率=÷×100%=×100%。