- 2021-07-05 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
物质的分离与提纯学案
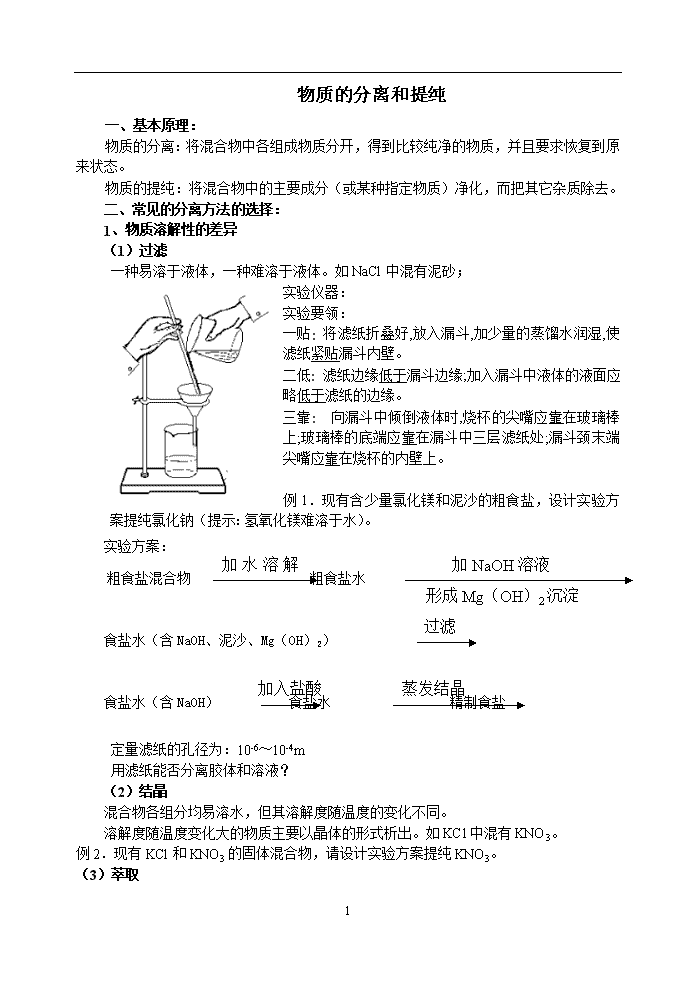
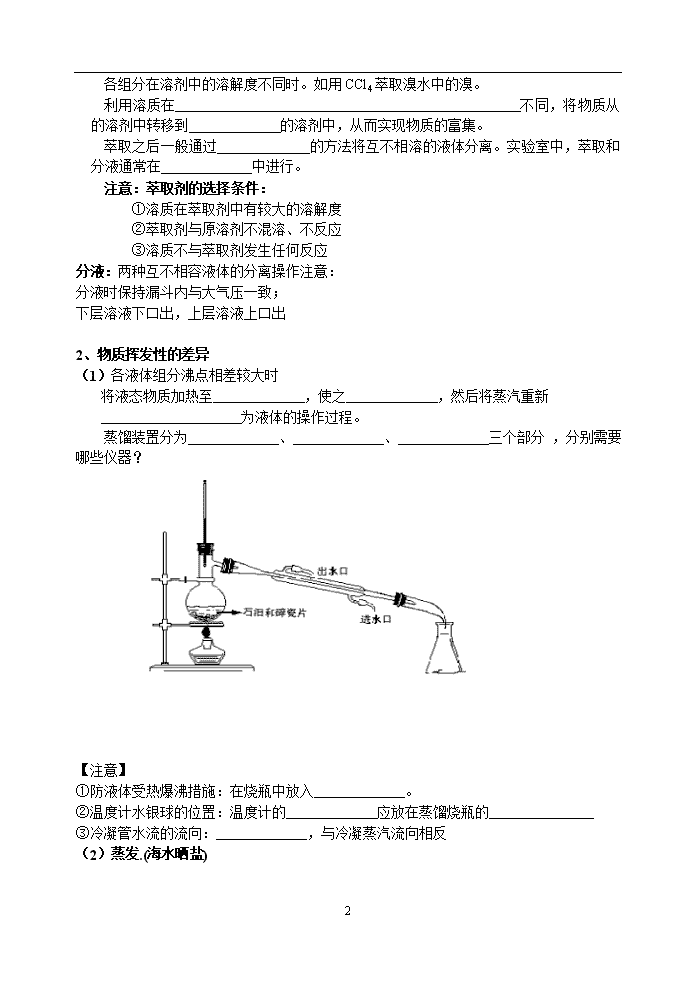
物质的分离和提纯 一、基本原理: 物质的分离:将混合物中各组成物质分开,得到比较纯净的物质,并且要求恢复到原来状态。 物质的提纯:将混合物中的主要成分(或某种指定物质)净化,而把其它杂质除去。 二、常见的分离方法的选择: 1、物质溶解性的差异 (1)过滤 一种易溶于液体,一种难溶于液体。如NaCl中混有泥砂; 实验仪器: 实验要领: 一贴: 将滤纸折叠好,放入漏斗,加少量的蒸馏水润湿,使滤纸紧贴漏斗内壁。 二低: 滤纸边缘低于漏斗边缘;加入漏斗中液体的液面应略低于滤纸的边缘。 三靠: 向漏斗中倾倒液体时,烧杯的尖嘴应靠在玻璃棒上;玻璃棒的底端应靠在漏斗中三层滤纸处;漏斗颈末端尖嘴应靠在烧杯的内壁上。 例1.现有含少量氯化镁和泥沙的粗食盐,设计实验方案提纯氯化钠(提示:氢氧化镁难溶于水)。 加NaOH溶液 加水溶解后 实验方案: 形成Mg(OH)2沉淀 粗食盐混合物 粗食盐水 过滤 食盐水(含NaOH、泥沙、Mg(OH)2) 加入盐酸 蒸发结晶 食盐水(含NaOH) 食盐水 精制食盐 定量滤纸的孔径为:10-6~10-4m 用滤纸能否分离胶体和溶液? (2)结晶 混合物各组分均易溶水,但其溶解度随温度的变化不同。 溶解度随温度变化大的物质主要以晶体的形式析出。如KCl中混有KNO3。 例2.现有KCl和KNO3的固体混合物,请设计实验方案提纯KNO3。 (3)萃取 4 各组分在溶剂中的溶解度不同时。如用CCl4萃取溴水中的溴。 利用溶质在 不同,将物质从 的溶剂中转移到 的溶剂中,从而实现物质的富集。 萃取之后一般通过 的方法将互不相溶的液体分离。实验室中,萃取和分液通常在 中进行。 注意:萃取剂的选择条件: ①溶质在萃取剂中有较大的溶解度 ②萃取剂与原溶剂不混溶、不反应 ③溶质不与萃取剂发生任何反应 分液:两种互不相容液体的分离操作注意: 分液时保持漏斗内与大气压一致; 下层溶液下口出,上层溶液上口出 2、物质挥发性的差异 (1)各液体组分沸点相差较大时 将液态物质加热至 ,使之 ,然后将蒸汽重新 为液体的操作过程。 蒸馏装置分为 、 、 三个部分 ,分别需要哪些仪器? 【注意】 ①防液体受热爆沸措施:在烧瓶中放入 。 ②温度计水银球的位置:温度计的 应放在蒸馏烧瓶的 ③冷凝管水流的流向: ,与冷凝蒸汽流向相反 (2)蒸发.(海水晒盐) 4 (3)升华(分离碘单质与泥沙) 3.层析法 实验原理:根据混合物中各物质的 不同,将溶解在某溶剂的混合物分离出来。 分离提纯方法 适用范围 主要仪器 例子 过滤 不溶性固液混合物 漏斗、滤纸、烧杯、玻璃棒、铁架台 提纯粗食盐 蒸发、结晶 可溶性固体与液体的分离 蒸发皿、玻璃棒、酒精灯 蒸发食盐溶液制得固体食盐 降温结晶 产品和杂质的溶解度随温度变化较大的可溶性固体的分离 蒸发皿、烧杯、玻璃棒、酒精灯、铁架台 KNO3与KCl的分离 萃取、分液 互不相溶的两种液体混合物的分离 烧杯、分液漏斗、铁架台 CCl4萃取溴水中的溴。 蒸馏、分馏 沸点不同的液体混合物的分离 蒸馏烧瓶、酒精灯、温度计、冷凝管、石棉网、接液管、锥形瓶 石油的分馏 【练习】: 1. 下列除杂方法中,正确的是( )A A.用灼烧法除去二氧化锰中混有的炭粉 B.用点燃法除去CO2中混有的少量CO C.将H2和O2混和气体通过赤热的CuO以除去氧气中的氢气 D.干燥H2S中的水蒸气,将混和气通过浓硫酸的洗气瓶 2. 下列分离混合物的操作中,必须加热的是 ( ) A. 过滤 B.升华 C.结晶 D.蒸馏 3.下列实验操作:① 过滤 ② 分液 ③ 萃取 ④ 蒸馏 ⑤ 分馏。不能用于分离相互混溶的溶液的是 ( ) A. ③和④ B. ①和② C. ③、④和⑤ D. ①、②和③ 4.为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,正确的次序是( ) ①加水溶解; ②加热蒸发得到晶体; ③加入过量BaCl2溶液; ④加入过量盐酸; ⑤加入过量K2CO3; ⑥过滤。 A.①⑤③⑥④② B.①⑤③④⑥② C.①③④⑥⑤② D.①③⑤⑥④② 物质提纯的原则为: 4 不增(不引入新的杂质):操作中不能引入新的杂质,由于所加的试剂过量而引入的新杂质而除去。 不减:尽量不减少被提纯和分离的物质。 不变:若被分离或被提纯的物质转化为其他物质,在分离完毕时应将其恢复到原来状态。 4查看更多