2020届一轮复习鲁科版水溶液中的四大常数及其应用作业
水溶液中的四大常数及其应用
1.25 ℃时,用水稀释0.1 mol·L-1 的氨水,溶液中随着水量的增加而减小的是( )
① ②
③[H+][OH-] ④
A.①② B.③
C.③④ D.②④
D [在氨水中存在NH3·H2ONH+OH-的平衡,加水稀释时平衡右移,NH3·H2O的物质的量减小,NH和OH-的物质的量增大,但浓度均减小,由于温度一定,水的离子积KW和电离常数Kb不变,故可借助Kb=,KW=[H+][OH-]判断出②④正确。]
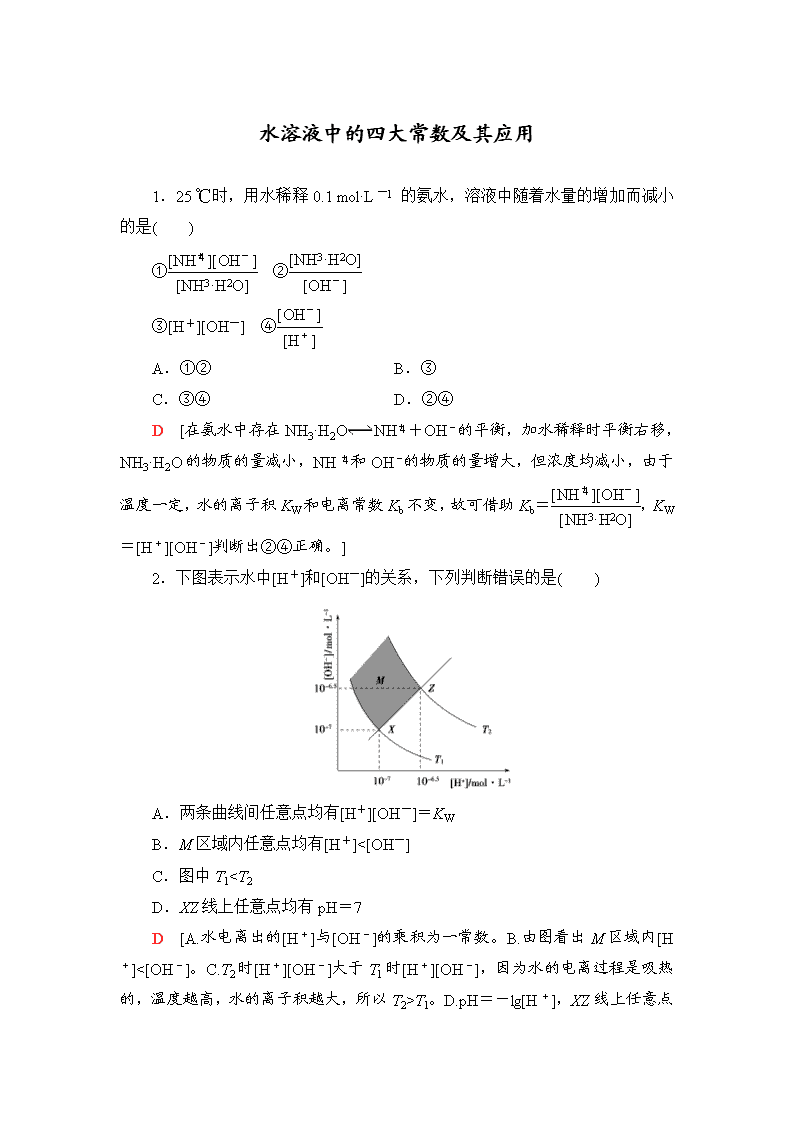
2.下图表示水中[H+]和[OH-]的关系,下列判断错误的是( )
A.两条曲线间任意点均有[H+][OH-]=KW
B.M区域内任意点均有[H+]<[OH-]
C.图中T1
T1。D.pH=-lg[H+],XZ
线上任意点的[H+]=[OH-],但pH不一定为7。]
3.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
HClO4
H2SO4
HCl
HNO3
Ka
3.0×10-8
mol·L-1
6.3×10-9 mol2·L-2
1.6×10-9 mol·L-1
4.2×10-10 mol·L-1
从以上表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
C [硫酸在冰醋酸中存在电离平衡,故电离方程式应用“”连接。]
4.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数Ka
9×10-7 mol·L-1
9×10-6 mol·L-1
10-2 mol·L-1
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
B [A项,Ka越大,酸越强,故HZ>HY>HX;C项,酸越弱,相应的盐水解程度越大,碱性越强,pH越大;D项,Ka只与温度有关,与浓度无关。]
5.常温下,有关物质的溶度积如下
物质
CaCO3
MgCO3
Ca(OH)2
Mg(OH)2
Fe(OH)3
Ksp
4.96×10-9 mol2·L-2
6.82×10-6 mol2·L-2
4.68×10-6 mol3·L-3
5.61×10-12 mol3·L-3
2.64×10-39 mol4·L-4
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,[Mg2+]∶[Fe3+]=2.125×1021
D.无法利用Ca(OH)2制备NaOH
D [A项中Ksp[Mg(OH)2][CH3COOH]>[H2CO3]
B.将相同浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐溶液加水稀释,水解程度均增大,且碱性均增强
C.等浓度的NaClO和NaHCO3混合溶液中:[Na+]=[HClO]+[ClO-]+[HCO]+[CO]+[H2CO3]
D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为2ClO-+CO2+H2O===CO+2HClO
C [酸的电离常数越大,其酸性越强,所以等浓度时,溶液pH:CH3COOH<H2CO3<HClO,则等pH时,浓度由大到小的顺序为[HClO]>[H2CO3]>[CH3COOH],A项错误。稀释过程中酸根离子的水解程度都增大,但溶液中氢氧根离子的浓度都减小,故溶液的碱性都减弱,B项错误。等浓度的NaClO和NaHCO3混合溶液中,根据物料守恒可得[Na+]=[HClO]+[ClO-]+[HCO]+[CO]+[H2CO3],C项正确。由于Ka2(H2CO3)<Ka(HClO),所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳气体的离子方程式为ClO-+CO2+H2O===HClO+HCO,D项错误。]
10.草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用。草酸在100 ℃开始升华,157 ℃时大量升华,并开始分解。已知下表信息:
电离方程式
电离常数/mol·L-1
H2C2O4H++HC2O
K1=5.4×10-2
HC2OH++C2O
K2=5.4×10-5
NH3·H2ONH+OH-
K=1.8×10-5
请回答下列问题:
(1)25 ℃时,(NH4)2C2O4溶液的pH________(填“>”“<”或“=”)7。
(2)草酸钠是一种重要的还原剂。合成草酸钠的操作如下:
草酸 草酸钠晶体
①75%酒精的作用是__________________________________。
②当草酸与碳酸钠按物质的量之比2∶1充分混合后,溶液中pH<7。请将该溶液中离子浓度按由大到小的顺序排列_________________________。
(3)已知某温度下CaC2O4的Ksp为2.5×10-9 mol2·L-2。将0.02 mol·L-1澄清石灰水和0.01 mol·L-1H2C2O4溶液等体积混合,所得溶液中C2O的物质的量浓度为________。
【解析】 (1)由题给表格可知,H2C2O4、HC2O、NH3·H2O的电离常数大小为H2C2O4>HC2O>NH3·H2O,故草酸铵溶液显酸性。(2)①加入酒精是为了降低草酸钠的溶解度,便于晶体析出。②二者反应后溶质为草酸氢钠,因为溶液显酸性,所以HC2O的电离程度大于其水解程度,则离子浓度大小顺序为[Na+]>[HC2O]>[H+]>[C2O]>[OH-]。(3)混合后所得溶液中[Ca2+]=0.005 mol·L-1,Ksp(CaC2O4)=[Ca2+][C2O]=2.5×10-9 mol2·L-2,则溶液中[C2O]= mol·L-1=5×10-7 mol·L-1。
【答案】 (1)<
(2)①降低草酸钠的溶解度,便于晶体析出
②[Na+]>[HC2O]>[H+]>[C2O]>[OH-]
(3)5×10-7 mol·L-1
11.已知Ka、Kb、KW、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是________。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,KW=Ka·Kh
(2)25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中[NH]=[Cl-],则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=________。
(3)已知:25 ℃时,HA的Ka=1×10-6 mol·L-1,则25 ℃时,浓度均为0.01 mol/L的HA与NaA等体积混合,则混合溶液呈________性(填“酸”“碱”或
“中”)。
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38 mol4·L-4、1.0×10-11 mol3·L-3,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液的pH范围是________(已知lg 2≈0.3)。
【解析】 (2)根据[NH]+[H+]=[Cl-]+[OH-]和[NH]=[Cl-]推知[H+]=[OH-],溶液呈中性。
Kb= mol·L-1= mol·L-1。
(3)Kh(A-)== mol·L-1=1×10-8 mol·L-1<Ka,故HA电离程度大于A-的水解程度,溶液呈酸性。
(4)Fe3+完全沉淀时,[OH-]3×1.0×10-5 mol·L-1>8.0×10-38mol4·L-4,[OH-]>(8.0×10-33) mol·L-1=2×10-11mol·L-1,所以pH>3.3;Mg2+不沉淀时,[OH-]2×0.1 mol·L-1<1×10-11 mol3·L-3,
[OH-]<(1×10-10) mol/L=1×10-5 mol/L,所以pH<9,故pH范围为3.3≤pH<9。
【答案】 (1)ad
(2)中 mol/L
(3)酸
(4)3.3≤pH<9
12. (1)根据下表数据做答:
表1 25 ℃时浓度为0.1 mol·L-1两种溶液的pH
溶质
NaClO
Na2CO3
pH
9.7
11.6
表2 25 ℃时两种酸的电离平衡常数
Ka1/mol·L
Ka2/mol·L
-1
-1
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
①根据表1能不能判断出H2CO3与HClO酸性强弱? ________(填“能”或“不能”)。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________________。
(2)已知:Ksp(AgCl)=1.5×10-10 mol2·L-2、Ksp(Ag2CrO4)=2.0×10-12 mol3·L-3;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀。向Cl-和CrO浓度均为0.1 mol·L-1的混合溶液中逐滴加入AgNO3溶液且不断搅拌,实验现象为
________________________________________________________________________。
(3)通过计算判断中和反应:2Fe(OH)3(s)+3H2C2O42Fe3++6H2O+3C2O在常温下能否发生反应________。(已知Ksp[Fe(OH)3]=1.0×10-39mol4·L-4;草酸H2C2O4的Ka1=6.0×10-2 mol·L-1,Ka2=6.0×10-5 mol·L-1;66=4.67×104)
【解析】 (1)①Na2CO3对应的“酸”是HCO,故根据表1不能判断H2CO3和HClO的酸性强弱。②Na2SO3溶液中[Na+]>[SO]>[OH-]>[HSO]>[H+]。③根据电离平衡常数知,酸性:H2SO3>H2CO3>HSO,故NaHCO3溶液和H2SO3溶液反应的主要离子方程式为HCO+H2SO3===HSO+CO2↑+H2O。(2)开始生成氯化银沉淀时[Ag+]=1.5×10-9 mol·L-1,开始生成铬酸银沉淀时[Ag+]= mol·L-1≈4.5×10-6 mol·L-1,故先生成氯化银白色沉淀,随着硝酸银溶液的逐渐加入,Ag+浓度增大,生成砖红色的铬酸银沉淀。
(3)K==
==4.67×10-11 mol2·L-2<1×10-5 mol2·L-2,故反应不能发生。
【答案】 (1)①不能 ②[Na+]>[SO]>[OH-]>[HSO]>[H+] ③H2SO3+HCO===HSO+CO2↑+H2O
(2)先生成白色沉淀,后来变为砖红色
(3)该反应的平衡常数K=4.67×10-11 mol2·L-2<1.0×10-5 mol2·L-2,所以该反应不能发生
13.(1)在温度为t时,某研究人员测定NH3·H2O的电离常数为1.8×10-5 mol·L-1,NH的水解常数为1.5×10-8 mol·L-1,则该温度下水的离子积常数为________,请判断t________(填“>”“<”或“=”)25 ℃。
(2)可溶性钡盐[如BaCl2、Ba(NO3)2等]外观与食盐、纯碱相近,误食会造成钡中毒。中毒患者应尽快用大量Na2SO4溶液洗胃,使Ba2+与SO形成沉淀而解毒,则所用Na2SO4溶液浓度至少为________mol·L-1。[已知:常温下Ksp(BaSO4)=1.1×10-10 mol2·L-2,当某离子浓度低于10-5 mol·L-1时可认为沉淀完全]
【解析】 (1)NH3·H2O的电离方程式为NH3·H2ONH+OH-,Kb==1.8×10-5 mol·L-1,NH的水解方程式为NH+H2ONH3·H2O+H+,Kh==1.5×10-8 mol·L-1,水的离子积KW=[H+][OH-]=Kb×Kh=2.7×10-13 mol2·L-2,25 ℃时水的离子积是1×10-14 mol2·L-2<2.7×10-13 mol2·L-2,水的离子积随温度的升高而增大,则t大于25 ℃。
(2)依题意:[Na2SO4]== mol·L-1=1.1×10-5 mol·L-1。
【答案】 (1)2.7×10-13 mol2·L-2 > (2)1.1×10-5