- 2021-07-05 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习过关训练:电化学基础
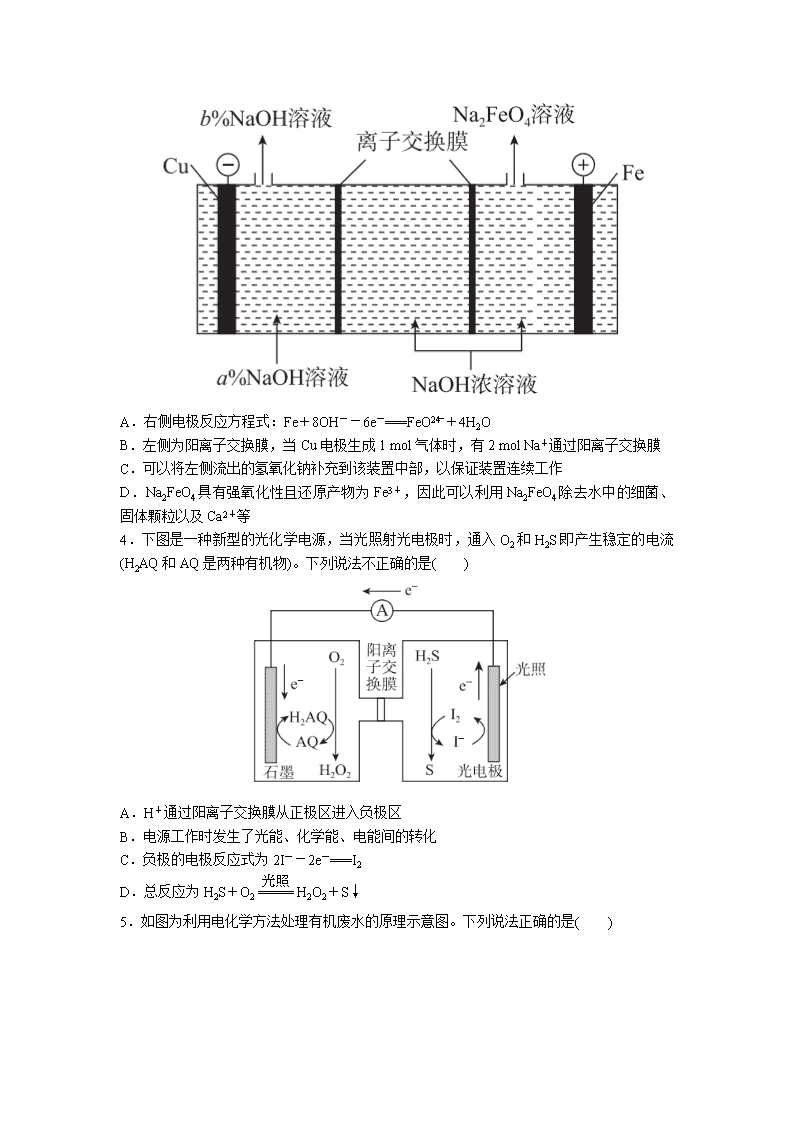
2021 届高考一轮复习化学 电化学基础 一、选择题 1.最近我国成功研制出高效电催化固氮催化剂 Mo2N,如图所示,在 0.1 mol·L-1 盐酸中, 一定电压下具有较高的产氨速率和稳定的电流效率。下列判断错误的是( ) A.石墨电极为阳极 B.P 为阳离子交换膜 C.Mo2N/GCE 电极区的反应式为 N2+6H++6e-===2NH3 D.为提高溶液的导电性,可在石墨电极区加入适量盐酸 2.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO3- 4 +2I-+2H+ ⇌ AsO3- 3 +I2+H2O”设计 成的原电池装置,其中 C1、C2 均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向 图ⅡB 烧杯中逐滴加入适量 40% NaOH 溶液。 下列叙述中正确的是( ) A.甲组操作时,电流表(A)指针发生偏转 B.甲组操作时,溶液颜色变浅 C.乙组操作时,C2 作正极 D.乙组操作时,C1 上发生的电极反应为 I2+2e-===2I- 3.Na2FeO4 是制造高铁电池的重要原料,同时也是一种新型的高效净水剂。在工业上通常 利用如图装置生产 Na2FeO4,下列有关说法不正确的是( ) A.右侧电极反应方程式:Fe+8OH--6e-===FeO2- 4 +4H2O B.左侧为阳离子交换膜,当 Cu 电极生成 1 mol 气体时,有 2 mol Na+通过阳离子交换膜 C.可以将左侧流出的氢氧化钠补充到该装置中部,以保证装置连续工作 D.Na2FeO4 具有强氧化性且还原产物为 Fe3+,因此可以利用 Na2FeO4 除去水中的细菌、固 体颗粒以及 Ca2+等 4.下图是一种新型的光化学电源,当光照射光电极时,通入 O2 和 H2S 即产生稳定的电流 (H2AQ 和 AQ 是两种有机物)。下列说法不正确的是( ) A.H+通过阳离子交换膜从正极区进入负极区 B.电源工作时发生了光能、化学能、电能间的转化 C.负极的电极反应式为 2I--2e-===I2 D.总反应为 H2S+O2===== 光照 H2O2+S↓ 5.如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( ) A.a、b 极不能使用同种电极材料 B.工作时,a 极的电势低于 b 极的电势 C.工作一段时间之后,a 极区溶液的 pH 增大 D.b 极的电极反应式为 CH3COO-+4H2O-8e-===2HCO- 3 +9H+ 6.按如图所示进行实验,下列说法不正确的是( ) A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 B.装置甲、乙中的能量变化均为化学能转化为电能 C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转 D.装置乙中负极的电极反应式:Zn-2e-===Zn2+ 7.关于图中装置说法正确的是( ) A.装置中电子移动的途径:负极→Fe→M 溶液→石墨→正极 B.若 M 为 NaCl 溶液,通电一段时间后,溶液中可能有 NaClO C.若 M 为 FeCl2 溶液,可以实现石墨上镀铁 D.若 M 是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 8.用惰性电极分别电解下列各物质水溶液一小段时间后,向剩余电解质溶液中加入适量 水,能使溶液恢复到电解前浓度的是 A.AgNO3 B.Na2SO4 C.CuCl2 D.KI 9.下图是利用盐桥电池从某些含碘物质中提取碘的两个装置 下列说法中正确的是 A.两个装置中,石墨 I 和石墨Ⅱ均作负极 B.碘元素在装置①中被还原,在装置②中被氧化 C.装置①、②中的反应生成等量的 I2 时,导线上通过的电子数之比为 1∶5 D.装置①中 MnO2 的电极反应式为 MnO2+2H2O+2e−=Mn2++4OH− 10.500mL KNO3 和 Cu(NO3)2 的混合溶液中 c(NO−3)=0.6mol·L−1,用石墨作电极电解此溶 液,当通电一段时间后,两极均收集到 2.24L 气体(标准状况下),假定电解后溶液体积仍 为 500mL,下列说法正确的是 A.原混合溶液中 c(K+)为 0.2mol·L−1 B.上述电解过程中共转移 0.2mol 电子 C.电解得到的 Cu 的物质的量为 0.05mol D.电解后溶液中 c(H+)为 0.2mol·L-1 11.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解 NaB(OH)4 溶液可制备 H3BO3,其工作原理如图。下列叙述错误的是 A.M 室发生的电极反应式:2H2O-4e−=O2↑+4H+ B.N 室:a0 ②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)ΔH2<0 ③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3 氢化过程中所需的高纯度 H2 可用惰性电极电解 KOH 溶液制备,写出产生 H2 的电极名称 ________( 填 “ 阳 极 ” 或 “ 阴 极 ”) , 该 电 极 反 应 方 程 式 为 ________________________________。 参考答案 一、选择题 1.D 解析:D [由图可知,Mo2N/GCE 电极上 N2 被还原生成 NH3,则 Mo2N/GCE 电极是阴 极,石墨电极是阳极,A 正确;阴极上生成 NH3,则 Mo2N/GCE 电极区的反应式为 N2+ 6H++6e-===2NH3,C 正确;阳极反应式为 2H2O-4e-===4H++O2↑,阳极产生 H+,阴 极消耗 H+,H+要透过隔膜 P 向左侧移动,故 P 为阳离子交换膜,B 正确;在石墨电极区 加入适量盐酸,石墨电极上 Cl-发生氧化反应生成 Cl2,产生污染性气体,D 错误。] 2.D 解析:D [装置Ⅰ中的反应,AsO3- 4 +2I-+2H+ ⇌ AsO3- 3 +I2+H2O,当加入适量浓盐酸 时,平衡向右移动,有电子转移,但电子不会沿导线通过,所以甲组操作时,电流表(A)指 针不会发生偏转,但由于 I2 浓度增大,所以溶液颜色变深;向装置ⅡB 烧杯中加入 NaOH 溶液中,C2 上发生:AsO3- 3 -2e-+2OH-===AsO3- 4 +H2O,电子沿导线到 C1 棒,I2+2e- ===2I-,所以 C2 为负极,C1 为正极。] 3.D 解析:D 解析:根据图示,Cu 电极为阴极,Fe 电极为阳极,右侧电极为 Fe 电极,Fe 失 去电子发生氧化反应生成 FeO2- 4 ,结合原子守恒和电荷守恒可得电极反应式为 Fe-6e-+ 8OH-===FeO2- 4 +4H2O,A 项正确;左侧为阴极室,H+的放电能力大于 Na+,Cu 电极上的 电极反应式为 2H2O+2e-===H2↑+2OH-,当 Cu 电极上生成 1 mol 气体时,同时产生 2 mol OH-,此时中部有 2 mol Na+通过阳离子交换膜进入阴极室平衡电荷,B 项正确;根据 B 项分析,阴极室生成 NaOH,左侧流出的 NaOH 溶液的浓度大于加入的 NaOH 溶液的浓 度,即 b%>a%,根据图示可将左侧流出的 NaOH 补充到该装置中部,以保证装置连续工 作,C 项正确;Na2FeO4 具有强氧化性,可利用 Na2FeO4 除去水中的细菌,Na2FeO4 的还原 产物为 Fe3+,Fe3+水解生成 Fe(OH)3 胶体,Fe(OH)3 胶体可吸附固体颗粒,但二者均不能除 去水中的 Ca2+,D 项错误。 4.A 解析:A 解析:由电子流向可知石墨电极为正极,光电极为负极;负极上碘离子失电子 被氧化,电极反应为 2I--2e-===I2,生成的碘可与硫化氢发生反应;正极 AQ 得电子被还 原生成 H2AQ,H2AQ 与氧气反应生成 AQ 和过氧化氢,总反应为 H2S+O2===== 光照 H2O2+ S↓。原电池工作时,阳离子向正极移动,A 项错误;由图像可知电源工作时发生了光能、 化学能、电能间的转化,B 项正确;通过以上分析可知,C、D 项正确。 5.D 6.B 7.B 解析: B 解析 装置中电子移动的途径:负极→Fe 电极,石墨→正极,溶液中通过离子导电,电子 不通过溶液,A 错误;若 M 为 NaCl 溶液,通电一段时间后,阳极产生 Cl2,溶液中的 NaOH 与阳极产生的 Cl2 发生反应生成 NaCl 和 NaClO,所以溶液中可能有 NaClO,B 正 确;若 M 为 FeCl2 溶液,在阳极,溶液中的 Cl-失去电子生成 Cl2,所以不可能实现石墨上 镀铁,C 错误;若 M 是海水,该装置是电解池,是通过外加电流的阴极保护法使铁不被腐 蚀,不是通过“牺牲阳极的阴极保护法”,D 错误。 8.B 解析:B 【解析】电解 AgNO3 生成银和氧气和硝酸,电解一段时间后需要加入氧化银才能恢复电解 前的浓度,不能只加入水,故错误;电解 Na2SO4 溶液实际就是电解水,所以电解一段时间 后加入适量的水能恢复原来的浓度,故正确;电解 CuCl2 生成铜和氯气,所以电解一段时 间后需要加入氯化铜才能恢复电解前的浓度,故错误;电解 KI 生成氢气和碘和氢氧化钾, 电解一段时间后需要加入碘化氢才能恢复原来的浓度,故错误。故选 B。 9.C 解析:C 【解析】两个装置中,①中左边碘离子化合价升高变为单质碘,因此石墨 I 作负极,②中 左边碘酸根离子化合价降低变为单质碘,因此石墨Ⅱ作正极,故 A 错误;碘元素在装置① 中化合价升高,被氧化,在装置②中化合价降低,被还原,故 B 错误;装置①、②中的反 应生成 1mol 的 I2 时,导线上通过的电子数物质的量分别为 2mol 和 10mol,导线上通过的 电 子 数 之 比 为 1 ∶ 5 , 故 C 正 确 ; 装 置 ① 中 MnO2 的 电 极 反 应 式 应 该 为 MnO2+4H++2e−=Mn2++2H2O,故 D 错误。综上所述,答案为 C。 10.A 解析:A 【解析】电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜 离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,气体的物质的量为 2.24L÷22.4L/mol=0.1mol;每生成 0.1mol 氧气转移 0.4mol 电子,每生成 0.1mol 氢气转移 0.2mol 电子,每生成 1mol 铜转移 2mol 电子,所以根据转移电子守恒得铜的物质的量=(0.4- 0.2)/2mol=0.1mol,则铜离子的物质的量浓度为 0.1mol÷0.5L=0.2mol/L,根据电荷守恒得 钾 离 子 浓 度 =0.6mol·L−1-0.2mol·L−1×2=0.2mol/L , A 正 确 ; 转 移 电 子 的 物 质 的 量 =0.1mol×4=0.4mol,错误;根据以上分析知,铜的物质的量为 0.1mol,错误;当电解硝酸 铜时溶液中生成氢离子,当电解硝酸钾溶液时,实际上是电解水,所以电解后氢离子的物 质的量为氧气的 4 倍,为 0.1mol×4=0.4mol,则氢离子浓度为 0.8mol/L,错误;答案选 A。 11.D 解析:D 【解析】M 室中石墨电极与电源正极相连,石墨为阳极,电解质溶液为稀硫酸,电解时阳 极上水失电子生成 O2 和 H+,电极反应式为 2H2O-4e−=O2↑+4H+,故 A 正确;N 室中石墨电 极与电源负极相连,石墨为阴极,电解质溶液为 NaOH 溶液,电解时阴极上水得电子生成 H2 和 OH−,原料室中的 Na+通过 c 膜进入 N 室,溶液中 NaOH 的浓度增大,所以 N 室:a <b,故 B 正确;由题意及离子移动方向规律,原料室中的[B(OH)4]−通过 b 膜进入产品 室 , M 室 H+ 通 过 a 膜 进 入 产 品 室 , 二 者 发 生 反 应 生 成 H3BO3 , 离 子 方 程 式 为 : [B(OH)4]−+H+ H3BO3+H2O,故 C 正确;由[B(OH)4]−+H+ H3BO3+H2O,理论上每生成 1mol 产品(H3BO3),会消耗 1mol H+,M 室要生成 1mol H+,由 M 室电极反应式 2H2O-4e−=O2↑+4H+可得,失去 1mol 电子,串联电路中根据得失电子守 恒,N 室必然得到 1mol 电子,由 N 室电极反应式 2H2O+2e−=H2↑+2OH−可得,N 室生成 0.5mol H2,即阴极室生成的气体在标准状况的体积是 11.2L,故 D 错误。故选 D。 12.B 解析:B 【解析】A.根据总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可知,Ag 的化合价升 高,被氧化,为原电池的负极,错误;B.式中 5MnO2 得电子生成 Na2Mn5O10,化合价共 降低了 2 价,所以每生成 1mol Na2Mn5O10 转移 2mol 电子,正确;C.在原电池中阴离子向 负极移动,阳离子向正极移动,错误;D.Ag 的化合价升高,被氧化,AgCl 是氧化产物, 错误。 【点睛】考查原电池的工作原理,氧化还原反应中电子的转移、电解质溶液中离子的移动 方向等问题。 13.A 解析:A 【解析】锂比铝的金属性强,可知负极的电极反应式为 Li-e- Li+,将负极反应式和正极反 应式联立,可得电池总反应式为 2Li+FeS Li2S+Fe,A 项正确,C 项错误;Li-Al 作为合金,其结 构类似金属单质,Li 元素的化合价为 0 价,B 项错误;充电时该装置相当于电解池,阴极应为原 电池的负极,发生还原反应 Li++e- Li,D 项错误。 二、非选择题 14. (1)Li++FePO4+e-===LiFePO4 (2)NO2+NO- 3 -e-===N2O5 (3)Al-3e-+4OH-===AlO- 2 +2H2O 15. (1)Fe3++e-===Fe2+,4Fe2++O2+4H+===4Fe3++2H2O 5.6 (2)①K1 2H2O+2e-===H2↑+2OH- ③制 H2 时,电极 3 发生反应:Ni(OH)2+OH--e- ===NiOOH+H2O。制 O2 时,上述电极反应逆向进行,使电极 3 得以循环使用 (3)阴极 2H2O+2e-===H2↑+2OH-(或 2H++2e-===H2↑) 解析 (1)由题图中 H+的移动方向知,左端的电极反应为 Fe3++e-===Fe2+,应为阴极,接 电源负极,右端的电极反应为 2HCl-2e-===Cl2+2H+,应为阳极,接电源正极,负极产生 的 Fe2+进一步被 O2 氧化生成 Fe3+,则 4Fe2++O2+4H+===4Fe3++2H2O;由此可知,每消 耗 1 mol O2,需转移 4 mol 电子,则转移 1 mol 电子时,应消耗1 4 mol O2,标准状况下,1 4 mol O2 的体积为1 4 mol×22.4 L/mol=5.6 L。 (2)①电解时,阴极产生 H2,即电极 1 产生 H2,此时开关连接 K1,阴极 H2O 得电子生成 H2,电极反应式为 2H2O+2e-===H2↑+2OH-。 ③连接 K1 时,电极 3 反应为 Ni(OH)2-e-+OH-===NiOOH+H2O;当连接 K2 制 O2 时,电 极 3 反应为 NiOOH+e-+H2O===Ni(OH)2+OH-。由以上电极反应可看出,不同的连接方 式,可使电极 3 循环使用。 (3)电解 KOH 溶液制 H2,实质是电解水。生成 H2 的一极为阴极,反应为 2H2O+2e - ===H2↑+2OH-或 2H++2e-===H2↑。查看更多