- 2021-07-05 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省天一大联考高二下学期阶段性测试(三)(4月)化学 Word版
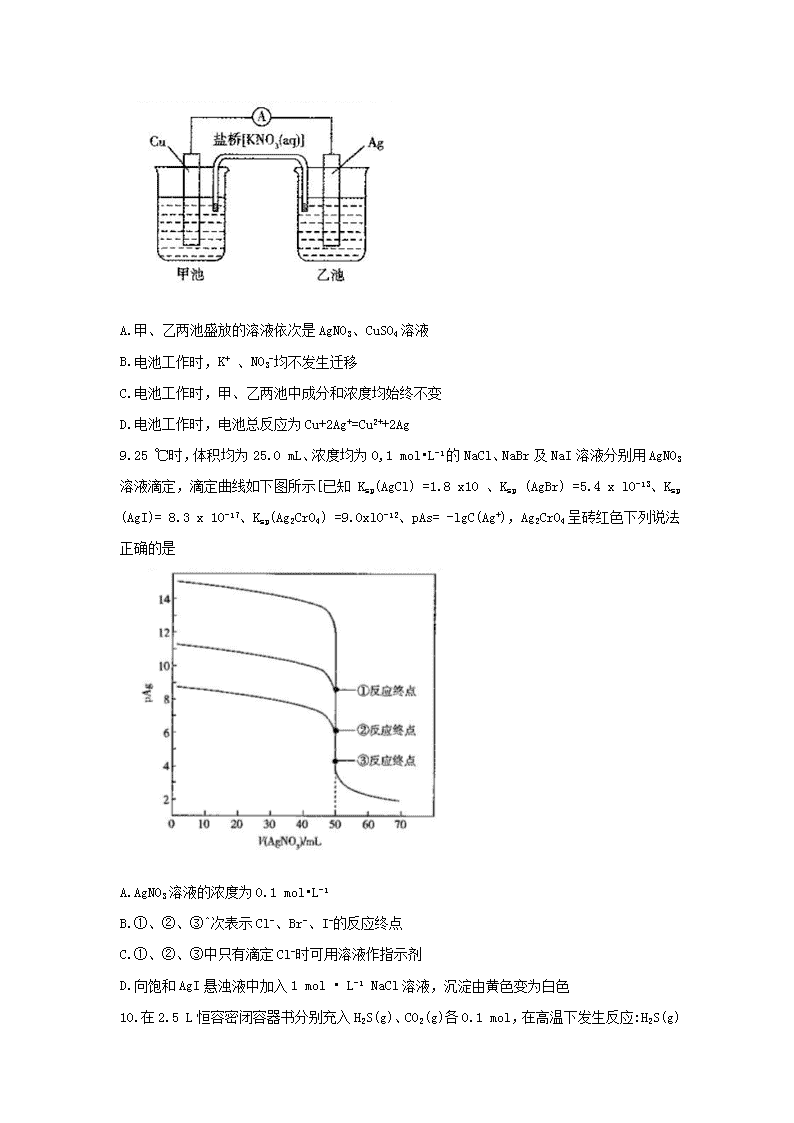
天一大联考 2017—2018学年高二年级阶段性测试(三) 化学 考生注意: 1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。 2.回答选择题时,选出每小题答案后,用铅笔杷答題卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选条其他答案标号。回答非选择題时,将答案写在答题卡上。写在本试卷上无效。 3.考试结束后,将本试卷和答題卡一并交同。 可能用到的相对及子质量:H 1 C 12 0 16 Se 79 Hg 201 一、选择题:本题共16小题,分为必做题和选做题两部分,其中1-12题为必做题,每个试题考生都必须作答; 13-16题为选做题,考生根据要求作答。每小题所铪的四个选项中,只有一项符台题目要求。每小题3 分,共48分。 1.一种“将阳光和水转化为氢燃料”的新技术原理如下图所示。下列说法正确的是 A.氢能是二次能源 B.图中能量转化方式只有一种 C.水分解为氢气和氧气的同时放出能量 D.装置工作时需不断补充CoFe204和FeAl204 2.硫化钠是实验室常用试剂。下列有关0.1 mol•L-1 Na2S溶液的说法正确的是 A.10℃时c(S2-)比25℃时小 B.加水稀释,溶液pH不断增大 C. c (S2-) >c(HS-) >c(H2S) D. c(Na+)> +c(H+) =c(S2-) +c(HS-) +c(0H-) 3. C3H6(丙烯)是液化石油气的主要成分之一。25℃101kPa3时1.0 g丙烯完全燃烧,生成了稳定的氧化物,释放了 45.761 kJ热量。下列热化学方程式正确的是 4.下列说法正确的是 A.电解精炼铜时,粗铜与外加直流电源的负极相连 B.镀层破损后,镀锌铁片中铁比镀锡铁片中铁更耐腐蚀 C.为减缓地下输油钢管镑蚀,将钢管与外加直流电源的正极相连 D.银质奖牌表面键金时,可将奖牌与外加直流电源的正极相连 5.恒容密闭容器中进行反应c(s) +NH3(g)=HCN(g) +H2(g),不能说明该反应已达到平衡状态的是 B.容器内压强不再随时间变化而变化 C.气体的密度不再随时间变化而变化 D.单位时间内断裂的N—H键与断裂的H—H键数目之比为3:1 6.下列指定的离子方程式正确的是 7.常温下,下列各组离子在指定溶液中能大量共存的是 8.铜棒和银棒及AgN03和CuS04溶液可构成铜银原电池(如下图)。下列说法正确的是 A.甲、乙两池盛放的溶液依次是AgNO3、CuSO4溶液 B.电池工作时,K+ 、N03-均不发生迁移 C.电池工作时,甲、乙两池中成分和浓度均始终不变 D.电池工作时,电池总反应为Cu+2Ag+=Cu2++2Ag 9.25 ℃时,体积均为25.0 mL、浓度均为0,1 mol•L-1的NaCl、NaBr及NaI溶液分别用AgN03溶液滴定,滴定曲线如下图所示[已知 Ksp(AgCl) =1.8 x1O 、Ksp (AgBr) =5.4 x lO-13、Ksp (AgI)= 8.3 x 10-17、Ksp(Ag2CrO4) =9.0xl0-12、pAs= -lgC(Ag+),Ag2CrO4呈砖红色下列说法正确的是 A.AgN03溶液的浓度为0.1 mol•L-1 B.①、②、③^次表示Cl-、Br-、I-的反应终点 C.①、②、③中只有滴定Cl-时可用溶液作指示剂 D.向饱和AgI悬浊液中加入1 mol • L-1 NaCl溶液,沉淀由黄色变为白色 10.在2.5 L恒容密闭容器书分别充入H2S(g)、C02(g)各0.1 mol,在高温下发生反应:H2S(g) +C02(g)=COS(g) +H20(g)5据图判断,下列有关说法正确的是 A.由图甲可知该反应正反应的活化能为276. 5 kJ • mol-1 B.由图乙可知0 一 t min 时平均速率 v( COS) = mol•L-1•min-1 C.由图丙可确定t1min时改变的条件一定是加入催化剂 D.由图丁可确定横坐标x可能是n(C02)/n(H2S) 11.由下列实验及现象不能推出相应结论的是 12.NaOH和Na2S03具有很强的脱除S02的能力,失效后可通过膜电解进行再生(装置如下图所示)。下列说法正确的是 A.“CM”为阴离子透过膜 B.装置工作时,阴极室PH减小 C.阳极发生的反应为SO32-+H20-2e-=S042-+2H+ D.中间室流出液的主要成分为NaHS03和H2S03 以下为选做题。请考生从A、B两钽中任选_组作答,不得交叉选择,若两组都做,则按第一组评分。 选做题 A组 选修3 物质结构与性质 13下列有关说法正确的是 A.电负性:Si>N B.第一电离能:S>P C.熔点:NaCl>KJBr D.在水中的溶解性:CH3OCH3> C2H5OH 14.下列说法正确的是 A.HBrO的酸性比HBr03的强 B.鉴别晶体与非晶体可用X -射线衍射实验 C.钾焰色反应的紫色辐射波长比钠焰色反应的黄光的波长要长 D.元素周期表中s 区、d区及ds区一定都是金属元素 15. W、X、Y、Z是元素周期表中原子序数依次增大的前四周期元素,基态W原子核外有3个来成对电子,X 是元素周期表所有元素中电负性最大的.Y与X同主族,基态1原子最外层只有〖个电子,其余各电子层(n)电子数均满足2n2个。下列说法正确的是 A. WX3分子为极性分子 B. X的简单氢化物的沸点比Y的低 C.晶体中金属Z的堆积模型与金属钠相同 D.基态Z中占据能层能最最高的电子的电子云轮廓为哑铃形 16.某配合物化学式为[RE2(Pro)6(H20)4 ] (C104)6.化学式中RE代表稀土元素Pr<镨)和Er(铒),Pw为脯氨酸(结构如右图所示)。下列说法不正确的是 A. Pro存在手性异构体 B. C104-的空间几何构型为正四面体 C. Pro和H20与RE3+以配位键结合 D. 1个Pro分子中含有10个cr键 选做题 B组 选修5 有机化学基础 13.化学与生活密切相关,下列有关说法正确的是 A.食品保鲜膜的主要成分为聚氯乙烯 B.油脂、糖类及蛋白质均属于高分子化合物 C.医用酒精中乙醇的体积分数为75% D.家用天然气中添加有特殊气味的物质,可促进气体完全燃烧 14. 一种香豆素衍生物的结构简式如图所示,下列有关说法正确的是 A.该有机物分子中冇三种含氧官能团 B.能与FeCl3溶液发生显色反应 C. 1 mol该有机物最多可与1 mol Br,反应 D. 1 mol该有机物最多可与3 mol NaOH反应 A.m、p的一氯取代物均只有3种 B. p、q中所有碳原子均位于同一平面 C. m、p、q均能与Br2的CC14溶液反应 D. m、n、p、q中能与酸性高锰酸钾溶液反应的只有2种 16.下列实验操作及得出的结论均正确的是 二、非选择题:本题共5小题,分为必做题和选做题。其中17-19题是必做题,每个试题考生都必须作答。 20、21题是选做题,考生根据选择题从A、B两组中选一组作答,且与选择题部分所选一致。不得交叉选择,若两组都做,则按所做的第一组评分。 17.(11分)盐酸、醋酸(pKa=-1gKa=4.75)、氨水(pKb =-1gKb=4.75)及氢氧化钠均是实验室常用试剂。回答下列问题: (1)常温下,将下列溶液等体积混合,所得溶液的pH =7的是 (填字母)。 a. pH =3的盐酸与pH =11的氨水 b. pH =3的醋酸与pH = 11的氨水 c. pH =3的盐酸与pH = 11的氣氧化钠溶液 d. pH =3的醋酸与pH = 11的氢氧化钠溶液 (2)常温下,在两个锥形瓶中分别盛有25.00 tnLpH均为3的盐酸和醋酸,分别用0. 001 0 mol•L-1 NaOH溶液滴定至终点, (填“盐酸”或“醋酸”)消耗NaOH溶液多。 (3)将50.5 mL pH=3的盐酸与49.5 mL pH = 11的NaOH溶液混合,所得溶液的pH为 (假设溶液总体积具有加和性) (4)用0.100 mol • L-1盐酸滴定25.00 mL 0.100 mol •L-1氯水的滴定曲线如下图所示。 ①滴定可用的指示剂为 (填“甲基橙”或“酚酞”) ②A点由水电离产生的c(H+)是 mol •L-1。 ③B点溶液中离于浓度由大到小的顺序为 。 18. (11分)Cu20是一种红棕色粉末,CuCl是一种微溶于水的白色粉末,它们都是用途非常广泛的一价铜的化合物。回答下列问题: ①阳极的电极材料是 ,阴极的电极反应式为 。 ②阳极上发生一系列连续反应.其反应机理如下: (I) (填方程式) (3)实验室可用CuSO4、NaCl及Na2S03反应制取CuCl,生成CuCl的离子方程式为 。 (4)反应2CuCl(s) +Hg22+ (aq)=Hg2Cl2(S) +2Cu+(aq)达到平衡时,平衡常数 K≈ 。 [已知Ksp(CuCl) =1.2xlO-6、Ksp (Hg2Cl2)=1.3x10-10保留 2 位有效数字]。 19.(12分)乙撤工业是石油化工产业的核心。回答下列问题: (1)由丙烷气裂解得到乙烯和甲烷气体的热化学方程式为 。 通过煤制合成气、合成气制甲醇,再由甲醇分解可制备乙烯。 ①一种生产=合成气的反应:C(s) +H20(g)—CO(g) +H2(g),该反应在高温下可自发进行,该反应的 (填字母)。 ②在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g)=C2H4(g)+2H20(g),依据表中的相关数据可确定该反应的△H 0(填“ >”“ <”或“=”,下同);容器C达到平衡时。 容器中总压强P(C)/>p(A) 2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H20(g)各0.1 mol,此时v(正) v(逆)。 (3)乙醇脱水可发生如下反应: 平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压-总压×物隄的量分数)lnKp= logeKp,e≈2.718,≈1.65]及产物选择性如下图所示: ①脱水制乙烯的反应属于 反应(填“吸热或“放热”)。 ②读图2,乙酵脱水反应用分子筛催化剂(活化温度范围373 - 523 K),欲制备乙烯应控制的温度为 。 ③图1中A点反应物及产物浓度间应满足的关系是 。 选做题 A组 选修3 物质结构与性质 20. (8 分)已知反应 K2Cr207 + 3H2C204 +4H2S04 =K2SO4+ Cr2(S04)3 +6C02↑ +7H20。回答下列问题: (1)基态Cr原子价电子轨道表达式(电子排布图)为 ;铬的第二电离能L2(Cr)比锰的及(Mn)大,其原因是 。 (2)钠和钾处于同主族,但纳的熔点和沸点均比钾高,原因是 。 (3)从轨道重叠方式看,乙二酸H2C204中所含共价键的类型有 ;与CO2互为等电子体的分子有 (写出一种即可)。 21.(10分)硫、硒(Se)及其化合物用途非常广泛。回答下列问题: (1)基态S原子核外电子排布式为[Ne] ,未成对电子数为 个。 (2)ZnS1-xFex是一种半导体。Zn、S、Se的电负性从大到小的顺序为 。 (3)Se与0、S、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图像所示变化的原因是 。 (4)晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置,下图为硒化汞的晶胞,其中原子坐标参数A为 (0,0,0),8为(, ,)。则C原子的坐标参数为 。 ②晶胞参数,描述晶胞的大小和形状,已知硒化汞的密度为p g•cm-3,其晶胞参数为a= nm(设阿伏加德罗常数的值为NA,用含p、NA的代数式表示)。 选做题 B组 选修5 有机化学基础 20.(8分)实验室以乙酸和正丁醇为原料制备乙酸正丁酯的流程如下: 回答下列问题: (1)反应的回流装置如下图,冷却水从接口 (填字母)进入,反应过程中及时从油水分离器中分离出水的目的是 。 (2)反应过程中除生成乙酸正丁酯外,还可能发生的副反应是 .(写出一个化牵方程式即可) (3)“分液”时用到的主要玻璃仪器是 、烧杯。 (4)再水洗”的目的是 。 (5)本次实验的产率为 。 21. (10分)茚虫威是最新研制的高效杀虫剂,由芳香化合物A等为原料合成,其中间体H的一种合成路线如下: 已知下列信息: ①B能与NaHCO3反应产生C02,又能使Br2的CC14溶液褪色。 回答下列问题: (1)A的化学名称是 。 (2)B生成C、E生成¥的反应类型依次是 、 。 (3)D的结构简式为 ,F的结构简式为 。 (4)B在催化剂作用下能生成高分子化合物,该反应的化学方程式 为 。 (5)分子式为C3H603且含有酯基的有机物有 种(不含一0—0—,不包括立体结构),其中G的核磁共振氢谱只有一组峰,则G的结构简式为 。查看更多