- 2021-07-05 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习无机物的结构、性质、用途作业
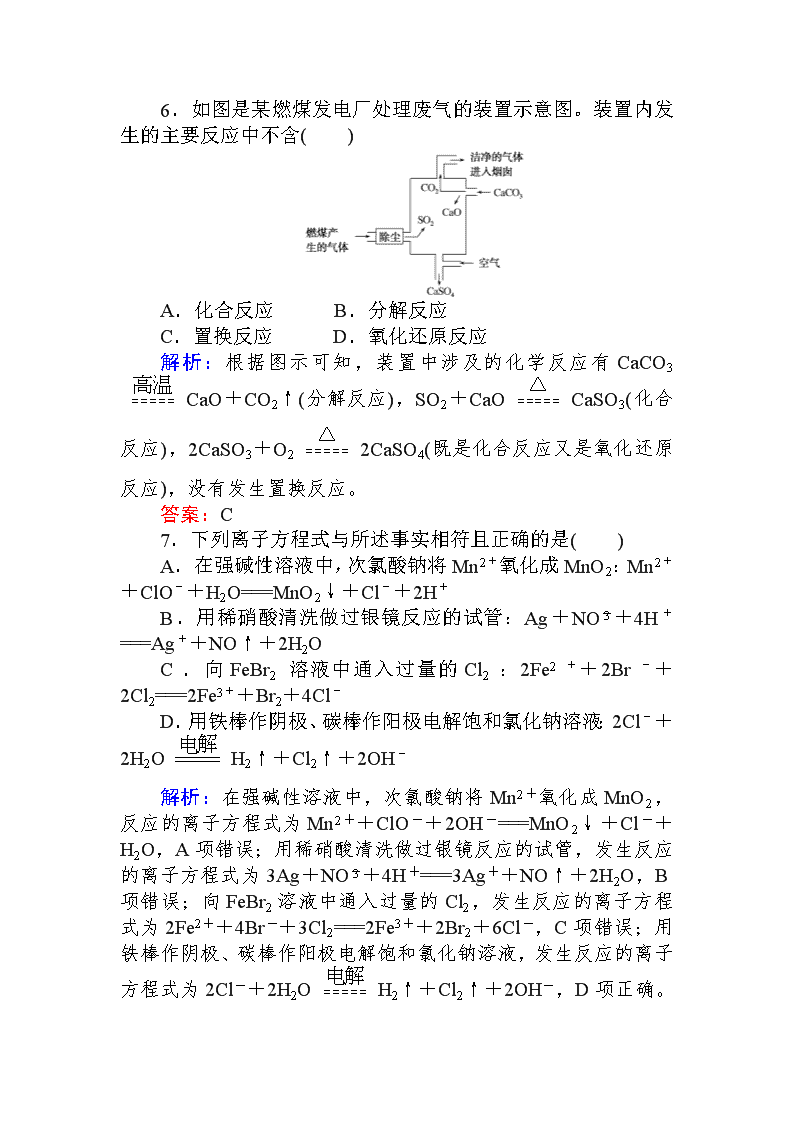
题型层级练3 无机物的结构、性质、用途 授课提示:对应学生用书125页 (A级) 1.下列物质性质与应用对应关系正确的是( ) A.钠和钾的合金具有导电性,可用于快中子反应堆热交换剂 B.明矾溶于水能产生Al(OH)3胶体,可用作净水剂 C.甲醛能使蛋白质变性,可用于食品防腐剂 D.水玻璃易溶于水,可用于生产黏合剂和防火剂 解析:本题考查钠钾合金、明矾、甲醛以及水玻璃的性质和应用。钠和钾的合金用于快中子反应堆热交换剂是利用其导热性,A项错误;明矾用于净水,B项正确;甲醛有毒,不能用于食品防腐剂,C项错误。 答案:B 2.下列应用不涉及氧化还原反应的是( ) A.Na2O2用作呼吸面具的供氧剂 B.工业上电解熔融状态的Al2O3制备Al C.工业上利用合成氨实现人工固氮 D.实验室用NH4Cl和Ca(OH)2反应制备NH3 解析:Na2O2用作呼吸面具的供氧剂,过氧化钠和二氧化碳反应生成碳酸钠和氧气,发生了氧化还原反应,A项不符合题意;工业上电解熔融状态的Al2O3制备Al,发生的是氧化还原反应,B项不符合题意;工业上利用合成氨实现人工固氮,氮气和氢气化合生成氨气,发生了氧化还原反应,C项不符合题意;NH4Cl和Ca(OH)2反应制备NH3的反应属于复分解反应,D项符合题意。 答案:D 3.一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,则乙可能是( ) A.Al(OH)3 B.H2SiO3 C.FeCl2 D.CH3Cl 解析: 氢氧化铝可由氯化铝与氨水反应生成或由偏铝酸钠和氯化铝反应生成,但两者均不是化合反应,A项错误;硅酸可由硅酸钠与盐酸反应得到,但不能通过化合反应获得,B项错误;氯化铁与铁单质发生化合反应可以生成氯化亚铁,属于化合反应,C项正确;甲烷与氯气发生取代反应可生成CH3Cl,但不属于化合反应,D项错误。 答案:C 4.下列物质的转化在给定条件下能实现的是( ) ①氯化钠饱和溶液NaHCO3(s) ②N2NO2HNO3 ③海水Mg(OH)2MgCl2(aq)MgCl2(s) ④Al2O3AlCl3(aq)Al(OH)3 ⑤重晶石(BaSO4)BaCO3BaCl2(aq) A.①③⑤ B.②③④ C.②④⑤ D.①④⑤ 解析:②N2在点燃的条件下不能生成NO2;③MgCl2易水解,加热蒸干不能得到无水MgCl2,得到的生成物可能是Mg(OH)2。 答案:D 5.生物法净化含硫废气时发生如下反应:CH3COOH+SO2HCO+H2S。下列有关说法正确的是( ) A.反应中CH3COOH是还原剂 B.反应中SO被氧化 C.H2S的酸性比H2CO3强 D.该反应属于复分解反应 解析:脱硫时硫元素的化合价由+6价降低到-2价,则硫元素被还原,SO为氧化剂,CH3COOH为还原剂,A项正确,B、D两项均错误;若H2S的酸性比H2CO3强,则应生成H2CO3和HS-(或S2-),C项错误。 答案:A 6.如图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含( ) A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应 解析:根据图示可知,装置中涉及的化学反应有CaCO3CaO+CO2↑(分解反应),SO2+CaOCaSO3(化合反应),2CaSO3+O22CaSO4(既是化合反应又是氧化还原反应),没有发生置换反应。 答案:C 7.下列离子方程式与所述事实相符且正确的是( ) A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O===MnO2↓+Cl-+2H+ B.用稀硝酸清洗做过银镜反应的试管:Ag+NO+4H+===Ag++NO↑+2H2O C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl- D.用铁棒作阴极、碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2OH2↑+Cl2↑+2OH- 解析:在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+2OH-===MnO2↓+Cl-+H2O,A项错误;用稀硝酸清洗做过银镜反应的试管,发生反应的离子方程式为3Ag+NO+4H+===3Ag++NO↑+2H2O,B项错误;向FeBr2溶液中通入过量的Cl2,发生反应的离子方程式为2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-,C项错误;用铁棒作阴极、碳棒作阳极电解饱和氯化钠溶液,发生反应的离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-,D项正确。 答案:D 8.下列各组物质中,不能满足组内任意两种物质在一定条件下均能发生反应的是( ) 组别 物质 甲 乙 丙 A H2SO4 NH4HCO3 Ba(OH)2 B H2S NaOH SO2 C NH3 NO2 HNO3 D FeBr3 Cl2 Cu 解析:本题考查S、N、Cl、Fe等元素的化合物之间的相互转化关系。HCO既能与H+反应,又能与OH-反应,A项不符合题意;H2S能与NaOH发生酸碱中和反应,SO2能被NaOH溶液吸收,H2S与SO2能发生氧化还原反应生成硫单质,B项不符合题意;NO2不能与HNO3反应,C项符合题意;Cl2能将Br-氧化为Br2,Cu能与Fe3+发生氧化还原反应,Cu与Cl2能发生化合反应,D项不符合题意。 答案:C 9.下列解释事实的离子方程式不正确的是( ) A.在重铬酸钾溶液中滴入NaOH溶液,溶液变为黄色:Cr2O+2OH-===2CrO+H2O B.硫酸铜溶液显酸性:Cu2++2H2OCu(OH)2+2H+ C.草酸使酸性高锰酸钾溶液褪色:2MnO+5C2O+16H+===2Mn2++10CO2↑+8H2O D.84消毒液与洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+===Cl2↑+H2O 解析:草酸为弱电解质,不能拆写,应为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。 答案:C (B级) 10.下列化学用语或相关叙述中不正确的是( ) A.纯碱的化学式为Na2CO3 B.CCl4的电子式为 C.HCO的电离方程式为HCO+H2OCO+H3O+ D.次氯酸分子的结构式为H—O—Cl 解析:纯碱是碳酸钠(Na2CO3)的俗名,A项正确;CCl4的电子式为:,B项错误;可将H3O+视为H+,C项正确;HClO的结构式为H—O—Cl,D项正确。 答案:B 11.下列关于物质应用的说法错误的是( ) A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污 C.浓氨水可检验氯气管道漏气 D.Na2S可除去污水中的Cu2+ 解析:A项,氢氟酸可与玻璃中的二氧化硅发生反应,所以不能用玻璃容器盛放氢氟酸,一般要将其保存在塑料或铅制容器中,所以,A项说法错误。B项,纯碱的主要成分为碳酸钠,溶于水后碳酸根离子水解使溶液显碱性。油脂在碱性溶液中又能比较容易发生水解反应,生成溶于水的物质,易于将其清洗掉,所以纯碱可用于清洗油污,故B的说法正确。C项,浓氨水挥发出的氨气能够和管道可能泄露出来的氯气发生氧化还原反应生成氮气和氯化铵,3Cl2+8NH3===N2+6NH4Cl,反应过程中会出现有很明显地“冒白烟”的现象,据此,可检验氯气管道是否漏气,故C的说法正确。D项,铜离子能够和硫离子结合生成难溶于酸的黑色沉淀物硫化铜,Cu2++S2-===CuS↓,所以Na2S可除去污水中的Cu2+,故D的说法正确。 答案:A 12.下列指定反应的离子方程式正确的是( ) A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-===ClO-+Cl-+H2O B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-===AlO+H2↑ C.室温下用稀HNO3溶解铜:Cu+2NO+2H+===Cu2++2NO2↑+H2O D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+ 解析:A项,Cl2与NaOH反应生成NaCl、NaClO和H2O,正确;B项,题给离子方程式不符合电荷守恒与得失电子守恒,错误;C项,稀HNO3与Cu发生反应生成NO,错误;D项,Na2SiO3为可溶性的钠盐,应拆开,错误。 答案:A 13.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( ) A.反应中NO为氧化剂,N2为氧化产物 B.汽车尾气的主要污染成分包括CO、NO和N2 C.NO和O2必须在催化剂表面才能反应 D.催化转化总化学方程式为2NO+O2+4CO4CO2+N2 解析:反应过程中NO、O2为氧化剂,N2为还原产物;汽车尾气中的N2不是污染物;NO和O2的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO+O2===2NO2,2NO2+4CO===N2+4CO2,将两步反应式合并可得总化学方程式为2NO+O2+4CO4CO2+N2。 答案:D 14.甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO离子中的两种组成,可以发生如图转化。下列说法不正确的是( ) A.在甲中滴加丁可能发生反应:HCO+Ba2++OH-===BaCO3↓+H2O B.溶液丙中还可以大量共存的离子:I-、NO、SO C.白色沉淀A可能溶解在溶液D中 D.甲为NaHCO3,乙为AlCl3 解析:由图中转化关系可知,“溶液甲+溶液乙→白色沉淀A+无色气体B+NaCl溶液”,只有Al3+与HCO发生相互促进的双水解反应才能出现此现象;溶液甲又能与溶液丙反应生成无色气体B,能与溶液丁反应生成白色沉淀C,则甲中含有HCO,而乙中有Al3+,阴离子只能为Cl-,故乙为AlCl3,那么丙为HCl。甲溶液与乙、丙溶液反应都有NaCl生成,则甲为NaHCO3;甲与丁溶液反应生成白色沉淀C,则丁为Ba(OH)2。当Ba(OH)2过量时,与NaHCO3反应的离子方程式为HCO+Ba2++OH-===BaCO3 ↓+H2O,A项正确;丙为HCl,NO、H+与I-发生氧化还原反应而不能大量共存,B项错误;白色沉淀A为Al(OH)3,溶液D可能含有NaOH,Al(OH)3能溶解于NaOH溶液,C项正确;根据上述分析知,甲为NaHCO3,乙为AlCl3,D项正确。 答案:B 15.氢气是一种绿色能源,大力开发氢能有利于环境保护。借助Cu/CuCl热化学循环制氢:2H2O===2H2↑+O2↑,其工艺流程如下。下列有关说法正确的是( ) A.步骤①中发生的反应属于放热反应 B.步骤②的温度为500℃,则反应的化学方程式为2Cu2OCl24CuCl+O2↑ C.步骤③可在电解池中进行,Cu是氧化产物 D.反应⑤一定是依据原电池原理实现的 解析:由图示看出①为CuCl2的水解反应,水解反应一般是吸热反应,A错误;②依据图示可知反应物为Cu2OCl2,生成物为CuCl和O2,故B正确;③从CuCl―→Cu化合价降低,发生还原反应,C错误;⑤中Cu与HCl产生H2,为非自发的氧化还原反应,依据原电池原理无法实现该反应,D错误。 答案:B 16.下列有关物质及成分、性质和用途都正确的是( ) 选项 物质及成分 性质 用途 A 小苏打(Na2CO3) 与酸反应产 生二氧化碳 作发酵粉 B 磁性氧化铁 (Fe2O3) 难溶于水,红色 制造红 色涂料 C 蓝矾(CuSO4· 5H2O) 蓝色 检验水蒸气 D 二氧化硫(SO2) 能和某些有色物质 反应生成无色物质 漂白草织品 解析:小苏打的成分是NaHCO3,A项错误;磁性氧化铁的成分是Fe3O4(黑色),通常用作颜料和抛光剂,B项错误;无水硫酸铜(CuSO4)的作用是检验水蒸气,C项错误。 答案:D 17.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程: 下列说法不正确的是( ) A.溶解烧渣选用足量硫酸,试剂X选用铁粉 B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2 C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O 解析:流程设计意图是用硫酸把Fe2O3、Al2O3,转化为硫酸盐,除去SiO2,然后用铁粉还原Fe3+得到硫酸亚铁,A正确;加硫酸后SiO2不能溶解,所以固体Ⅰ中有SiO2,分离FeSO4和Al2(SO4)3采用的是调控pH的方法,使Al3+转化为Al(OH)3沉淀而与FeSO4分离,B正确;Fe2+容易被氧化,所以在得到FeSO4·7H2 O产品的过程中,要防止其被氧化和分解,C正确;若在溶液1中直接加过量的NaOH得到的是Fe(OH)3沉淀,这样的话,得到的不是FeSO4·7H2O,而是Fe2(SO4)3,D不正确。 答案:D查看更多