- 2021-07-03 发布 |
- 37.5 KB |
- 90页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学一轮复习课件:模块4 第十单元 第2节 物质的检验、分离和提纯
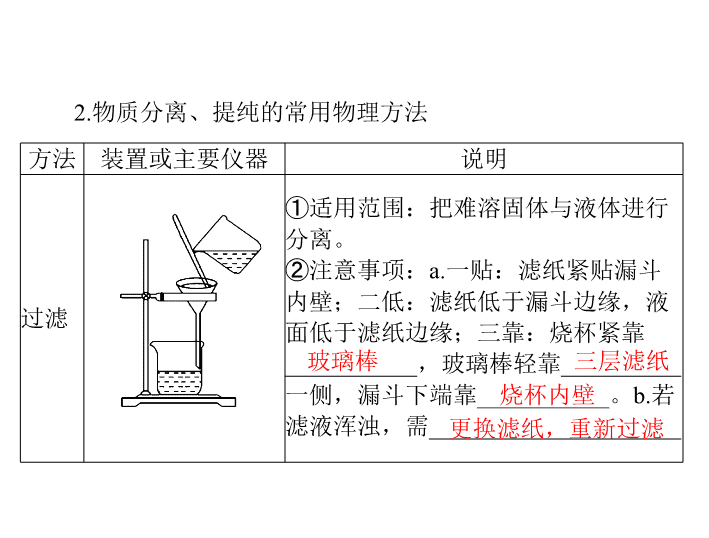
第 2 节 物质的检验、分离和提纯 考纲点击: 掌握常见物质检验、分离和提纯的方法。 回归教材 一、物质的分离和提纯 1. 物质分离、提纯的区别 (1) 物质的分离 将混合物的各组分分离开来,获得几种纯净物的过程。 (2) 物质的提纯 将混合物中的杂质除去而得到纯净物的过程,又叫物质的 净化或除杂。 方法 装置或主要仪器 说明 过滤 ① 适用范围:把难溶固体与液体进行 分离。 ②注意事项: a. 一贴:滤纸紧贴漏斗 内壁;二低:滤纸低于漏斗边缘,液 面低于滤纸边缘;三靠:烧杯紧靠 ___________ ,玻璃棒轻靠 __________ 一侧,漏斗下端靠 ___________ 。 b. 若 滤液浑浊,需 _____________________ 2. 物质分离、提纯的常用物理方法 玻璃棒 三层滤纸 烧杯内壁 更换滤纸,重新过滤 ( 续表 ) 溶液飞溅 大量晶体 方法 装置或主要仪器 说明 蒸发 ① 适用范围:分离固体溶质和溶剂。 ② 注意事项: a. 玻璃棒的作用:搅拌,防止局部温度过高造成 __________ 。 b. 当有 ____________ 析出时,停止加热,用余热蒸干 ( 续表 ) 大 互不混溶 不反应 下口 上层 方法 装置或主要仪器 说明 萃取和分液 ① 适用范围: a. 萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来。 b. 分液:两种液体互不相溶,易分层。用于分离两种互不相溶的液体混合物。 ② 注意事项: a. 溶质在萃取剂中的溶解度要比在原溶剂中 ____ 。 b. 萃取剂与原溶剂 ____________ 。 c. 萃取剂与溶质 ____________ 。 d. 分液时,分液漏斗中的下层液体从 ______ 放出, ________ 液体从上口倒出 方法 装置或主要仪器 说明 蒸馏 ( 分馏 ) ① 适用范围:互溶的 ________ 相差 较大的液体混 合物。 ②注意事项: a. 温度计的水银球在 蒸馏烧瓶的 ____________ 。 b. 蒸馏烧瓶中要加沸石或碎瓷片防 暴沸。 c. 冷凝管水流方向应为 __________ ______________________ ( 续表 ) 沸点 支管口处 低进高出或 下口进上口出 方法 装置或主要仪器 说明 升华 ① 适用范围:混合物中某种组分易升 华,利用物质易升华的性质在加热条 件下分离的方法。 ②注意事项:应与物质的分解反应区 分,如 NH 4 Cl NH 3 ↑ + HCl↑ , 属于化学变化 ( 续表 ) 胶体 轻金属盐或铵盐 ( 续表 ) 方法 装置或主要仪器 说明 渗析 ① 适用范围:分离提纯 ________ 与小分子 ( 或离子 ) 组成的混合液。 ② 注意事项:要不断更换烧杯中的蒸馏水 ( 或用流动水 ) 以提高渗析效果 盐析 ① 适用范围:利用蛋白质在加某些 ______________________[ 如 Na 2 SO 4 、 (NH 4 ) 2 SO 4 等 ] 时,其溶解度降低而析出的性质来分离的方法。 ② 注意事项:盐析后过滤 [ 特别提醒 ] 创新装置 (1) 过滤装置的创新 —— 抽滤 由于水流的作用,使图 1 装置 a 、 b 中气体的压强减小,故 使过滤速率加快。 图 1 (2) 蒸馏、冷凝装置的创新应用 图 2 图 3 图 4 图 2 、图 3 、图 4 ,由于冷凝管竖立,使 液体混合物能冷凝 回流,若以此容器做反应容器,可使反应物循环利用,提高了 反应物的转化率。 (3) 洗气装置的创新 —— 双耳球吸收法 图 5 图 5 中, 由于双耳球上端球形容器的容积较大,能有效地 防止倒吸。故该装置既能除去气体中的气态杂质,又能防止倒 吸。 方法 原理 典例 加热 分解法 混合物中混有热稳定性差 的杂质时,可直接加热,使 热稳定性差的杂质分解而 分离出去 纯碱中混有小苏打 沉淀法 在混合物中加入某试剂,使 杂质离子以沉淀形式分离 出去的方法 加适量 AgNO 3 溶液除去 KNO 3 溶液中的 KCl 3. 物质分离、提纯的化学方法 ( 续表 ) 方法 原理 典例 转化法 不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后将转化物质恢复为原物质 分离 Fe 3 + 和 Al 3 + 时,可加入过量的 NaOH 溶液,生成 Fe(OH) 3 沉淀和 NaAlO 2 溶液,过滤后,向 Fe(OH) 3 中加入盐酸重新生成 Fe 3 + ,向 NaAlO 2 中通入过量 CO 2 ,生成 Al(OH) 3 沉淀,过滤后向 Al(OH) 3 中加入盐酸重新生成 Al 3 + 酸碱 溶解法 被提纯物质不与酸碱反应,而杂质可与酸碱发生反应 用盐酸除去 SiO 2 中的石灰石,用 NaOH 溶液除去铁粉中的铝粉 ( 续表 ) 方法 原理 典例 氧化 还原法 ① 对混合物中混有的还原性杂质,可加入适当的氧化剂将其氧化为被提纯物质; ② 对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质 通入 Cl 2 将 FeCl 3 中混有的 FeCl 2 氧化成 FeCl 3 ,达到除杂目的;将过量铁粉加入混有 FeCl 3 的 FeCl 2 溶液中,振荡、过滤,可除去 FeCl 3 杂质 调节 pH 法 通过加入试剂来调节溶液的 pH ,使溶液中某种成分沉淀分离的方法 CaCl 2 溶液中含有 FeCl 3 杂质,由于 FeCl 3 的水解,溶液呈酸性,可采用调节溶液 pH 的方法将 Fe 3 + 沉淀,因此,可加 CaCO 3 ( 续表 ) [ 特别提醒 ] 分离、提纯物质遵循的 “ 四原则”“三必须” 二、物质的检验 1. 离子检验 (1) 常见阳离子 的检验 蓝色沉淀 白 灰绿 红褐 红 无明显 红 红褐 现象 ⑤NH 4 ④Al 3+ 产生白色沉淀,继续加入 ________ 溶 液,白色沉淀又会 ________ + 共热,生成使湿润的红色石蕊试纸 ____ 的气体 NaOH 溶解 变蓝 浅紫 黄 ⑥K + 火焰呈 ________ 色 ( 透过蓝色钴玻璃 ) ⑦Na + 火焰呈 ______ 色 石蕊 甲基橙 材中给定的方法,如检验 Fe 3+ 用 KSCN 溶液。 [ 特别提醒 ] (1) 阳离子的检验除了一些特殊的方法 ( 焰色反应、 KSCN 溶 液显色反应 ) 外,我们一般用 NaOH 溶液即可鉴别。 (2) 在没有特殊要求时,如果有多种检验方法,应该选择教 (3) 含 Fe 3 + 、 Fe 2 + 的混合溶液中检验 Fe 2 + 的方法是加 入 K 3 [Fe(CN) 6 ] 溶液,产生蓝色沉淀或滴加几滴酸性 KMnO 4 溶液, KMnO 4 浅紫色褪去。 (2) 常见阴离子的检验 红 蓝 无 无 利用酸碱指示剂检验: 利用盐酸和其他试剂检验: 白色沉淀 刺激性 白色沉淀 HCO 3 - HSO 3 - Cl - 、 Br - 、 I - 的检验: Cl - Br - I - Br - ① 硝酸酸化的硝酸银溶液。 I - 蓝 [ 特别提醒 ] 2. 气体检验 (1) 可燃性气体的检 验 (2) 酸性气体的检验 先变浑浊后变澄清 褪去 又恢复红色 白烟 红 (3) 碱性气体 (NH 3 ) 的检验 白烟 蓝 (4) 强氧化性气体的检验 (5)NO 的检验 —— 无色气体,与空气接触后立即变为红棕 色。 复燃 黄绿 刺激性 蓝 红棕 刺激性 [ 特别提醒 ] (1) 检验气体时,要防止气体之间的互相干扰,如 Cl 2 、 SO 2 均能使品红溶液褪色。 (2) 中学阶段只学过一种碱性气体,所以只要使湿润的红色 石蕊试纸变蓝的气体一般都是氨气。 基础测评 1.(2018 年山东威海模拟 ) 下列实验操作正确的是 ( ) 。 A. 向混有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶 液,振荡静置,用装置甲分液,放出水相后再从分液漏斗下口 放出有机相 B. 用装置乙加热分解法除去 Na 2 CO 3 中混有的少量 NaHCO 3 C. 用装置丙除去氯气中的 HCl 气体 D. 除去 Cu 粉中混有的 CuO :加适量稀硫酸后,过滤、洗 涤 答案: D A. 冷水浸泡 B. 加热煎制 C. 箅渣取液 D. 灌装保存 2.(2016 年北京卷 ) 下列中草药煎制步骤中,属 于过滤操作 的是 ( ) 。 解析: A 项,冷水浸泡属于物质的溶解,故错误; B 项, 加热煎制属于加热,故错误; C 项,箅渣取液属于过滤操作, 故正确; D 项,灌装是液体转移,故错误。 答案: C 选项 操作 现象 结论 A 向某浓溶液中加入铜 片和浓硫酸并加热 有红棕色刺激性 气味的气体产生 原溶液中一定 - 有 NO 3 B 向某溶液中滴入氯水, 再滴加 KSCN 溶液 溶液显红色 原溶液中一定 有 Fe 2+ C 向某无色溶液中加入 硝酸钡溶液 产生白色沉淀,沉 淀不溶于稀硝酸 原溶液中一定 - 2 有 SO 4 D 将某气体通入酸性 KMnO 4 溶液中 溶液褪色 该气体一定是 C 2 H 4 3.(2018 年陕西汉中模拟 ) 根据实验操作和现象所得出的结 论正确的是 ( ) 。 4.(2018 年河南郑州模拟 ) 下列各组物质,不用任何试剂即 可鉴别的是 ( ) 。 A.NaCl 、 NaBr 、 KI 三种无色溶液 B.HCl 、 NaCl 、 NaNO 3 、 Na 2 CO 3 四种溶液 C.NaBr 、 HCl 、 KCl 三种溶液 D. 淀粉、淀粉 - 碘化钾、碘化钾、溴水四种溶液 解析: NaCl 、 NaBr 、 KI 三种无色溶液要用 AgNO 3 溶液鉴 别, A 不符合题意; HCl 、 NaCl 、 NaNO 3 、 Na 2 CO 3 四种溶液两 两混合,有气泡产生的是 HCl 和 Na 2 CO 3 两种溶液,依据互滴 法可鉴别 HCl 和 Na 2 CO 3 ,剩余的是 NaCl 和 NaNO 3 两种溶液需 再用 AgNO 3 溶液鉴别, B 不符合题意; NaBr 、 HCl 、 KCl 三种 溶液需先用 Na 2 CO 3 溶液鉴别出 HCl ,再用 AgNO 3 溶液鉴别出 NaBr 和 KCl , C 不符合题意;淀粉、淀粉 - 碘化钾、碘化钾、溴 水四种溶液中溴水有颜色,溴水与碘化钾溶液 反应生成碘单质, 溶液颜色加深,溴水与淀粉 - 碘化钾溶液反应生成碘单质,碘单 质与淀粉反应使溶液呈蓝色,剩余的为淀粉溶液, D 符合题意。 答案: D 5.(2018 年安徽合肥模拟 ) 根据下列实验事实得出的结论正 确的是 ( ) 。 解析: A 项,也可能含有 Ba 2+ ; B 项,也可能是 H 2 S 或 CO 气体; C 项,也 可能是浓硝酸。 答案: D 考点一 考向 1 物质的分离与提纯 古典文献中物质的分离、提纯方法 [ 典例 1 ](2017 年新课标 Ⅰ 卷 )《 本草衍义 》 中对精制砒霜过 程有如下 叙述: “ 取砒之法,将生砒就置火上,以器覆之,令 砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者 次之。”文中涉及的操作方法是 ( ) 。 A. 蒸馏 B. 升华 C. 干馏 D. 萃取 解析: “将生砒就置火上,以器覆之,令砒烟上飞着覆器, 遂凝结 …… ” ,属于固体直接转化为气体,类似于碘的升华, 因此涉及的操作方法是升华,故选 B 。 答案: B 下列说法错误的是 ( 考向 2 根据物理性质选择分离方法 [ 典例 2 ](2018 年河南高中毕业班考前预测 ) 按以下实验方案 可从海洋动物柄海鞘中提取具有 抗肿瘤活性的天然产物。 A. 步骤 (1) 需要过滤装置 C. 步骤 (3) 需要用到坩埚 ) 。 B. 步骤 (2) 需要用到分液漏斗 D. 步骤 (4) 需要蒸馏装置 . . 解析: 滤液与不溶物是用过滤的方法分离的, A 正确;分 离水层与有机层,需要用分液漏斗, B 正确;溶液蒸发结晶应 用蒸发皿, C 错误;用蒸馏的方法从有机层溶液中蒸出甲苯, D 正确。 答案: C [ 方法技巧 ] 依据物理性 质选择分离、提纯的方法 (1)“ 固+固 ” 混合物的分离 ( 提纯 ) (2)“ 固+液 ” 混合物的分离 ( 提纯 ) (3)“ 液+液”混合物的分离 ( 提纯 ) 考向 3 根据化学性质选择分离方法 [ 典例 3 ] 在测定 Na 2 SO 4 和 NaCl 的混合物中 Na 2 SO 4 的质量 分数时,常采用在混合物的溶液中加入过量 BaCl 2 溶液,沉淀 SO 2 - ,然后过滤、洗涤、烘干、称量得到 BaSO 4 质量的方法。 试问: (1) 怎样判断 SO 2 - 是否沉淀完全? (2) 过滤完毕后,为什么要洗涤沉淀 ( 即洗涤沉淀的目的 )? (3) 沉淀的洗涤方法? (4) 怎样判断沉淀是否洗净? 4 4 若产生白色沉淀,说明 SO 2 - 未沉淀完全,反之则沉淀完 全。 答案: (1) 取上层清液少许于试管中,再加入 BaCl 2 溶液, (2) 洗去可溶性杂质 (Na + 、 Cl - 等 ) 。 (3) 沿玻璃棒向漏斗中注水至浸没沉淀,待水自然流下后, 再重复 2 ~ 3 次。 (4) 取最后一次滤出液少许于试管中,滴加稀 HNO 3 酸化的 AgNO 3 溶液,若产生白色沉淀,说明 沉淀未洗净,反之已洗净。 4 [ 答题模板 ] (1) 沉淀洗涤的答题模板 注洗涤液 ( 沿玻璃棒向漏斗中注入洗涤液 ) ↓ 标准 ( 使洗涤液完全浸没沉淀或晶体 ) ↓ 重复 ( 待洗涤液流尽后,重复操作 2 ~ 3 次 ) (2) 沉淀是否洗净的答题模板 取样 ( 取少量最后一次洗涤液于一洁净的试管中 ) ↓ 加试剂 [ 加入 ×× 试剂 ( 必要时加热,如检验 NH + )] ↓ 现象 ( 不产 生 ×× 沉淀、溶液不 变 ×× 色或不产生 ×× 气 体 ) ↓ 结论 ( 说明沉淀已经洗涤干净 ) 4 离出 X 的两种方案,下列说法中不合理的是 ( 考向 4 物质分离提纯的实验方案及流程分析 [ 典例 4 ](2018 年重庆沙坪坝模拟 ) 下图表示从原混合物中分 ) 。 . . . A. 若含 X 的混合物为溴水,可通过方案 Ⅰ 进行分离,加入 试剂为 CCl 4 ,充分振荡后液体分层,下层为 X 的 CCl 4 溶液 B. 若含 X 的混合物为 BaSO 4 、 BaSO 3 的混合物,可通过方 案 Ⅱ 进行分离得到 X ,加入试剂为稀硝酸, X 为 BaSO 4 C. 若含 X 的混合物为乙醇和乙酸乙酯的混合物,可通过方 案 Ⅰ 进行分离,加入试剂为饱和 NaOH 溶液,残留液中含有乙 酸钠 D. 若含 X 的混合物为 Fe 、 Al ,可通过方案 Ⅱ 进行分离,加 入的试剂是过量的 NaOH 溶液, 1 mol X 与足量氯气完全反应 时,转移 3 mol 电子 解析: A 项,溴易溶于四氯化碳、微溶于水,四氯化碳的 密度比水的大,在混合液的下层,该方法合理; B 项, BaSO 3 被稀硝酸氧化成硫酸钡,然后通过过滤得到 BaSO 4 ,该方法合 理; C 项,分离乙醇和乙酸乙酯时,应该选用饱和碳酸钠溶液, 若用 NaOH 溶液,乙酸乙酯会与 NaOH 溶液反应,该方法不合 理; D 项,铝可与 NaOH 溶液反应,铁与氯气反应生成氯化铁, 1 mol 铁与足量氯气完全反应时,转移 3 mol 电子,该描述合理。 答案: C [ 思维建模 ] 化学方法除杂的一般思路 【 拓展演练 】 1.(2018 年江苏卷 ) 下列有关从海带中提取碘的实验原理和 装置能达到实验目的的是 ( ) 。 甲 乙 丙 丁 A. 用装置甲灼烧碎海带 B. 用装置乙过滤海带灰的浸泡液 C. 用装置丙制备用于氧化浸泡液中 I - 的 Cl 2 D. 用装置丁吸收氧化浸泡液中 I - 后的 Cl 2 尾气 解析: A 项,灼烧碎海带应用坩埚; B 项,海带灰的浸泡 液用过滤法分离获得含 I - 的溶液; C 项, MnO 2 与浓盐酸反应制 Cl 2 需要加热; D 项,尾气 Cl 2 应用 NaOH 溶液吸收。 答案: B 2.(2018 年河南平顶山检测 ) 海洋植物如海带、海藻中含有 大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻 中提取碘的流程如下图: (1) 实验室焙烧海带,需要下列仪器中的 ______( 填字母 ) 。 a. 试管 b. 烧杯 c. 坩埚 d. 泥三角 e. 三脚架 f. 酒精灯 (2) 指出提取碘的过程中有关的实验操作名称:① ______ , ③ ________ 。 (3) 提取碘的过程中,可选择的有机试剂是 ______( 填字母 ) 。 A. 甲苯、酒精 C. 汽油、乙酸 B. 四氯化碳、苯 D. 汽油、甘油 (4) 为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧 杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及 必要的夹持仪器、物品,尚缺少的玻璃仪器有 ______________ 、 ______________ 。 (5) 小组用 CCl 4 萃取碘水中的碘,在上 图的分液漏斗中,下 层液体呈 ________ 色;他们打开分液漏斗活塞,却未见液体流 下,原因 可能是 ____________________________________ 。 (6) 从含碘的有机溶液中提取碘和回收有机溶剂,还 须经过 蒸馏,指出下面实验装置图中的错误之处: ①_______________________________________________ ; ② _______________________________________________ ; ③ _______________________________________________ 。 (7) 进行上述蒸馏操作时,使用水浴加热的原因是 ________ _______ ,最后晶体碘在 ________ 里聚集。 解析: 海带要在坩埚中焙烧,选择萃取剂要与水互不相溶。 蒸馏操作时注意冷凝水的方向,加热烧杯要垫石棉网。 萃取分液 (3)B 答案: (1)cdef (2) 过滤 (4) 分液漏斗 普通漏斗 (5) 紫红 分液漏斗上口活塞小孔未与空气相通 ② 温度计插到了液体中 ③ 冷凝管进出 (6)① 缺石棉网 水的方向颠倒 (7) 使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧 瓶 考点二 考向 1 物质的检验 常见离子的检验 [ 典例 5 ](2018 年安徽淮北模拟 ) 下列离子在未知溶液中的检 验方法正确的是 ( ) 。 [ 答题模板 ] 离子检验简答题的答题模板 [ 方法技巧 ] 无色溶液中溶质的检验程序 选项 实验操作 现象 结论 A 将某气体通入 FeCl 2 溶液中 溶液由浅绿色 变为黄色 该气体中一定含 有 Cl 2 B 将某气体与湿润的 淀粉 -KI 试纸接触 试纸变蓝色 该气体一定是还 原性气体 C 将某气体通过灼热 的 CuO 粉末 粉末由黑变红 该气体中一定含 有 H 2 D 将某气体与湿润的 红色石蕊试纸接触 试纸变蓝色 该气体中一定含 有 NH 3 考向 2 气体的检验 [ 典例 6 ](2018 年天津塘沽模拟 ) 下列有关实验操作、现象和 结论正确的是 ( ) 。 解析: A 项中气体还可能是 O 2 、 O 3 、 NO 2 等; B 项中气体 一定是氧化性气体; C 项中还可能是 CO 等。 答案: D [ 答题模板 ] 常见气体检验答题模板 ( 以 CO 2 的检验为例 ) 【 拓展演练 】 3.(2015 年天津卷 ) 下列关于物质或离子检验的叙述正确的 是 ( ) 。 解析: A 项, Fe 3 + 遇 KSCN 会使溶液呈现红色, Fe 2 + 遇 KSCN 不反应无现象,如果该溶液既含 Fe 3 + ,又含 Fe 2 + ,滴加 KSCN 溶液,溶液呈红色,则证明存在 Fe 3 + 但并不能证明无 Fe 2 + ,错误; B 项,气体通过无水硫酸铜,粉末变蓝,则发生反应: CuSO 4 + 5H 2 O===CuSO 4 ·5H 2 O , CuSO 4 ·5H 2 O 为蓝色,故可证明原气体中含有水蒸气,正确; C 项,灼烧白色粉末,火焰呈黄色,证明原粉末中有 Na + , Na + 焰色反应为黄色,但并不能证明无 K + ,因为黄光可遮住紫光,故 K + 焰色反应需透过蓝色的钴玻璃滤去黄光后观察,错误; D 项,能使澄清石灰水变浑浊的气体有 CO 2 、 SO 2 等,故将气体通入澄清石灰水,溶液变浑浊,则原气体不一定是 CO 2 ,错误。 答案: B 4.(2018 年华中师大附中模拟 ) 为确定某溶液的离子组成, 进行如下实验:①测定溶液的 pH ,溶液显强碱性;②取少量溶 液加入稀盐酸至溶液呈酸性,产生无色无味且能使澄清石灰水 变浑浊的气体;③在②溶液中再滴加 Ba(NO 3 ) 2 溶液,产生白色 沉淀;④取③中上层清液继续滴加 Ba(NO 3 ) 2 溶液至无沉淀时, 再滴加 AgNO 3 溶液,产生白色沉淀。根据实验现象,以下 推测 正确的是 ( ) 。 考点三 考向 1 常见物质的鉴别 物质的鉴别 [ 典例 7 ](2018 年山东济南模拟 ) 常温下,欲鉴别物质的量浓 度均为 0.1 mol·L - 1 的 KCl 、 (NH 4 ) 2 SO 4 、 NH 3 ·H 2 O 和 H 2 SO 4 四瓶 ) 。 无色溶液,下列实验方案最佳的是 ( A. 用 pH 试纸鉴别 B. 分别闻气味和用 pH 试纸鉴别 C. 分别用 BaCl 2 和 NaOH 溶液鉴别 D. 用 Ba(OH) 2 溶液鉴别 解析: 用 pH 试纸测定各溶液的 pH , pH 小 于 7 的 是 (NH 4 ) 2 SO 4 和 H 2 SO 4 ,且 H 2 SO 4 溶液的 pH 比 (NH 4 ) 2 SO 4 溶液的 小, KCl 溶液的 pH 等于 7 , NH 3 ·H 2 O 溶液的 pH 大于 7 。 答案: A 一般类型 鉴别方法 不用试剂 ① 先依据外观特征,鉴别出其中的一种或几种,然 后再利用它或它们去鉴别其他几种物质 ② 若均无明显外观特征,可考虑能否用加热或焰色 反应等方法鉴别出一种或几种物质 ③ 若以上两种方法都不能鉴别时,可考虑两两混合 或相互滴加,记录反应现象,分析确定 [ 方法技巧 ] 物质鉴别的 一般类型和方法 一般类型 鉴别方法 只用一种 试剂 ① 先分析被鉴别物质的水溶性、密度、颜色等,初 步将被鉴别物质确定或分组 ② 在鉴别多种酸、碱、盐的溶液时,可依据“相反 原理”确定试剂进行鉴别。即被鉴别的溶液多数呈 酸性时,可选用碱或水解呈碱性的盐溶液作试剂; 若被鉴别的溶液多数呈碱性时,可选用酸或水解呈 酸性的盐溶液作试剂 ③ 可考虑用已检出的物质为试剂做后续鉴别 任选或 限选试剂 此类题目不限制所加试剂的种类或在指定范围内选 择试剂,可有多种解法,题目考查的形式往往是从 众多的鉴别方案中选择最佳方案,其要求是操作步 骤简单,试剂选用最少,现象最明显 (续表) [ 典例 8 ](2018 年福建泉州五校联考 ) 在一无色溶液中检验出 有 Ba 2 + 、 Ag + ,同时又测得其酸性很强。某学生还要鉴 定此溶 液中是否大量存在: 其实,这些离子中有一部分不必再鉴定就能加以否定,你 认为不必鉴定的离子组是 ( A.③⑤⑥⑦⑩ C.③④⑦⑧⑨ ) 。 B.①②⑤⑥⑧⑨ D.①②③⑤⑥⑩ [ 方法技巧 ] 离子鉴别的四项基本原则 (3) 电中性原则 溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中 正电荷总数与负电荷总数相等。 ( 这一原则可帮助我们确定一些 隐含的离子 ) (4) 进出性原则 通常在实验过程中使用,是指在实验过程中反应生成的离 子或引入的离子对后续实验的干扰。 【 拓展演练 】 5.(2018 年天津卷 ) 由 下列实验及现象推出的相应结论正确 的是 ( ) 。 实验 现象 结论 某溶液中滴加 K 3 [Fe(CN) 6 ] 溶液 产生蓝色沉淀 原溶液中有 Fe 2 + ,无 Fe 3 + B. 向 C 6 H 5 ONa 溶液中通入 CO 2 溶液变浑浊 酸性: H 2 CO 3 > C 6 H 5 OH C. 向含有 ZnS 和 Na 2 S 的悬浊液中滴加 CuSO 4 溶液 生成黑色沉淀 K sp (CuS)< K sp (ZnS) D.① 某溶液中加入 Ba(NO 3 ) 2 溶液 ②再加足量盐酸 ① 产生白色沉淀 ②仍有白色沉淀 Cu 2+ 一定与溶液中的 S 2 - 反应得到黑色的 CuS 沉淀,不能证明 解析: A 项,某溶液中滴加 K 3 [Fe(CN) 6 ] 溶液,产生蓝色沉 淀,说明溶液中有 Fe 2 + ,但是无法证明是否有 Fe 3 + ,错误。 B 项,向 C 6 H 5 ONa 溶液中通入 CO 2 ,溶液变浑浊,说明生成了苯 酚,根据强酸制弱 酸的原则,得到碳酸的酸性强于苯酚,正确。 C 项,向含有 ZnS 和 Na 2 S 的悬浊液中滴加 CuSO 4 溶液,虽然 ZnS 为不溶物,但是溶液中还有 Na 2 S ,加入硫酸铜溶液后, 发生了沉淀转化,错误。 D 项,向溶液中加入硝酸钡 溶液,得 到白色沉淀 ( 有很多可能 ) ,再加入盐酸时,溶液中就会同时存 在硝酸钡电离的硝酸根 和盐酸电离的氢离子,溶液具有硝酸的 强氧化性,如果上一步得到的是亚硫酸钡沉淀,此步就会被氧 化为硫酸钡沉淀,依然不溶,则无法证明原溶液中有硫酸根离 子,错误。 答案: B 6.(2016 年新课标 Ⅱ 卷 ) 某白色粉末由两种物质组成,为鉴 别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足 量稀盐酸,有气泡产生,固体全部溶解 ② 取少量样品加入足 量稀硫酸有气泡产生,振荡后仍有固体存在 ) 。 该白色粉末可能为 ( A.NaHCO 3 、 Al(OH) 3 C.Na 2 SO 3 、 BaCO 3 B.AgCl 、 NaHCO 3 D.Na 2 CO 3 、 CuSO 4 解析: A 项, NaHCO 3 、 Al(OH) 3 中加入足量稀硫酸有气泡 生,生成硫酸钠 、硫酸铝、二氧化碳和水,最终无固体存在, 错误; B 项, AgCl 不溶于水和酸,加入水后,碳酸氢钠溶解, 而 AgCl 不溶,再加入足量稀盐酸, AgCl 仍然不溶,固体不能 全部溶解,错误; C 项,亚硫酸钠和碳酸钡中加入水,碳酸钡 不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应 生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足 量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二氧化碳和 水,符合题意,正确; D 项, Na 2 CO 3 、 CuSO 4 中加热足量稀硫 酸,振荡后无固体存在,错误。 答案: C 温度 /℃ 0 10 20 30 40 50 60 70 80 90 100 溶解 度 /g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246 溶解度曲线在物质分离提纯中的应用 1. 溶解度的表示方法 (1) 列表法 硝酸钾在不同温度时的溶解度: (2) 曲线法 2. 溶解度曲线的含义 (1) 不同物质在各温度时的溶解度不同。 (2) 曲线与曲线交点的含义:表示两物质在某温度时有相同 的溶解度。 (3) 能很快比较出两种物质在某温度时溶解度的大小。 (4) 能反映出溶解度随温度的变化趋势。 [ 典例 ] (2018 年山东青岛模拟 ) 高氯酸铵可用作火箭推进剂, 实验室可由 NaClO 3 等原料制取 ( 部分物质溶解度如图 ) ,其实验 流程如下: ( 已知氯酸钠受热分解生成高氯酸钠和氯化钠 ) (1)80 ℃ 时浸取液冷却至 0 ℃ 过滤,滤渣的主要成分为 ____________( 写化学式 ) 。 (2) 反应器中加入氯化铵饱和溶液发生反应的离子方程式 为 _______________________________________ 。 解析: (1)80 ℃ 时浸取液主要含有 NaClO 4 和 NaCl , NaClO 4 溶解度受温度影响较大,而 NaCl 受温度影响很小,当冷却至 0 ℃ 时, NaClO 4 会因温度降低溶解度减小而析出,所以滤渣中 主要物质是 NaClO 4 。 (2) 反应器中含有 NaClO 4 ,加入氯化铵饱 和溶液后,根据不同物质的溶解度相对大小关系,可知溶解度 [ 演练 ] (2018 年河北衡水一中模拟 ) 根据下列各组溶解度曲 线图,判断分离提纯方法。 (1) 根据下图①中 Na 2 SO 4 和 Na 2 SO 4 ·10H 2 O 的溶解度曲线 (g/100 g H 2 O) ,由 Na 2 SO 4 溶液得到 Na 2 SO 4 固体的操作为将溶 液升温结晶、 ____________ 、用乙醇洗涤后干燥。用乙醇洗涤 而不用水洗的原因是 __________________________ 。 图① 图② (2) 根据图②所示相关物质的溶解度曲线。在实验室中提纯 过硫酸钾粗产品的实验具体操作依次为将过硫酸钾粗产品溶于 适量水中, ______________________ ,干燥。 (3) 根据图①中红矾钠 (Na 2 Cr 2 O 7 ·2H 2 O) 和 Na 2 SO 4 的溶解度 曲线。从 Na 2 Cr 2 O 7 和 Na 2 SO 4 的混合溶液中提取红矾钠的操作 为先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 __________________________________________________ ,然 后将滤液 __________ ,从而析出红矾钠。 答案: (1) 趁热过 滤 防止形成 Na 2 SO 4 ·10H 2 O (2) 在不超过 80 ℃ 的条件下加热浓缩,冷却结晶,过滤, 用冷水洗涤 (3) 有利于 Na 2 SO 4 结晶析出,又能防止 Na 2 Cr 2 O 7 ·2H 2 O 结晶 析出 冷却结晶查看更多