- 2021-07-03 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版专题六原子结构化学键考点一微粒间的组成、结构和性质学案
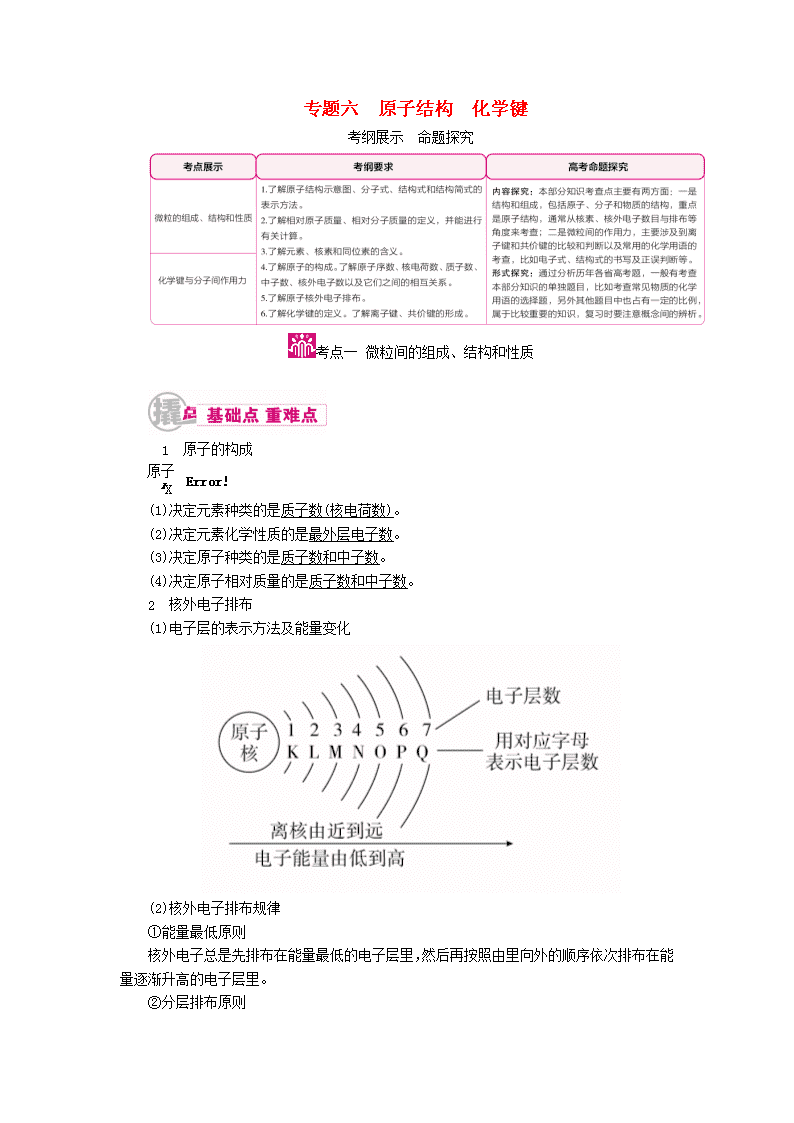
专题六 原子结构 化学键 考纲展示 命题探究 1 原子的构成 (1)决定元素种类的是质子数(核电荷数)。 (2)决定元素化学性质的是最外层电子数。 (3)决定原子种类的是质子数和中子数。 (4)决定原子相对质量的是质子数和中子数。 2 核外电子排布 (1)电子层的表示方法及能量变化 (2)核外电子排布规律 ①能量最低原则 核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺序依次排布在能量逐渐升高的电子层里。 ②分层排布原则 a.每层最多容纳的电子数为2n2个。 b.最外层不超过8个(K层为最外层时不超过2个)。 c.次外层不超过18个,倒数第三层不超过32个。 学霸巧学卡 正确理解微粒的组成和结构 (1)有质子的原子不一定有中子,有质子的微粒不一定有电子。如H只有一个质子和一个电子,不含中子;H+只有一个质子,既没有中子也没有电子。 (2)质子数相同的粒子不一定属于同种元素,如Ne和H2O。 (3)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中。 (4)核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH与OH-等。 (5)核外电子排布的几条规律是相互联系的,不能孤立地理解,必须同时满足各项要求。如M层不是最外层时,其最多只能容纳18个电子;当M层为最外层时,其最多只能容纳8个电子。 3 元素、核素、同位素的概念及相互关系 4 相对原子质量 (1)定义:以12C原子质量的(约1.66×10-27 kg)作为标准,其他原子的质量跟它比较所得的值。其国际单位制单位为1,符号为1(单位1一般不写)。 (2)概念辨析 ①原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。如一个O原子的质量是2.657×10-26 kg。 ②核素的相对原子质量:各核素的质量与12C原子的质量的的比值。一种元素有几种同位素,就应有几种不同的核素的相对原子质量,如35Cl为34.969,37Cl为36.966。 ③核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该核素的质量数相等。如35Cl为35,37Cl为37。 ④元素 的相对原子质量:是按该元素各种天然同位素的相对原子质量与其在自然界中所占的原子百分比算出的平均值。如Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。 ⑤元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其丰度的乘积之和。 学霸巧学卡 对核素、同位素概念的深度剖析 (1)一种元素可以有若干种不同的核素,也可以只有一种核素,有多少种核素就有多少种原子。因此,核素的种类大于元素的种类。 (2)同位素的研究对象是原子,同素异形体的研究对象是单质,所以2H2和3H2既不是同位素,也不是同素异形体,可看成是同种分子,同位素是原子的互称。 (3)核素的相对原子质量不是元素的相对原子质量。通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算。 1.思维辨析 (1)34S原子核内中子数为16。( ) (2)1HO的摩尔质量为20 g·mol-1。( ) (3)H3O+和OH-中具有相同的质子数和电子数。( ) (4)O和S2-具有相同的质子数和电子数。( ) (5)不同的核素可能具有相同的质子数,可能具有相同的中子数,可能具有相同的质量数,也可能质子数、中子数、质量数均不相同。( ) (6)核聚变如H+H―→He+n,因为有新微粒生成,所以该变化是化学变化。( ) 答案 (1)× (2)√ (3)× (4)√ (5)√ (6)× 2.下列说法中,正确的是( ) A.18O原子核内的中子数为8 B.16O2和18O2的化学性质几乎相同 C.HO与HO质子数不同 D.H2和D2属于同位素 答案 B 解析 18O原子核内的中子数为18-8=10,A不正确;元素的性质主要取决于元素原子的核外电子数,16O2和18O2都是由氧原子组成,故化学性质几乎相同,B正确;HO与HO质子数都为10,C不正确;H2和D2属于单质,同位素的对象是原子,D不正确。 [考法综述] 本考点在高考中主要以选择题形式出现,主要考查微粒间的关系以及对概念的辨析,属基础题。 命题法1 原子及微粒间的关系 典例1 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是( ) A.(A-N+m) mol B.(A-N) mol C.(A-N) mol D.(A-N+m) mol [解析] X原子的质子数为(A-N),一个HmX分子中所含的质子数为(A-N+m),HmX的摩尔质量为(A+m) g·mol-1,所以a g HmX中所含质子的物质的量为(A-N+m) mol。 [答案] A 【解题法】 掌握原子结构中微粒之间的关系 (1)X中,质子数(Z)=核电荷数=核外电子数 (2)质量数(A)=质子数(Z)+中子数(N) (3)阳离子Xn+的核外电子数=质子数-阳离子所带的电荷数=Z-n (4)阴离子Xm-的核外电子数=质子数+阴离子所带的电荷数=Z+m 命题法2 几个重要概念的辨析 典例2 重水(D2O)是重要的核工业原料,下列说法错误的是( ) A.氘(D)的原子核外有1个电子 B.1H与D互称同位素 C.H2O与D2O互称同素异形体 D.1HO与DO的相对分子质量相同 [解析] H2O与D2O都是化合物,而同素异形体是同一种元素形成的不同单质,故C项错误。 [答案] C 【解题法】 元素、核素、同素异形体、同位素的比较 元素 核素 同素异形体 同位素 概念 核电荷数(即质子数)相同的同一类原子的总称 具有一定数目质子和一定数目中子的一种原子 同种元素组成的不同单质之间互为同素异形体 质子数相同而中子数不同的同一元素的不同原子互为同位素 存在范围 在同一类原子之间 在原子之间 在无机物单质之间 在原子之间 命题法3 核外电子排布规律的应用 典例3 短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( ) A.元素W、X的氯化物中,各原子均满足8电子的稳定结构 B.元素X与氢形成的原子个数比为1∶1的化合物有很多种 C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D.元素Z可与元素X形成共价化合物XZ2 [解析] W是制备一种高效电池的重要材料,确定W为Li元素;X原子的最外层电子数是内层电子数的2倍,确定X是C元素;Y是地壳中含量最丰富的金属元素,确定Y是Al元素;根据原子序数依次增大,Z原子的最外层电子数是其电子层数的2倍,确定Z是S元素。W为Li元素,其氯化物为LiCl,电子式为Li+[]-,显然Li不能满足8电子稳定结构,A错误;C元素和H元素形成的原子个数比为1∶1的有机物有多种,如C2H2、C6H6、C8H8等,B正确;金属Al与氢氧化钠溶液或盐酸都反应产生氢气,C正确;S元素和C元素形成的CS2属于共价化合物,D正确。 [答案] A 【解题法】 1~18号元素原子结构的特征 (1)原子核中无中子的原子:H。 (2)最外层有1个电子的元素:H、Li、Na。 (3)最外层有2个电子的元素:Be、Mg、He。 (4)最外层电子数等于次外层电子数的元素:Be、Ar。 (5)最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。 (6)电子层数与最外层电子数相等的元素:H、Be、Al。 (7)电子总数为最外层电子数2倍的元素:Be。 (8)次外层电子数是最外层电子数2倍的元素:Li、Si。 (9)内层电子总数是最外层电子数2倍的元素:Li、P。 (10)电子层数是最外层电子数2倍的原子有Li。 (11)最外层电子数是电子层数2倍的原子有He、C、S。 (12)最外层电子数是电子层数3倍的原子有O。 1.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。关于 Lv的叙述错误的是( ) A.原子序数 116 B.中子数 177 C.核外电子数 116 D.相对原子质量 293 答案 D 解析 原子序数=质子数=核电荷数=核外电子数,中子数=质量数-质子数。 Lv的质量数是293,不能确定其相对原子质量,D选项错误。 2.短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( ) A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) B.Y分别与Z、W形成的化合物中化学键类型相同 C.X的最高价氧化物对应的水化物的酸性比W的弱 D.Y的气态简单氢化物的热稳定性比W的强 答案 D 解析 X原子的最外层电子数是其内层电子数的2倍,所以X有2个电子层,是碳元素;地壳中含量最高的元素是氧,故Y为氧元素;Z2+与O2-具有相同的电子层结构,故Z是镁元素;W与X同主族,原子序数比X大的同主族元素是硅。由X、Y、Z、W在周期表中的位置可知,原子半径的大小顺序应为r(Z)>r(W)>r(X)>r(Y),A错误;Y与Z、W形成的化合物分别为MgO、SiO2,其中MgO中的化学键是离子键,SiO2中的化学键是共价键,二者化学键类型不同,B错误;H2CO3的酸性比H2SiO3的酸性强,C错误;H2O的热稳定性比CH4强,CH4的热稳定性比SiH4强,故H2O的热稳定性比SiH4的强,D正确。 3.230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是( ) A.Th元素的质量数是232 B.Th元素的相对原子质量是231 C.232Th转化成233U是化学变化 D.230Th和232Th的化学性质相同 答案 D 解析 元素无质量数,A选项错误;元素的相对原子质量与同位素的相对原子质量及各同位素的丰度有关,B选项错误;C选项的相互转化原子核发生变化,由化学变化的最小微粒是原子可知错误;原子的质子数和核外电子排布均相同,所以化学性质相同,D选项正确。 4.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R原子完全转化为R2-时,含有电子的物质的量是( ) A. mol B. mol C. mol D. mol 答案 D 解析 R原子的质子数为(m-n),其核外电子数也为(m-n),所以R2-的核外电子数为(m-n+2),而w g R原子的物质的量为 mol,所以形成的R2-含有的电子为 mol,故选D。查看更多