- 2021-07-03 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版自然界中的元素——阶段验收_章章清
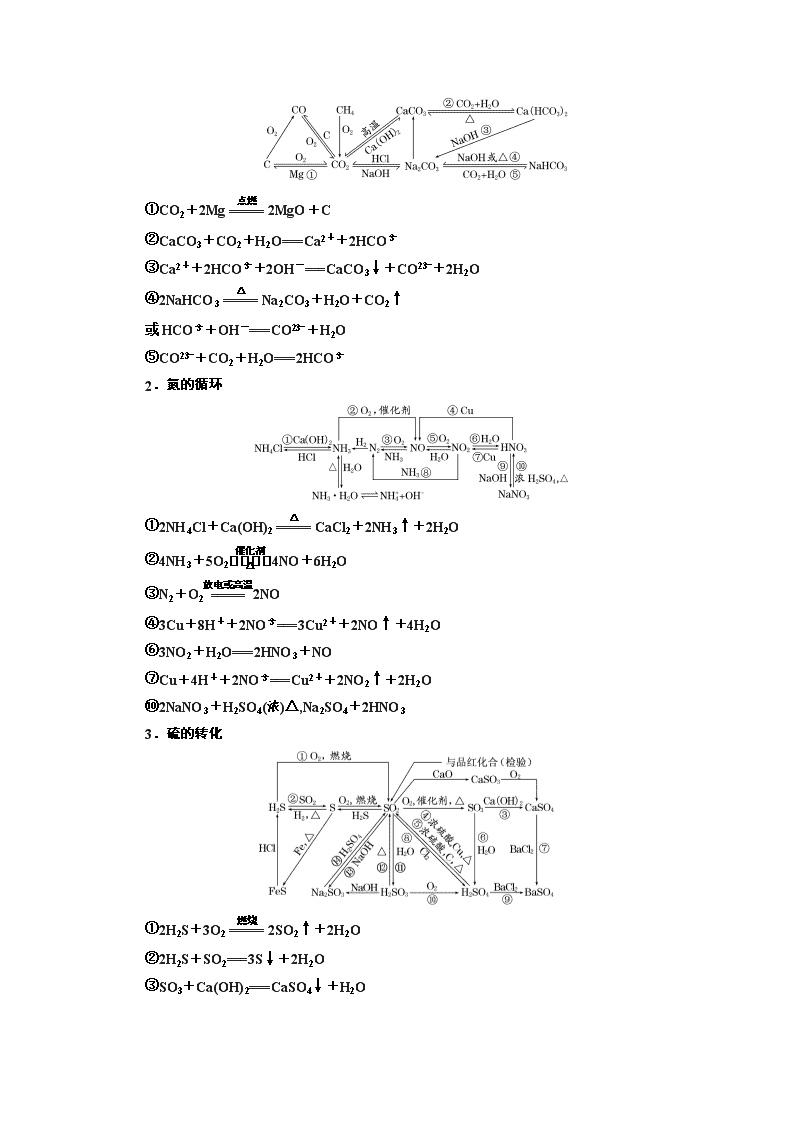
自然界中的元素 一、辨清易错易混不失分 1.碳的多样性 (1)金刚石、石墨和C60互为同分异构体( ) (2)将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2( ) (3)通过水除去CO中的CO2( ) (4)通过灼热CuO除去H2中的CO( ) (5)分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠出现,则说明两种物质均受热分解( ) (6)苏打是面包发酵粉的主要成分之一( ) (7)NaHCO3溶液中加入稀盐酸:CO+2H+===H2O+CO2↑( ) (8)向小苏打和苏打溶液中分别加入盐酸,均有气泡冒出,说明两者均能与盐酸反应( ) (9)用酚酞溶液可鉴别饱和食盐水与饱和纯碱溶液( ) (10)确定NaCl溶液中是否混有Na2CO3的方法是取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊( ) (11)向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊,该溶液一定是碳酸盐溶液( ) (12)利用澄清石灰水可以鉴别Na2CO3和NaHCO3溶液( ) 答案:(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)√ (9)√ (10)√ (11)× (12)× 2.氮的循环 (1)焊接金属、填充灯泡、贮存粮食、罐头、水果等,常用氮气作保护气以防止氧化或腐烂( ) (2)NH3经催化氧化生成NO属于氮的固定( ) (3)氮的氧化物是造成光化学烟雾的主要原因,汽车尾气大量排放会造成光化学烟雾( ) (4)浓硝酸应盛放在带有橡皮塞的棕色细口瓶里( ) (5)铁不能溶于冷的浓硝酸中,说明铁不能与冷的浓硝酸反应( ) (6)硝酸与任何金属氧化物反应时均只表现酸性( ) (7)如果不慎接触过多的氨气,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛( ) (8)可以加热分解氯化铵制备氨气( ) (9)铵盐可作氮肥,贮藏时要密封包装并放在阴凉处,施肥时应埋在土下并及时灌水以保证肥效( ) (10)所有铵盐与NaOH溶液的反应都可表示为NH+OH-===NH3↑+H2O( ) (11)将镁条放入氯化铵溶液中有气体放出( ) 答案:(1)√ (2)× (3)√ (4)× (5)× (6)× (7)√ (8)× (9)√ (10)× (11)√ 3.硫的转化 (1)硫在自然界中仅以化合态存在( ) (2)硫与汞反应体现了硫的氧化性( ) (3)试管中残留的硫可以利用酒精洗涤( ) (4)氯气可以将铁氧化到+3价,而硫只能将铁氧化到+2价,所以氯气的氧化性大于硫的氧化性( ) (5)二氧化硫能使溴水退色,证明SO2有漂白性( ) (6)浓H2SO4具有强氧化性,不能干燥SO2( ) 答案:(1)× (2)√ (3)× (4)√ (5)× (6)× 4.海水中的元素 (1)从海水中提取物质都必须通过化学反应才能实现( ) (2)实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取( ) (3)镁表面能形成氧化膜对内部金属起保护作用,因此实验室对镁条不需要特殊保护( ) (4)镁失火可用CO2灭火器灭火( ) (5)海水中提取镁所涉及的化学反应全都是氧化还原反应( ) (6)将氯化镁晶体(MgCl2·6H2O)直接加热可制得无水氯化镁( ) (7)实验室保存液溴时要加少量水进行水封,不用橡胶塞( ) (8)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-( ) (9)I-遇淀粉变蓝色( ) (10)类比Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3( ) (11)用AgNO3溶液可以鉴别KCl和KI( ) 答案:(1)× (2)× (3)√ (4)× (5)× (6)× (7)√ (8)√ (9)× (10)× (11)√ 二、书写规范保高分 (由图示写出标号的反应的化学方程式,是离子反应的写离子方程式,有明显实验现象的,描述现象) 1.碳的多样性 ①CO2+2Mg2MgO+C ②CaCO3+CO2+H2O===Ca2++2HCO ③Ca2++2HCO+2OH-===CaCO3↓+CO+2H2O ④2NaHCO3Na2CO3+H2O+CO2↑ 或HCO+OH-===CO+H2O ⑤CO+CO2+H2O===2HCO 2.氮的循环 ①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ②4NH3+5O24NO+6H2O ③N2+O22NO ④3Cu+8H++2NO===3Cu2++2NO↑+4H2O ⑥3NO2+H2O===2HNO3+NO ⑦Cu+4H++2NO===Cu2++2NO2↑+2H2O ⑩2NaNO3+H2SO4(浓)△,Na2SO4+2HNO3 3.硫的转化 ①2H2S+3O22SO2↑+2H2O ②2H2S+SO2===3S↓+2H2O ③SO3+Ca(OH)2===CaSO4↓+H2O ④2H2SO4(浓)+CuCuSO4+SO2↑+2H2O ⑤2H2SO4(浓)+C2SO2↑+CO2↑+2H2O ⑦CaSO4+BaCl2===BaSO4↓+CaCl2 ⑧SO2+Cl2+2H2O===H2SO4+2HCl ⑩2H2SO3+O2===2H2SO4 ⑪SO2+H2O===H2SO3 ⑫H2SO3H2O+SO2↑ ⑬SO2+2OH-===SO+H2O 4.海水中的元素 ②Mg+Cl2MgCl2 ③MgCl2(熔融)Mg+Cl2↑ ④3Mg+N2Mg3N2 ⑤Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑ ⑥MgCO3+CO2+H2O===Mg2++2HCO ⑦Mg2++2HCO+4OH-===Mg(OH)2↓+2CO+2H2O ⑧Cl2+2Br-===2Cl-+Br2 ⑨Br2+2I-===2Br-+I2 ⑩Cl2+2I-===2Cl-+I2 [综合评估验收] (对应配套卷P293) 一、选择题(每个小题只有一个选项符合题意,每题5分,共50分) 1.为建设“蓝天常在、青山常在、绿水常在”的美丽中国,国务院颁布了《水污染防治行动计划》。下列做法不利于该目标实现的是( ) A.推广使用无磷洗涤剂 B.用O3替代Cl2作饮用水消毒剂 C.用工业污水直接灌溉农田 D.含Cr3+的废水用适量石灰处理后排放 解析:选C A项,磷元素可以造成水体富营养化,推广使用无磷洗涤剂可以减少水污染,正确;B项,臭氧作氧化剂,产物是水,没有污染,正确;C项,工业污水含有很多有害物质,可以造成水污染,错误;D项,Cr3+和石灰水反应生成Cr(OH)3沉淀,除去Cr3+的水可以排放,正确。 2.(2018·唐山模拟)战国所著《周礼》中记载沿海古人“煤饼烧砺房成灰”(“砺房”即牡蜗壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是( ) A.CaO B.Na2CO3 C.SiO2 D.CaCO3 解析:选A 牡蜗壳的主要成分是碳酸钙,受热分解生成氧化钙,氧化钙溶于水即得到强碱氢氧化钙。 3.有a、b、c、d、e五种气体,进行下列实验,a、b、c、d、e依次可能是( ) (1)a和b混合 气体变红棕色 (2)c和d混合 产生白烟 (3)c和e分别通入少量溴水中 溴水都变成无色透明的液体 (4)b和e分别通入氢硫酸中 都产生淡黄色浑浊 A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3 C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4 解析:选C a和b混合后气体变成红棕色,可知a和b分别为NO与O2中的一种;b通入氢硫酸中产生淡黄色沉淀,则b为O2,a为NO;c和d混合产生白烟,则c和d分别为NH3、HCl中的一种;c通入少量溴水中溴水变成无色透明的液体,则c为NH3,d为HCl;e通入少量溴水中,溴水变成无色透明的液体,e通入氢硫酸中产生淡黄色浑浊,则e为SO2。 4.(2018·山东、安徽大联考)一种制取粗碘的工艺流程如图所示,下列有关说法正确的是( ) A.步骤①中H2O2作还原剂 B.步骤②③中均用到分液漏斗 C.步骤③④互为可逆反应 D.步骤⑤中“操作X”为蒸馏 解析:选B A项,步骤①中H2O2作氧化剂,将I-氧化为I2,错误;B项,步骤②为萃取、分液操作,步骤③为分液操作,均用到分液漏斗,正确;C项,步骤③为I2与NaOH反应生成I-、IO,步骤④为I-、IO在酸性条件下反应生成I2,条件不同,不是可逆反应,错误;D项,I2易溶于有机溶剂中,生成的I2应该先萃取然后分液,最后蒸馏可得到粗碘,因此步骤⑤中“操作X”为萃取、分液和蒸馏,错误。 5.甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。 下列推断错误的是( ) A.若甲为焦炭,则丁可能是O2 B.若甲为N2,则丙可能是NO2 C.若甲为Cl2,则丁可能是Fe D.若甲为NaOH溶液,则丁可能是CO2 解析:选B 若甲为焦炭,丁是O2,乙是CO,丙是CO2,CO2和焦炭反应又生成CO,A正确;甲为N2,丙是NO2时,丁是O2,乙是NO,NO2和N2反应不能生成NO,B错误;甲为Cl2,丁是Fe时,乙是FeCl3,丙是FeCl2,FeCl2又可与Cl2反应生成FeCl3,C正确;甲为NaOH溶液,丁是CO2时,乙为Na2CO3,丙为NaHCO3,符合转化关系,D正确。 6.(2018·山东日照模拟)下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( ) A.利用甲装置,验证SO2或H2SO3具有氧化性 B.利用乙装置,验证元素的非金属性:Cl>C>Si C.利用丙装置,进行NH3的干燥、收集、尾气处理 D.利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 解析:选B A项,若装置中出现黄色浑浊,可以验证SO2或H2SO3具有氧化性,正确;B项,因为浓盐酸具有挥发性,挥发出的HCl也能使烧杯中出现白色沉淀,所以该装置不能证明元素的非金属性:C>Si,错误;C项,用碱石灰干燥NH3,用向下排空气法收集NH3,用水吸收NH3时要防止倒吸,正确;D项,蔗糖脱水炭化,同时生成SO2,可以证明浓H2SO4具有脱水性、强氧化性,品红溶液退色可以证明SO2具有漂白性,酸性KMnO4溶液退色可以证明SO2具有还原性,正确。 7.建构数学模型来研究化学问题,既直观又简洁,下列建构的数轴模型正确的是( ) A.钠在氧气中燃烧,钠的氧化产物: B.铁在Cl2中燃烧,铁的氧化产物: C.AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: D.FeI2溶液中通入Cl2,铁元素存在形式: 解析:选D A项,钠在氧气中燃烧,只生成过氧化钠,错误;B项,铁在Cl2中燃烧,只生成氯化铁,错误;C项,氯化铝与氢氧化钠溶液反应,当氢氧化钠少量时发生Al3++3OH-===Al(OH)3↓,但氢氧化钠过量时发生Al3++4OH-===AlO+2H2O,错误;D项,FeI2溶液中通入Cl2,当=1∶1,发生的离子反应为2I-+Cl2===I2+2Cl-,当=3∶ 2时,发生的离子反应为4I-+2Fe2++3Cl2===2I2+2Fe3++6Cl-,正确。 8.将X气体通入BaCl2溶液中,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( ) 选项 X Y A SO2 H2S B Cl2 CO2 C NH3 CO2 D SO2 Cl2 解析:选B A项,在溶液中SO2和H2S反应生成单质硫沉淀:2H2S+SO2===3S↓+2H2O;B项,Cl2与BaCl2溶液不反应,再通入CO2,酸性条件下不能反应生成BaCO3沉淀;C项,NH3与BaCl2不反应,但再通入CO2,则可生成 BaCO3沉淀:2NH3+H2O+CO2+BaCl2===BaCO3↓+2NH4Cl;D项,在溶液中SO2可与Cl2反应:Cl2+SO2+2H2O===2HCl+H2SO4,反应生成的H2SO4可与BaCl2反应生成BaSO4沉淀:BaCl2+H2SO4===BaSO4↓+2HCl。 9.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 解析:选B A项,NH3收集用向下排空气法,不符合;C项,铜和稀硝酸反应不能产生NO2,且NO2的吸收不能用水,可以用NaOH溶液;D项,用浓盐酸与MnO2反应制Cl2需要加热,本装置不能满足。 10.(2018·湖南长沙模拟)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法错误的是( ) A.硝酸的物质的量浓度为2.6 mol·L-1 B.产生的NO在标准状况下的体积为4.48 L C.Cu、Cu2O与硝酸反应后剩余的HNO3为0.2 mol D.原固体混合物中Cu与Cu2O的物质的量之比为2∶1 解析:选A 由题意可知,Cu(OH)2的质量为39.2 g,其物质的量为0.4 mol,设Cu、Cu2O的物质的量分别为x mol、y mol,则x+2y=0.4,64x+144y=27.2,解得x=0.2,y=0.1,故D正确;Cu和Cu2O中的Cu都变成了+2价,转移的电子的物质的量为0.4 mol+0.2 mol=0.6 mol,根据得失电子守恒可知,生成的NO为0.2 mol,故B正确;n(NaOH)=1 mol,生成0.4 mol Cu(OH)2时消耗了0.8 mol NaOH,另外0.2 mol NaOH中和了硝酸,故C正确;硝酸总的物质的量为0.2 mol(剩余的)+0.2 mol(表现氧化性的)+0.8 mol(表现酸性的)=1.2 mol,其物质的量浓度为2.4 mol·L-1,故A错误。 二、非选择题(3个小题,共50分) 11.(16分)(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。 [查阅资料] (NH4)2SO4在260 ℃和400 ℃时分解产物不同。 [实验探究] 该小组拟选用如下列各图所示装置进行实验(夹持和加热装置略)。 实验1:连接装置A—B—C—D,检查气密性,按图示加入试剂(装置B盛0.500 0 mol·L-1盐酸70.00 mL)。通入N2排尽空气后,于260 ℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不退色。取下装置B,加入指示剂,用0.200 0 mol·L-1 NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO。 (1)仪器X的名称是________。 (2)滴定前,下列操作的正确顺序是________(填字母编号)。 a.盛装0.200 0 mol·L-1 NaOH溶液 b.用0.200 0 mol·L-1 NaOH溶液润洗 c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面 (3)装置B内溶液吸收气体的物质的量是________mol。 实验2:连接装置A—D—B,检查气密性,按图示重新加入试剂。通过N2排尽空气后,于400 ℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO,无SO。进一步研究发现,气体产物中无氮氧化物。 (4)检验装置D内溶液中有SO、无SO的实验操作和现象是__________________ ________________________________________________________________________。 (5)装置B内溶液吸收的气体是________。 (6)(NH4)2SO4在400 ℃分解的化学方程式是____________________________________ ________________________________________________________________________。 解析:(1)仪器X为圆底烧瓶。(2)对滴定管的使用:先查漏、清洗干净,再用待装液润洗,赶走气泡再调零,最后读数,故顺序为dbaec。(3)0.200 0 mol·L-1 NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL,故消耗的盐酸为0.200 0 mol·L-1×0.025 L=0.005 mol,装置B盛0.500 0 mol·L-1盐酸70.00 mL,n(HCl)=0.500 0 mol·L-1×0.07 L=0.035 mol,HCl~NH3,因此B装置吸收的NH3物质的量为0.035 mol-0.005 mol=0.03 mol。(4)检验溶液中有SO、无SO的操作:取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体。(5)根据观察到装置A、D之间的导气管内有少量白色固体,则说明白色固体只能是(NH4)2SO3,即气体中含有NH3和SO2,SO2被NaOH溶液吸收,故B装置中的稀盐酸吸收的是NH3。(6)根据实验现象和氧化还原反应的原理可知,产物有NH3、N2、H2O和SO2,故反应的化学方程式为3(NH4)2SO43SO2↑+4NH3↑+N2↑+6H2O↑。 答案:(1)圆底烧瓶 (2)dbaec (3)0.03 (4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体 (5)NH3 (6)3(NH4)2SO43SO2↑+4NH3↑+N2↑+6H2O↑ 12.(16分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。 (1)实验步骤: ①按如图(夹持仪器未画出)组装好实验装置后,首先进行的操作是____________________。 ②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。 ③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________________________________________________________________。 ④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______________________________________________________ ________________________________________________________________________。 ⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。 (2)关于该实验方案,回答下列问题。 ①若加热反应后不鼓入空气,对测定结果的影响是 ________________________________________________________________________ ________________________________________________________________________。 ②E处干燥管中盛放的药品是_______________,其作用是 ________________________________________________________________________, 如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”“偏小”或“无影响”)。 ③若样品质量为w g。反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为______________________(用含w、m1、m2的代数式表示)。 解析:(1)①组装好实验装置后首先应检查装置气密性。③由于装置中存在CO2和水蒸气,应先除去装置中的CO2和水蒸气。④由物质的性质可知该装置在加热时发生的反应为2NaHCO3Na2CO3+H2O↑+CO2↑、Na2CO3·10H2ONa2CO3+10H2O↑。(2)①加热后有部分CO2和水蒸气会残留在装置中,必须鼓入空气使其完全被吸收,若不鼓入空气,则测得的NaHCO3和Na2CO3·10H2O的质量分数偏小,NaCl的质量分数偏大。②装置E是防止空气中的CO2和水蒸气进入装置D,故干燥管中盛放的药品是碱石灰,如果没有该装置,会使测得的NaHCO3的质量偏大。③由题目信息知反应放出的CO2的质量为m2 g,根据反应方程式2NaHCO3Na2CO3+H2O↑+CO2↑,可计算出该反应中产生的水的质量为 g,从而计算出Na2CO3·10H2O分解产生水的质量为g,再根据Na2CO3·10H2ONa2CO3+10H2O↑计算出Na2CO3·10H2O的质量,最后计算出Na2CO3·10H2O的质量分数。 答案:(1)①检查装置气密性 ③除去装置中的水蒸气和CO2 ④2NaHCO3Na2CO3+H2O↑+CO2↑、 Na2CO3·10H2ONa2CO3+10H2O↑ (2)①Na2CO3·10H2O和NaHCO3的质量分数测定结果偏小,NaCl的质量分数测定结果偏大 ②碱石灰 防止空气中的CO2和水蒸气进入D中影响测定结果 偏大 ③×100% 13.(18分)(2018·长沙模拟)汽车尾气中的CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。 (1)氧化还原法消除NOx的转化如下: NONO2N2 ①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是________ mol。 ②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为________。 (2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。 装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO和NO,请写出生成等物质的量的NO和NO时的离子方程式:__________________________________。 (3)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的________(填“阳极”或“阴极”),同时在另一极生成S2O的电极反应式为________________________________________________。 (4)已知进入装置Ⅳ的溶液中NO的浓度为a g·L-1,要使1 m3该溶液中的NO完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气________ L(用含a的代数式表示,结果保留整数)。 解析:(1)①在反应NO+O3===NO2+O2中,每产生1 mol 的氧气,转移电子的物质的量是2 mol,现在生成标准状况下11.2 L O2时,n(O2)=0.5 mol,所以转移电子的物质的量是1 mol。②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3∶2时,反应方程式是6NO2+4CO(NH2)2===7N2+4CO2+8H2O,在该反应中,NO2是氧化剂,生成还原产物N2;CO(NH2)2是还原剂,生成氧化产物N2,所以氧化产物与还原产物的质量比为4∶3。(2)在酸性条件下,NO被Ce4+氧化的产物主要是NO、NO,根据电子守恒、电荷守恒、原子守恒可得生成等物质的量的NO和NO时的离子方程式是2NO+3H2O+4Ce4+===NO+NO+6H++4Ce3+。(3)用质子交换膜电解槽电解Ce3+使得Ce4+再生,再生时Ce3+失去电子,被氧化,所以生成的Ce4+在电解槽的阳极,同时在另一极发生还原反应生成S2O,电极反应式为2H++2HSO+2e-===S2O+2H2O。(4)进入装置Ⅳ的溶液中,NO的浓度为a g·L-1,要使1 m3该溶液中的NO完全转化为NH4NO3,则失去电子:1 000×。 设消耗标准状况下氧气的体积是V,则得电子:×2×(2-0)。根据电子守恒1 000×=×2×(2-0)。解得V≈243a。 答案:(1)①1 ②4∶3 (2)2NO+3H2O+4Ce4+===NO+NO+6H++4Ce3+ (3)阳极 2H++2HSO+2e-===S2O+2H2O (4)243a查看更多