北京版2021高考化学一轮复习专题九化学反应中的能量变化精练含解析
专题九 化学反应中的能量变化
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
化学反应中能量变化的有关概念及计算
1.通过化学键的断裂和形成,能说明化学反应中能量变化的原因。
2.通过化学能与热能的相互转化,认识常见的能量转化形式及其重要应用。
2019北京理综,27(1)
2017北京理综,26(1)
2015北京理综,9
中
化学平衡
★★★
热化学方程式的书写及正误判断
能正确书写热化学方程式并根据盖斯定律进行有关计算。
2018北京理综,27(1)
2017北京理综,26(1)
中
化学平衡
★★★
分析解读 高考对本部分知识的考查主要集中在以下几个方面:一是能量的转化及其应用,主要涉及能量变化的本质,物质能量高低与稳定性的关系,以图像的形式表示能量变化过程的分析;二是热化学方程式的书写,主要根据题给信息正确书写有限制条件的热化学方程式,通过化学键与能量的关系计算反应热等;三是盖斯定律的应用,主要是利用盖斯定律计算反应热的数值。本专题在高考题中的出现频率极高,难度多集中在盖斯定律的应用。考查考生变化观念与平衡思想、证据推理与模型认知、科学态度与社会责任的学科核心素养。
【真题探秘】
- 19 -
破考点 练考向
【考点集训】
考点一 化学反应中能量变化的有关概念及计算
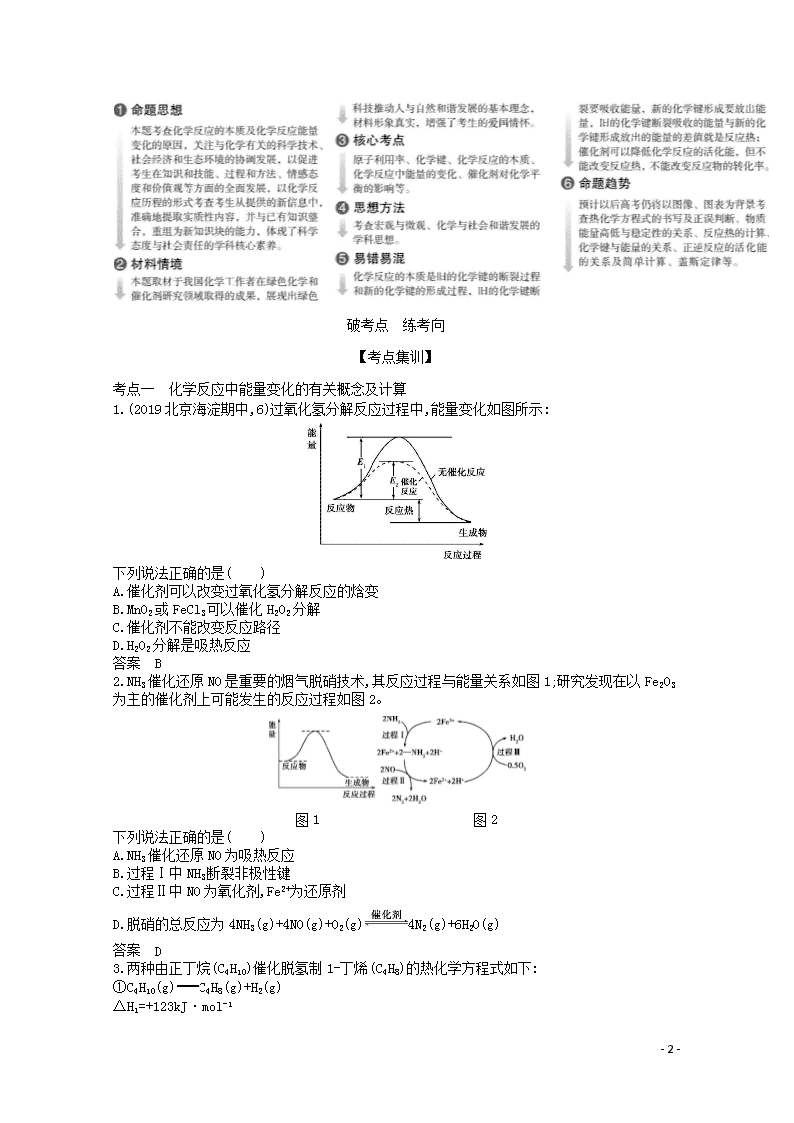
1.(2019北京海淀期中,6)过氧化氢分解反应过程中,能量变化如图所示:
下列说法正确的是( )
A.催化剂可以改变过氧化氢分解反应的焓变
B.MnO2或FeCl3可以催化H2O2分解
C.催化剂不能改变反应路径
D.H2O2分解是吸热反应
答案 B
2.NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图2。
图1 图2
下列说法正确的是( )
A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g)
答案 D
3.两种由正丁烷(C4H10)催化脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)C4H8(g)+H2(g)
ΔH1=+123kJ·mol-1
- 19 -
②C4H10(g)+1/2O2(g)C4H8(g)+H2O(g)
ΔH2=-119kJ·mol-1
下列说法中不正确的是( )
A.①中有极性键断裂,同时有非极性键形成
B.①中使用不同的催化剂,ΔH1不变
C.②中反应物总能量低于生成物总能量
D.1molC4H10(g)完全燃烧释放的能量大于119kJ
答案 C
考点二 热化学方程式的书写及正误判断
4.下列依据热化学方程式得出的结论正确的是( )
A. 已知2C(s)+2O2(g)2CO2(g) ΔH=a,2C(s)+O2(g)2CO(g) ΔH=b,则a>b
B.已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.3kJ·mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
C.已知2H2(g)+O2(g)2H2O(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
D.已知CH4(g)+H2O(g)CO(g)+3H2(g)ΔH=+206.1kJ·mol-1,反应过程中使用催化剂,ΔH减小
答案 B
5.(2019北京石景山期末,11)已知:2H2O(l)2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程 Ⅱ 热化学方程式:3FeO(s)+H2O(l)H2(g)+Fe3O4(s) ΔH=+128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环分解水制H2具有成本低、产物易分离等优点
答案 C
6.(2019北京昌平期末,16)天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)CH4(g)+H2O(g) ΔH1=-206kJ/mol,CO(g)+H2O(g)H2(g)+CO2(g) ΔH2=-41kJ/mol。
①CO2转化为CH4的热化学方程式是___________________________________。
②有利于提高混合气中CH4含量的措施是______________。
a.使用催化剂 b.升高温度 c.及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示:
①电极b是______极(填“正”或“负”)。
- 19 -
②电极a的电极反应式是______________________。
答案 (1)①CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-165kJ/mol ②c
(2)①正 ②CH4-8e-+2H2OCO2+8H+
炼技法 提能力
【方法集训】
方法 反应热大小的比较及计算
1.氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应2H2(g)+O2(g)2H2O(g)能自发进行,该反应的ΔH<0
B.氢氧燃料电池的负极反应为O2+2H2O+4e-4OH-
C.常温常压下,氢氧燃料电池放电过程中消耗11.2LH2,转移电子的数目为6.02×1023
D.反应2H2(g)+O2(g)2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和
答案 A
2.①2C(s)+O2(g)2CO(g) ΔH=-221kJ·mol-1;②稀溶液中,H+(aq)+OH-(aq)H2O(l) ΔH=-57.3kJ·mol-1。下列结论正确的是( )
A.碳的燃烧热为ΔH=-110.5kJ·mol-1
B.反应①的ΔH<0,ΔS>0,则ΔG<0,在任意温度下反应均可自发进行
C.反应①中反应物的总键能大于生成物的总键能
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量大于57.3kJ
答案 B
3.下列说法正确的是( )
A.乙醇的燃烧热ΔH=-akJ·mol-1,则乙醇燃烧的热化学方程式可表示为C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH=-akJ·mol-1
B.稀硫酸与稀 NaOH 溶液反应的中和热为-57.3kJ·mol-1
C.S(g)+O2(g)SO2(g) ΔH=-akJ·mol-1,S(s)+O2(g)SO2(g) ΔH=-bkJ·mol-1,则a>b
D.500℃、30MPa 下,将 0.5molN2和 1.5molH2置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6kJ·mol-1
答案 C
【五年高考】
考点一 化学反应中能量变化的有关概念及计算
A组 自主命题·北京卷题组
1.(2015北京理综,9,6分)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
答案 C
- 19 -
2.(2013北京理综,6,6分)下列设备工作时,将化学能转化为热能的是( )
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
答案 D
3.(2019北京理综,27节选)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是_______________________________________。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用__________________________________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是____________(选填字母序号)。
a.促进CH4转化
b.促进CO转化为CO2
c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率___________(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因:_______________________________________。
答案 (1)①CH4+2H2O4H2+CO2
②C(s)+2H2O(g)CO2(g)+2H2(g)或C(s)+CO2(g)2CO(g)
③abc
④降低 CaO+CO2CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积
4.(2015北京理综,26,12分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是____________________________。
- 19 -
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是________(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是__________________________。
③经检测,H2SO4层中c(H+)∶c(SO42-)=2.06∶1。其比值大于2的原因是__________________________。
(3)反应Ⅱ:2H2SO4(l)2SO2(g)+O2(g)+2H2O(g)
ΔH=+550kJ·mol-1。
它由两步反应组成:ⅰ.H2SO4(l)SO3(g)+H2O(g) ΔH=+177kJ·mol-1;ⅱ.SO3(g)分解。
L(L1、L2)、X可分别代表压强或温度。如图表示L一定时,ⅱ中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是_______________________。
②判断L1、L2的大小关系,并简述理由:___________________________________________________。
答案 (1)SO2+I2+2H2OH2SO4+2HI
(2)①a、c
②观察颜色,颜色深的是HI层,颜色浅的是H2SO4层
③H2SO4层中含有少量HI
(3)①压强
②L1
T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45mol·L-1
(4)环戊二烯可用于制备二茂铁[Fe(C5H5)2,结构简式为],后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为____________,总反应为__________________________。电解制备需要在无水条件下进行,原因为____________________________________________________________________________。
答案 (1)89.3 (2)40% 3.56×104 BD
(3)CD (4)Fe电极
水会阻碍中间物Na的生成;水会电解生成OH-,进一步与Fe2+反应生成Fe(OH)2
考点二 热化学方程式的书写及正误判断
A组 自主命题·北京卷题组
1.(2018北京理综,27节选)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
(1)反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g)
ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)SO2(g) ΔH3=-297kJ·mol-1
反应Ⅱ的热化学方程式:____________________________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___________________p1(填“>”或“<”),得出该结论的理由是_______________________________________。
- 19 -
答案 (1)3SO2(g)+2H2O(g)2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1
(2)> 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向进行,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大
B组 统一命题、省(区、市)卷题组
2.(2015重庆理综,6,6分)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)K2S(s)+N2(g)+3CO2(g)
ΔH=xkJ·mol-1
已知:碳的燃烧热ΔH1=akJ·mol-1
S(s)+2K(s)K2S(s) ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)2KNO3(s) ΔH3=ckJ·mol-1
则x为( )
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
答案 A
3.(2019天津理综,10,14分)多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
Ⅰ.硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,该反应的热化学方程式为_______________________________。SiHCl3的电子式为__________________。
Ⅱ.将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)3SiHCl3(g) ΔH3
(1)氢化过程中所需的高纯度H2可用惰性电极电解KOH溶液制备,写出产生H2的电极名称_____________(填“阳极”或“阴极”),该电极反应方程式为_________________________________。
(2)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是__________;相同温度下,反应②比反应①的ΔG小,主要原因是______________________。
- 19 -
(3)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是______(填序号)。
a.B点:v正>v逆
b.v正:A点>E点
c.反应适宜温度:480~520℃
(4)反应③的ΔH3=__________(用ΔH1,ΔH2表示)。温度升高,反应③的平衡常数K_______(填“增大”“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有___________(填分子式)。
答案 (14分)Ⅰ.Si(s)+3HCl(g)SiHCl3(g)+H2(g) ΔH=-225kJ·mol-1
Ⅱ.(1)阴极 2H2O+2e-H2↑+2OH-或2H++2e-H2↑
(2)1000℃ ΔH2<ΔH1导致反应②的ΔG小
(3)a、c
(4)ΔH2-ΔH1 减小
(5)HCl、H2
4.(2017课标Ⅰ,28,14分)近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_____(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________________、______________________________,制得等量H2所需能量较少的是______。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=__________%,反应平衡常数K=___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________α1,该反应的ΔH________0(填“>”“<”或“=”)。
③向反应器中再分别充入下列气体,能使H2S转化率增大的是_____(填标号)。
A.H2S B.CO2 C.COS D.N2
答案 (1)D
(2)H2O(l)H2(g)+12O2(g) ΔH=286kJ·mol-1 H2S(g)H2(g)+S(s) ΔH=20kJ·mol-1 系统(Ⅱ)
(3)①2.5 2.8×10-3 ②> > ③B
- 19 -
C组 教师专用题组
5.(2015山东理综,30,19分)合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起着重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐渐增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)zMHy(s) ΔH1(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_______(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___________mL·g-1·min-1。反应(Ⅰ)的焓变ΔH1__________0(填“>”“=”或“< ”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)________η(T2)(填“>”“=”或“<”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达平衡后反应(Ⅰ)可能处于图中的___________点(填“b”“c”或“d”),该贮氢合金可通过_________或___________的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。温度为T时,该反应的热化学方程式为__________________________________________。
已知温度为T时:
CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=+165kJ·mol-1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41kJ·mol-1
答案 (1)2y-x 30 < (2)> c 加热 减压
(3)CO(g)+3H2(g)CH4(g)+H2O(g)
ΔH=-206kJ·mol-1
6.(2013北京理综,26,14分)NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式:________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是______________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是______________________________________________--,元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
- 19 -
①Pt电极上发生的是_____反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:__________________________。
答案 (1)3NO2+H2O2HNO3+NO
(2)①N2(g)+O2(g)2NO(g) ΔH=+183kJ·mol-1
②增大
(3)①2CO+2NON2+2CO2
②根据Mg、Ca、Sr和Ba的质子数,得知它们均为ⅡA族元素。同一主族的元素,从上到下,原子半径逐渐增大
(4)①还原 ②NO+O2--2e-NO2
7.(2012北京理综,26,13分)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:ⅰ.反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
①H2O的电子式是______________。
②反应A的热化学方程式是___________________________。
③断开1molH—O键与断开1molH—Cl键所需能量相差约为_______________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl)∶n(O2),分别为1∶1、2∶1、4∶1、6∶1]下,反应温度对HCl平衡转化率影响的曲线。
①曲线b对应的投料比是___________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2∶1、温度为400℃时,平衡混合气中Cl2的物质的量分数是______________。
答案 (1)①H∶O····∶H
②4HCl(g)+O2(g)2Cl2(g)+2H2O(g)
ΔH=-115.6kJ/mol
- 19 -
③32 强
(2)①4∶1 ②投料比越高,对应的反应温度越低
③30.8%
【三年模拟】
时间:45分钟 分值:100分
一、选择题(每题6分,共48分)
1.(2020届北京海淀期中,9)利用固体表面催化工艺进行NO分解的过程如下图所示。
下列说法不正确的是( )
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成 11.2LN2转移电子数为6.02×1023
答案 D
2.(2019北京十一中期末,8)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1,可实现氯的循环利用。已知:
下列说法正确的是( )
A.升高温度能提高HCl的转化率
B.断裂H2O(g)中1molH—O键比断裂HCl(g)中1molH—Cl键所需的能量高
C.1molCl2(g)转化为2molCl放出243kJ能量
D.加入催化剂,能使该反应的焓变减小
答案 B
3.(2019北京海淀二模,10)汽车尾气处理存在反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应过程及能量变化如图所示:
下列说法正确的是( )
A.升高温度,平衡正向移动
B.该反应生成了具有非极性共价键的CO2
C.使用催化剂可以有效提高反应物的平衡转化率
D.反应物转化为活化配合物需要吸收能量
答案 D
4.(2019北京朝阳期中,10)某科研团队研制出“TM-LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意图如下:
- 19 -
下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有键发生断裂
B.合成NH3总反应的原子利用率是100%
C.“TM-LiH”能降低合成氨反应的ΔH
D.生成NH3:2LiNH+3H22LiH+2NH3
答案 C
5.(2019北京朝阳期末,9)我国某科研团队以N2为原料合成了超高含能材料聚合氮——以氮氮单键(N—N)结合的具有网状结构的聚合体。有关化学键的键能数据如下:
化学键
键能/kJ·mol-1
946
419
159
下列分析不正确的是( )
A.氮原子的结构示意图:
B.聚合氮转变为N2会释放能量
C.高温有利于聚合氮的合成
D.低压有利于聚合氮的合成
答案 D
6.(2019北京海淀期末,11)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)2HI(aq)+H2SO4(aq) ΔH1=-213kJ·mol-1
反应Ⅱ:H2SO4(aq)SO2(g)+H2O(l)+12O2(g)
ΔH2=+327kJ·mol-1
反应Ⅲ:2HI(aq)H2(g)+I2(g) ΔH3=+172kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为2H2O(l)2H2(g)+O2(g) ΔH=+286kJ·mol-1
D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
答案 C
7.(2019北京通州期末,10)白磷和红磷与氧气反应过程中的能量变化如图(E表示能量)。下列说法中正确的是( )
- 19 -
A.红磷比白磷稳定
B.白磷燃烧是吸热反应
C.红磷转变为白磷是放热反应
D.红磷燃烧的热化学方程式是4P(s)+5O2(g)P4O10(s) ΔH=(E2-E3)kJ·mol-1
答案 A
8.(2019北京丰台一模,10)CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是( )
A.已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为∶Cl····∶Cl····∶2∶Cl·····
B.相同条件下,Ea越大反应速率越慢
C.图中ΔH<0,其大小与Ea1、Ea2无关
D.CH4转化为CH3Cl的过程中,所有C—H键发生了断裂
答案 D
二、非选择题(共52分)
9.(2020届北京牛栏山一中10月月考,16)(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:
H2(g)+12O2(g)H2O(l) ΔH1=akJ·mol-1
H2(g)+12O2(g)H2O(g) ΔH2=bkJ·mol-1
则a____b(填“>”“=”或“<”)。
(2)拆开1mol气态物质中某种共价键需要吸收的能量叫键能,部分化学键键能如表。
化学键
H—H
N—H
键能/kJ·mol-1
436
a
945
已知反应N2(g)+3H2(g)2NH3(g) ΔH=-93kJ·mol-1,试根据表中所列键能数据计算a=___________。
(3)利用水煤气合成二甲醚(CH3OCH3)的三步反应如下:
①2H2(g)+CO(g)CH3OH(g) ΔH1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2
③3H2(g)+3CO(g)CO2(g)+ CH3OCH3(g) ΔH3
反应③为制取二甲醚的第3步反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用_________________________反应的ΔH。
(4)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。
- 19 -
图中CO2转化为CO的反应为CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41kJ·mol-1
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH=-128kJ·mol-1
则图中CO转化为C2H4的热化学方程式是___________________________________________。
答案 (1)<
(2)391
(3)2H2(g)+O2(g)2H2O(g)、2CO(g)+O2(g)2CO2(g)
(4)2CO(g)+4H2(g)CH2CH2(g)+2H2O(g) ΔH=-210kJ·mol-1
10.(2019北京东城十一学校零模,26)(14分)半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
(1)步骤Ⅰ,CO变换反应的能量变化如下图所示:
①CO变换反应的热化学方程式是____________________________________________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1、T2)下氢气的体积分数φ(H2)与时间的关系如下图所示。
ⅰ.T1、T2的大小关系及判断理由是_________________________________________________________。
ⅱ.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数φ(H2)随时间的变化曲线。
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是_____(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全过程:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
②后期析出固体的成分及析出固体的原因是______________________________________________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):______________________。
答案 (1)①CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-36kJ·mol-1
- 19 -
②ⅰ.T2>T1,相同条件下,温度越高反应速率越快,达到化学平衡的时间越短(CO变换反应是放热反应,温度升高时H2的体积分数减小)
ⅱ.
(2)①ac
②NaHCO3,NaHCO3的溶解度比Na2CO3的小,依据反应Na2CO3+CO2+H2O2NaHCO3,水的质量减少,溶质质量增大
③2NaHCO3Na2CO3+CO2↑+H2O
11.(2019北京朝阳一模,26)(14分)脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g)+3O2(g)+2H2O(l)4HNO3(aq) ΔH1=-423kJ·mol-1
ⅱ.Ca(ClO)2(aq)CaCl2(aq)+O2(g) ΔH2=-120kJ·mol-1
ⅲ.3Ca(ClO)2(aq)+4NO(g)+2H2O(l)4HNO3(aq)+3CaCl2(aq) ΔH3
①ΔH3=__________kJ·mol-1。
②反应ⅲ的平衡常数随温度升高的变化趋势是_______________________________________________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________________________________________________________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClONO2+HCl
b.NO+NO2+H2O2HNO2
c.HClO+HNO2HNO3+HCl
下列分析正确的是_________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
图1
- 19 -
图2
①图1中,pH降低NO脱除率增大的原因:_____________________________________________。
②脱除过程中往往有Cl2产生,原因是______________________________________。(用离子方程式表示)
③图2中,60~80℃NO脱除率下降的原因:___________________________________________。(至少答出两点)
答案 (每空2分)(1)①-783 ②减小
(2)2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(3)AC
(4)①pH降低,ClO-+H+HClO,溶液中c(HClO)增大
②HClO+Cl-+H+Cl2↑+H2O(或ClO-+Cl-+2H+Cl2↑+H2O)
③HClO受热分解,c(HClO)减小;气体溶解度降低;反应b平衡逆向移动;反应ⅲ平衡逆向移动等(合理即可)
12.(2019北京门头沟一模,26)(14分)CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪CO2将作为新碳源被广泛使用。
(1)以CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1=+247kJ·mol-1
②CH4(g)+H2O(g)CO(g)+3H2(g) ΔH2=+205kJ·mol-1
写出由CO2获得CH4的热化学方程式:___________________________________________。
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g)
按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图1所示。此反应优选温度为900℃的原因是_______________________________________________________。
图1
(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________________________________。
图2
- 19 -
②为了提高该反应中CH4的转化率,可以采取的措施是__________________________________(写出两种)。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式是_______________________________________________。
(4)O2辅助的Al-CO2电池工作原理如图3所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
图3
电池的负极反应式:______________________________。
电池的正极反应式:2CO2+2e-C2O42-
该过程中,O2起催化作用,催化过程可表示为:
ⅰ:6O2+6e-6O2-
ⅱ:……
写出ⅱ的离子方程式:______________________。
答案 (1)CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-163kJ·mol-1(2分)
(2)900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低(2分)
(3)①温度超过250℃时,催化剂的催化效率降低(2分)
②增大体系压强、增大CO2的浓度(2分)
③3Cu2Al2O4+32H++2NO3-6Cu2++6Al3++2NO↑+16H2O(2分)
(4)Al-3e-Al3+(或2Al-6e-2Al3+)(2分)
6CO2+6O2-3C2O42-+6O2(2分)
- 19 -