【新高考】2021高考化学一轮考评特训:课练17 化学反应中的能量变化
www.ks5u.com
第七单元 化学反应与能量
课练17 化学反应中的能量变化
——————————[狂刷小题 夯基础]——————————
[练基础]
1.下列变化过程,属于放热反应的是( )
①工业合成氨 ②酸碱中和反应 ③水蒸气变成液态水 ④固体NaOH溶于水 ⑤Na在Cl2中燃烧 ⑥食物腐败 ⑦浓H2SO4稀释
A.①③④⑦ B.②③④⑤
C.①②⑤⑥ D.①②⑤⑦
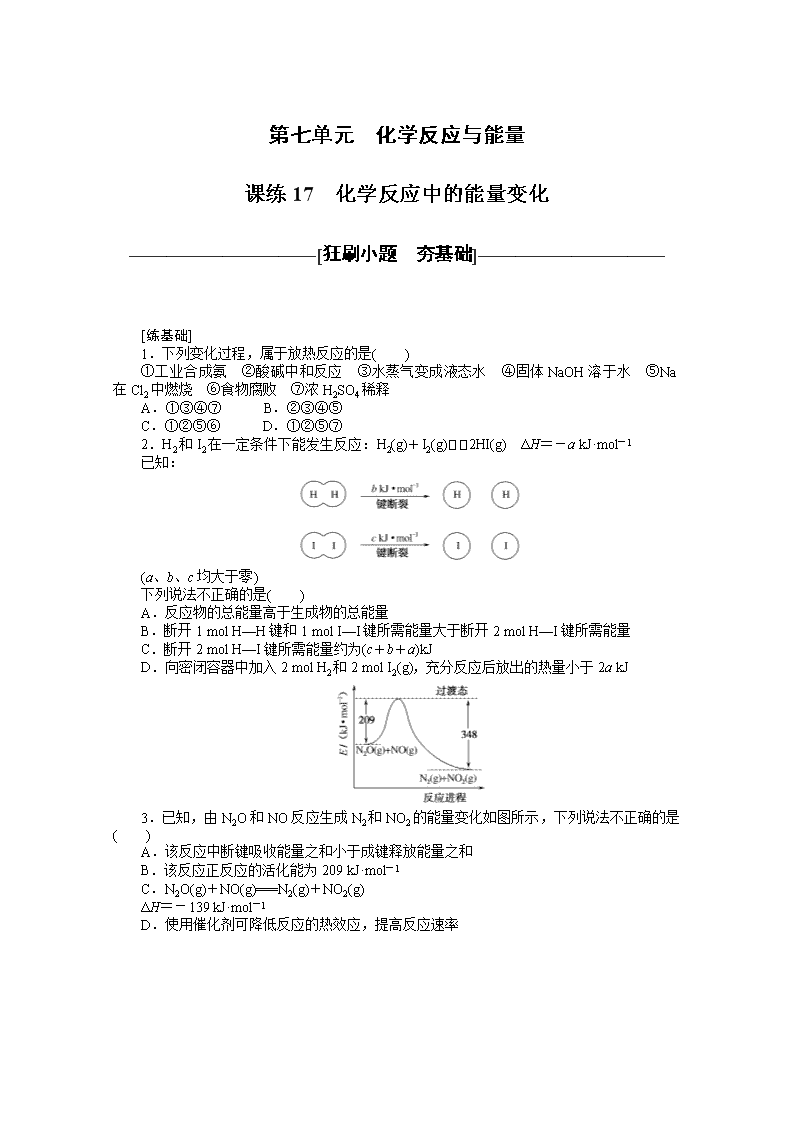
2.H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g) ΔH=-a kJ·mol-1
已知:
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2 mol H2和2 mol I2(g),充分反应后放出的热量小于2a kJ
3.已知,由N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法不正确的是( )
A.该反应中断键吸收能量之和小于成键释放能量之和
B.该反应正反应的活化能为209 kJ·mol-1
C.N2O(g)+NO(g)===N2(g)+NO2(g)
ΔH=-139 kJ·mol-1
D.使用催化剂可降低反应的热效应,提高反应速率
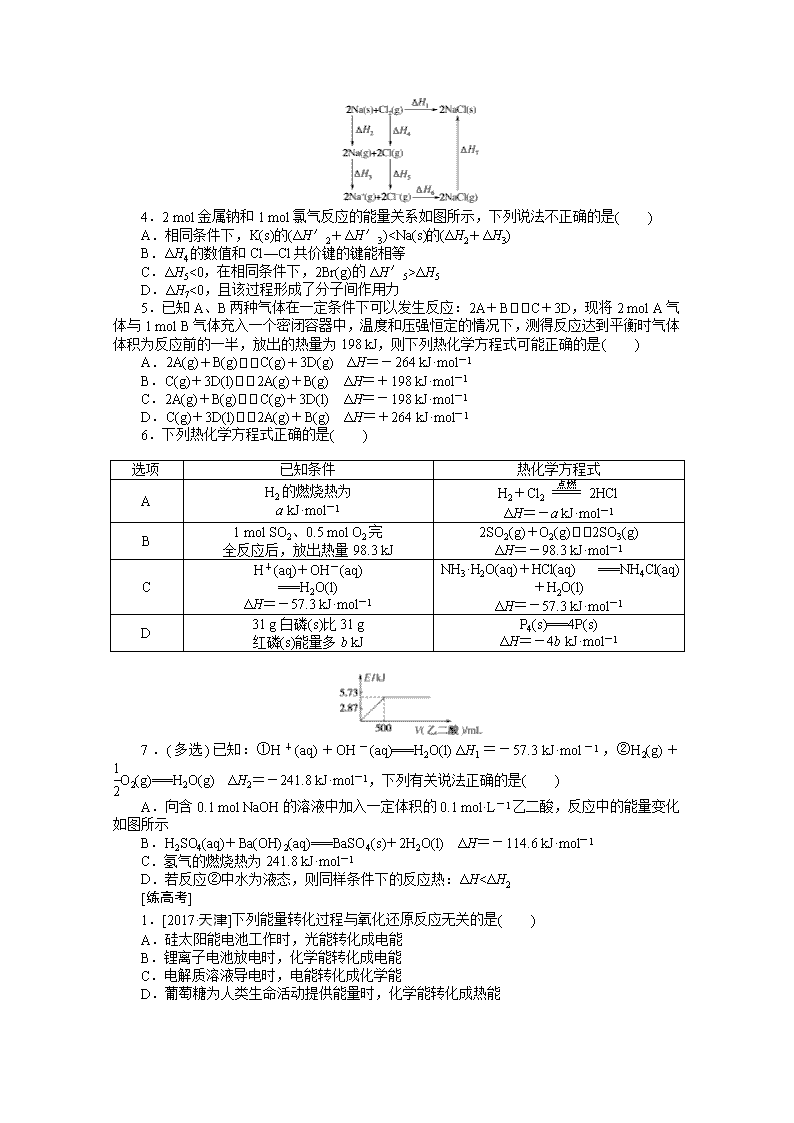
4.2 mol金属钠和1 mol氯气反应的能量关系如图所示,下列说法不正确的是( )
A.相同条件下,K(s)的(ΔH′2+ΔH′3)
ΔH5
D.ΔH7<0,且该过程形成了分子间作用力
5.已知A、B两种气体在一定条件下可以发生反应:2A+BC+3D,现将2 mol A气体与1 mol B气体充入一个密闭容器中,温度和压强恒定的情况下,测得反应达到平衡时气体体积为反应前的一半,放出的热量为198 kJ,则下列热化学方程式可能正确的是( )
A.2A(g)+B(g)C(g)+3D(g) ΔH=-264 kJ·mol-1
B.C(g)+3D(l)2A(g)+B(g) ΔH=+198 kJ·mol-1
C.2A(g)+B(g)C(g)+3D(l) ΔH=-198 kJ·mol-1
D.C(g)+3D(l)2A(g)+B(g) ΔH=+264 kJ·mol-1
6.下列热化学方程式正确的是( )
选项
已知条件
热化学方程式
A
H2的燃烧热为
a kJ·mol-1
H2+Cl22HCl
ΔH=-a kJ·mol-1
B
1 mol SO2、0.5 mol O2完
全反应后,放出热量98.3 kJ
2SO2(g)+O2(g)2SO3(g)
ΔH=-98.3 kJ·mol-1
C
H+(aq)+OH-(aq)
===H2O(l)
ΔH=-57.3 kJ·mol-1
NH3·H2O(aq)+HCl(aq) ===NH4Cl(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1
D
31 g白磷(s)比31 g
红磷(s)能量多b kJ
P4(s)===4P(s)
ΔH=-4b kJ·mol-1
7.(多选)已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,②H2(g)+O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
A.向含0.1 mol NaOH的溶液中加入一定体积的0.1 mol·L-1乙二酸,反应中的能量变化如图所示
B.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C.氢气的燃烧热为241.8 kJ·mol-1
D.若反应②中水为液态,则同样条件下的反应热:ΔH<ΔH2
[练高考]
1.[2017·天津]下列能量转化过程与氧化还原反应无关的是( )
A.硅太阳能电池工作时,光能转化成电能
B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
2.[2016·海南](多选)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是( )
A.由X→Y反应的ΔH=E5-E2
B.由X→Z反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
3.[2015·上海]已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2―→H2O+O2+Q
D.反应物的总能量高于生成物的总能量
4.[2018·北京]我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.①→②放出能量并形成了C—C键
D.该催化剂可有效提高反应物的平衡转化率
5.[2016·江苏]通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g) ΔH2=131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·mol-1
[练模拟]
1.[2019·福州质量抽测]已知化学反应A2(g)+B2(g)===2AB(s)的能量变化如图所示,下列叙述正确的是( )
A.该反应可以自发进行
B.ΔH=+(a-b)kJ·mol-1
C.使用催化剂可以减小a、b的差值
D.1 mol A2和1 mol B2完全分解为气态原子需放出a kJ能量
2.[2019·山东八校联考]利用H2和O2制备H2O2的原理如下:
Ⅰ.H2(g)+A(l)===B(l) ΔH1
Ⅱ.O2(g)+B(l)===A(l)+H2O2(l) ΔH2
已知:①A、B均为有机物,两个反应在一定条件下均能自发进行;
②I为快反应,Ⅱ为慢反应;
③ΔH1<ΔH2。
则下列说法正确的是( )
A.ΔH1<0;ΔH2>0
B.A、B均为该反应的催化剂
C.总反应的活化能等于两个分步反应的活化能之和
D.该反应的历程可用如图表示
3.[2019·资阳期末]下列热化学方程式正确的是(ΔH的绝对值均正确)
A.CH3OH(g)的燃烧热为192.9 kJ·mol-1,则CH3OH(g)燃烧热的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
B.OH-(aq)+H+(aq)===H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1(反应热)
D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
4.[2019·厦门月考]在25℃、101 kPa下,0.1 mol甲醇完全燃烧生成CO2和液态水时放出热量72.58 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)
ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-725.8 kJ·mol-1
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)
ΔH=-725.8 kJ·mol-1
D.2CH2OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 451.6 kJ·mol-1
—————————[综合测评 提能力]—————————
一、选择题:本题共7小题,每小题2分,共14分。每小题只有一个选项符合题意。
1.已知一些燃料的燃烧热数据如下:
燃料
一氧化碳
甲烷
异辛烷(C8H18)
乙醇
燃烧热
283.0 kJ
·mol-1
891.0 kJ
·mol-1
5 461 kJ
·mol-1
1 306.8 kJ
·mol-1
使用上述燃料,最不符合“低碳经济”理念的是( )
A.一氧化碳 B.甲烷
C.异辛烷 D.乙醇
2.反应Ⅰ:CaSO4(s)+4CO(g)CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol-1;反应Ⅱ:CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol-1。假设某温度下,反应I的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( )
3.NO与CO在金属铑(Rh)的催化下发生反应2NO(g)+CO(g)N2O(g)+CO2(g)ΔH,该反应需要经历如下两步:
Ⅰ.NO(g)+CO(g)+Rh(s)RhN(s)+CO2(g)
ΔH1=-33.44 kJ·mol-1
Ⅱ.RhN(s)+NO(g)Rh(s)+N2O(g)
ΔH2=-319.35 kJ·mol-1
如图所示为该反应在无催化剂(a)和有催化剂(b)时反应过程的能量关系:
下列有关判断正确的是( )
A.ΔH=-352.79 kJ·mol-1,一定条件下2 mol NO(g)和1 mol CO(g)充分反应放出的热量为352.79 kJ
B.E1为反应2NO(g)+CO(g)N2O(g)+CO2(g)的活化能
C.ΔH=E3-(E1+E2)
D.使用催化剂可降低反应的活化能,提高反应速率
4.下列说法不正确的是( )
A.已知冰的熔化热为6.0 kJ·mol-1,冰中氢键键能为20 kJ·mol-1,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数Ka=。若加水稀释,则CH3COOHCH3COO-+H+向右移动,a增大,Ka不变
C.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
5.某同学按照课本实验要求,用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热。下列说法中正确的是( )
A.实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用主要是固定小烧杯
D.若将盐酸的体积改为60 mL,理论上所求中和热不相等
6.实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
A.2FeCO3(l)+O2(g)===Fe2O3(s)+2CO2(g)
ΔH=-130 kJ·mol-1
B.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)
ΔH=+260 kJ·mol-1
C.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)
ΔH=-260 kJ·mol-1
D.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)
ΔH=+130 kJ·mol-1
7.下列说法正确的是( )
A.氢气的燃烧热为285.8 kJ·mol-1,则分解水的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时,放出19.12 kJ热量,则Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1
C.500℃、30 MPa时,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出19.3 kJ热量,则N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
D.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则0.5 mol H2SO4和0.5 mol Ba(OH)2反应放出57.3 kJ热量
二、选择题:本题共3小题,每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
8.已知断裂1 mol H2(g)中的H—H键需要吸收436.4 kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498 kJ的能量,生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量。下列说法正确的是( )
A.断裂1 mol H2O中的化学键需要吸收925.6 kJ的能量
B.2H2(g)+O2(g)===2H2O(g) ΔH=-480.4 kJ·mol-1
C.2H2O(l)===2H2(g)+O2(g) ΔH=471.6 kJ·mol-1
D.H2(g)+O2(g)===H2O(l) ΔH=-284.2 kJ·mol-1
9.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。
下列说法正确的是( )
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,但发展前景广阔
10.HI被O2氧化依次发生如下三步反应:
①HI(g)+O2(g)===HOOI(g)
②HOOI(g)+HI(g)===2HOI(g)
③HOI(g)+HI(g)===H2O(g)+I2(g)
1 mol HI(g)被氧化为I2(g)放出a kJ热量,反应进程中的能量变化曲线如图所示。下列说法正确的是( )
A.步骤①的化学反应速率最慢
B.三步反应均为放热反应
C.氧化性:O2>I2
D.热化学方程式为4HI(g)+O2(g)===2H2O(g)+2I2(g) ΔH=-a kJ·mol-1
三、非选择题:本题共3小题。
11.(6分)写出或完成下列热化学方程式。
(1)0.5 mol CH4完全燃烧生成CO2和液态水时,放出445 kJ的热量。写出CH4燃烧的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(2)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其他功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)在恒温(500 K)、体积为1.0 L的密闭容器中通入1.0 mol N2和1.0 mol H2,发
生合成氨反应N2+3H22NH3,20 min后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为________________________。
12.(8分)红磷[P(s)]和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
根据图像,回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是________________________________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=________;P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4________ΔH3(填“大于”“小于”或“等于”)。
13.(8分)按要求回答下列问题:
(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________________________________。
(2)已知:①碳的燃烧热ΔH1=a kJ·mol-1;
②S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g)的ΔH=________。
(3)已知:①C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
②H2(g)+O2(g)===H2O(g)
ΔH=-242 kJ·mol-1
③CO(g)+O2(g)===CO2(g)
ΔH=-283.0 kJ·mol-1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式:________________________________________________________________________。
计算10 m3(标准状况)水煤气完全燃烧生成CO2(g)和H2O(g)放出的热量约为________kJ。
课练17 化学反应中的能量变化
[狂刷小题 夯基础]
[练基础]
1.C ①属于放热反应;②属于放热反应;③不属于化学反应;④不属于化学反应;⑤属于放热反应;⑥属于放热反应;⑦不属于化学反应。故选C。
2.B H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g) ΔH=-a kJ·mol-1,反应是放热反应,反应物能量高于生成物,故A正确;断裂化学键吸收能量,形成化学键放出能量,反应是放热反应,所以形成化学键放出的能量大于断裂化学键吸收的能量,断开1 mol H—H键和1 mol I—I键所需能量小于断开2 mol H—I键所需能量,故B错误;ΔH=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=(b+c) kJ·mol-1-2(H—I键键能)=-a kJ·mol-1,得到断开2 mol H—I键所需能量约为(a+b+c) kJ,故C正确;反应是可逆反应,不能进行彻底,依据焓变意义分析,向密闭容器中加入2 mol H2和2 mol I2(g),充分反应后放出的热量小于2a kJ,故D正确。
3.D A项,依题图可知此反应是放热反应,因此断键吸收能量之和小于成键释放能量之和,正确;B项,根据能量变化图可知,该反应正反应的活化能为209 kJ·mol-1,正确;C项,根据能量变化图,N2O(g)+NO(g)===N2(g) +NO2(g) ΔH=(209-348) kJ·mol-1=-139 kJ·mol-1,正确;D项,使用催化剂可降低反应的活化能,加快化学反应速率,但不影响反应的热效应,错误。
4.D K比Na活泼,相同条件下K更易失去电子,则K(s)的(ΔH′2+ΔH′3)Br,故相同条件下,2Br(g)的ΔH′5>ΔH5,C项正确;NaCl为离子化合物,不能形成分子间作用力,D项错误。
5.D 设平衡时B气体转化的物质的量为x mol,则
2A + B C + 3D
起始/mol: 2 1 0 0
变化/mol: 2x x x 3x
平衡/mol: 2-2x 1-x x 3x
恒温恒压下,体积之比为物质的量之比,平衡时气体体积为反应前的一半,说明D为液态或固态,因此有=2,x=,消耗1 mol B放出的热量为198×kJ=264 kJ,因此热化学反应方程式可能为2A(g)+B(g)C(g)+3D(l) ΔH=-264 kJ·mol-1,故D可能正确。
6.D 选项A中符合已知条件的应是H2和O2反应,A错;ΔH应为-196.6 kJ·mol-1,B错;选项C中NH3·H2 O电离需要吸热,放出的热量小于57.3 kJ,C错。
7.AD 乙二酸是弱酸,向含0.1 mol NaOH的溶液中加入一定体积的0.1 mol·L-1乙二酸放出热量小于5.73 kJ,故A正确;H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l),由于有硫酸钡沉淀生成,放出的热量大于114.6 kJ,故B错误;氢气的燃烧热是生成液态水放出的热量,故C错误;若反应②中水改为液态,则同样条件下的反应热ΔH<ΔH2,故D正确。
[练高考]
1.A A项,硅太阳能电池,是直接将太阳能转化为电能的装置,不涉及氧化还原反应,正确;B项,锂离子电池放电时为原电池,原电池的基本要素之一是有自发的氧化还原反应发生,错误;C项,电能转化为化学能的装置为电解池装置,该过程涉及氧化还原反应,错误;D项,葡萄糖为人类生命活动提供能量时,是葡萄糖在人体内的氧化还原反应过程,错误。
2.BC A项,由图像可知,由X→Y反应的ΔH=E3-E2,错误;B项,由图像可知,反应物的总能量高于生成物的总能量,该反应为放热反应,ΔH<0,正确;C项,根据化学反应2X(g)3Y(g),该反应是气体体积增加的反应,降低压强,平衡正向移动,Y的产率升高,
正确;D项,该反应为放热反应,升高温度平衡逆向移动,Z的产率降低,错误。
3.D A项,加入催化剂,对反应的热效应无影响,错误;B项,加入催化剂,只能改变反应速率,不能使平衡移动,故无法提高H2O2的平衡转化率,错误;C项,热化学方程式需标明物质的状态,错误;D项,由图像知,该反应的反应物的总能量高于生成物的总能量,正确。
4.D 观察图形,发生的反应是二氧化碳和甲烷化合生成醋酸,故原子利用率为100%,A正确;甲烷生成醋酸过程中,有C—H键断裂,B正确;观察图形,①→②物质的能量降低,故反应放出能量,且形成了C—C键,C正确;催化剂只能改变反应速率,不影响平衡的转化率,D错误。
5.D A项,反应①是光能转化为化学能,错误;B项,反应②的焓变为正值,属于吸热反应,错误;C项,催化剂不改变反应焓变,错误;D项,用“反应③-反应②”得所求反应的焓变为206.1 kJ·mol-1-131.3 kJ·mol-1=74.8 kJ·mol-1,正确。
[练模拟]
1.B 该反应为吸热反应,ΔH>0,反应后气体分子数减小,ΔS<0,则ΔH-T·ΔS>0,故该反应不能自发进行,A项错误;该反应为吸热反应,ΔH=+(a-b)kJ·mol-1,B项正确;使用催化剂可以降低正、逆反应的活化能,但反应热不变,即a、b的差值不变,C项错误;1 mol A2(g)和1 mol B2(g)完全分解为气态原子需吸收a kJ能量,D项错误。
2.D A项,从两个反应特点(ΔS<0)以及“均能自发”确定两个反应的ΔH<0,均为放热反应,错误。B项,考生容易混淆催化剂与中间产物。催化剂的特点为“先消耗,后生成”,而物质B的特点为“先生成,后消耗”,属于中间产物,错误。C项,总反应的活化能与分步反应的活化能没有必然联系,错误。D项,反应速率快慢取决于活化能大小:活化能越小,反应速率越快;反应热的大小取决于反应物和生成物总能量的差值。由信息②可知活化能Ⅰ<Ⅱ;由信息③可知反应物和生成物总能量的差值Ⅰ>Ⅱ,图像正确。
3.C 应生成液态的水而不是氢气,A错误;中和反应是放热反应,B错误;D项没有注明物质的状态,D错误。
4.C 由题意知,1 mol甲醇完全燃烧生成CO2和液态水时放出热量725.8 kJ。A中,放热反应的ΔH应小于0,故A错;B中ΔH=-1 451.6 kJ·mol-1,B错;反应生成的水应为液态,故D错。
[综合测评 提能力]
1.A 最能体现“低碳经济”理念的即为生成1 mol二氧化碳放出热量最多的燃料,根据一氧化碳、甲烷、异辛烷及乙醇这4种燃料的燃烧热,则生成1 mol二氧化碳放出热量分别为283.0 kJ、891.0 kJ、kJ=682 kJ、 kJ=683.4 kJ,所以生成1 mol二氧化碳放出热量最少的为一氧化碳,故选A。
2.D 本题考查反应中能量变化、活化能对反应速率的影响等。反应Ⅰ是放热反应,反应物具有的总能量高于生成物具有的总能量;反应Ⅱ是吸热反应,反应物具有的总能量低于生成物具有的总能量,B、C错误;由题意可知,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅰ的活化能大于反应Ⅱ的活化能,故D正确,A错误。
3.D 应用盖斯定律,Ⅰ+Ⅱ可得2NO(g)+CO(g)N2O(g)+CO2(g) ΔH=ΔH1+ΔH2=-352.79 kJ·mol-1,但该反应为可逆反应,反应不能进行到底,所以2 mol NO(g)和1 mol CO(g)在一定条件下充分反应放出的热量小于352.79 kJ,A项错误;E1为反应2NO(g)+CO(g)N2O(g)+CO2(g)不使用催化剂和使用催化剂时的活化能之差,B项错误;在不使用催化剂时,正反应的活化能为E1+E2,逆反应的活化能为E3,反应的焓变为正反应活化能减去逆反应活化能,ΔH=(E1+E2)-E3,C项错误;使用合适的催化剂可降低反应的活化能,从而提高反应速率,D项正确。
4.D 1 mol冰熔化时,熔化热能破坏的氢键的物质的量为:=0.3
mol,占冰中氢键的百分数为×100%=15%,A项正确;醋酸溶液加水稀释,电离平衡向正反应方向移动,电离度增大,由于电离常数只与温度有关,Ka保持不变,B项正确;甲烷的标准燃烧热表示25 ℃、101 kPa时1 mol甲烷完全燃烧生成液态水时放出的热量,该热化学方程式正确,C项正确;合成氨的反应为可逆反应,0.5 mol N2和1.5 mol H2不能完全反应,生成的NH3小于1 mol,放热19.3 kJ,而热化学方程式N2(g)+3H2(g)2NH3(g) ΔH对应生成2 mol NH3,故放出热量大于38.6 kJ,ΔH<-38.6 kJ·mol-1,D项错误。
5.B 本题考查中和热的测定实验。该装置中大、小烧杯之间填充碎纸条,烧杯用硬纸板盖住,可减少但无法完全消除热量损失,A错误;根据题图可知,实验装置缺少环形玻璃搅拌棒,B正确;烧杯间填满碎纸条的作用除固定小烧杯外,主要是保温,减少热量的损失,C错误;中和热是以生成1 mol H2O作为基准的,若将盐酸的体积改为60 mL,生成水的量[n(H2O)]将增大,放出的热量(Q放)将增多,但所求中和热理论上不变,D错误。
6.C 本题考查热化学方程式的书写及判断。FeCO3和O2反应生成铁红放出热量,该反应是放热反应,则ΔH<0,B、D错误。反应物FeCO3是固体,书写热化学方程式时表示为FeCO3(s),A错误。160 g固体铁红(Fe2O3)的物质的量为1 mol,生成1 mol Fe2O3放出130 kJ热量,则反应4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)的ΔH=-260 kJ·mol-1,C正确。
7.B 本题考查燃烧热、中和热及热化学方程式的判断。氢气的燃烧热为285.8 kJ·mol-1,据此可得2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,根据热化学方程式的书写规则及方法,分解水的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1,A错误;9.6 g硫粉和11.2 g铁粉的物质的量分别为0.3 mol、0.2 mol,二者充分反应生成0.2 mol FeS(硫粉有剩余),放出19.12 kJ热量,则生成1 mol FeS(s)时放出的热量为19.12 kJ×5=95.6 kJ,B正确;N2和H2合成氨的反应是可逆反应,0.5 mol N2和1.5 mol H2充分反应放热19.3 kJ,此时生成的NH3(g)的物质的量小于1 mol,故N2(g)+3H2(g)2NH3(g)的ΔH<-38.6 kJ·mol-1,C错误;0.5 mol H2SO4和0.5 mol Ba(OH)2反应生成1 mol H2O,同时生成0.5 mol BaSO4,生成BaSO4也会放热,故反应放出的热量大于57.3 kJ,D错误。
8.BD 生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量,则断裂1 mol H2O(g)中的化学键需要吸收热量462.8 kJ×2=925.6 kJ,但并未说明水的状态,故A项错误;2H2(g)+O2(g)===2H2O(g) ΔH=(436.4 kJ/mol)×2+(498 kJ/mol)-2×2×(462.8 kJ/mol)=-480.4 kJ·mol-1,故B项正确;2H2O(g)===2H2O(l) ΔH=-88 kJ/mol,则2H2(g)+O2(g)===2H2O(l) ΔH=-568.4 kJ/mol,可知2H2O(l)===2H2(g)+O2(g) ΔH=+568.4 kJ·mol-1,故C错误;2H2(g)+O2(g)===2H2O(l) ΔH=-568.4 kJ/mol,则H2(g)+O2(g)===H2O(l) ΔH=-284.2 kJ·mol-1,故D项正确;故选BD。
9.CD 2H2O(l)===2H2(g)+O2(g)是吸热反应,说明2 mol液态H2O的能量低于2 mol H2和1 mol O2的能量。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。
10.AC 活化能越大,反应速率越慢,由题图可知,步骤①反应的活化能最大,则步骤①的反应速率最慢,故A正确;反应物总能量大于生成物总能量时,反应为放热反应,否则为吸热反应,由题图可知,第①步反应中反应物总能量小于生成物总能量,为吸热反应,故B错误;总反应的化学方程式为4HI(g)+O2(g)===2H2O(g)+2I2(g),氧化剂的氧化性大于氧化产物的氧化性,所以氧化性:O2>I2,故C正确;1 mol HI(g)被氧化为I2(g)放出a kJ热量,则4 mol HI(g)被氧化成I2(g)放出4a kJ热量,则总反应的热化学方程式为4HI(g)+O2(g)===2H2O(g)+2I2(g) ΔH=-4a kJ·mol-1,故D错误。
11.答案:(1)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
(2)CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=
(3)N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1
解析:本题考查热化学方程式的书写,重点考查燃烧热、盖斯定律的应用,以及热化学方程式的特点。
(1)0.5 mol CH4完全燃烧生成CO2和液态水时,放出445 kJ的热量,则1 mol CH4
完全燃烧生成CO2和液态水时,放出2×445 kJ的热量,因此CH4燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1。
(2)将题给3个热化学方程式依次编号为①②③,根据盖斯定律可知即得到CO还原FeO的热化学方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=。
(3)设参加反应的N2为x mol,对该反应列三段式:
N2 + 3H22NH3
起始量/mol 1 1 0
转化量/mol x 3x 2x
平衡量/mol 1-x 1-3x 2x
则1-x+1-3x+2x=1.6,解得x=0.2,所以消耗1 mol氮气放出的热量是5×18.4 kJ=92 kJ,则该反应的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1。
12.答案:(1)P(s)+Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ·mol-1
(3)-399 kJ·mol-1 等于
解析:本题考查热化学方程式的书写、反应热的比较、盖斯定律的应用等。
(1)由题图结合题给信息可知,P(s)和Cl2(g)反应生成1 mol PCl3(g)的ΔH1=-306 kJ·mol-1,则反应的热化学方程式为P(s)+Cl2(g)===PCl3(g) ΔH1=-306 kJ·mol-1。
(2)PCl3(g)和Cl2(g)生成1 mol PCl5(g)的ΔH2=-93 kJ·mol-1,则反应的热化学方程式为PCl3(g)+Cl2(g)===PCl5(g) ΔH2=-93 kJ·mol-1。结合ΔH的数值与反应进行方向的关系推知,PCl5(g)分解成PCl3(g)+Cl2(g)的热化学方程式为PCl5(g)===PCl3(g)+Cl2(g)
ΔH=+93 kJ·mol-1。
(3)根据盖斯定律可知,P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=ΔH1+ΔH2=(-306 kJ·mol-1)+(-93 kJ·mol-1)=-399 kJ·mol-1。根据盖斯定律可知,无论化学反应是一步完成还是分多步完成,其反应热是相同的,则有ΔH4=ΔH3。
13.答案:(1)N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1
(2)(3a+b-c) kJ·mol-1
(3)C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1 1.17×105
解析:本题考查热化学方程式的书写,涉及燃烧热、盖斯定律的应用等。
(1)N2与H2反应生成NH3的反应为N2(g)+3H2(g)2NH3(g),根据ΔH与键能的关系,可得该反应的ΔH=(946 kJ·mol-1+3×436 kJ·mol-1)-(6×391 kJ·mol-1)=-92 kJ·mol-1。
(2)①碳的燃烧热ΔH1=a kJ·mol-1,则有C(s)+O2(g)===CO2(g) ΔH1=a kJ·mol-1。根据盖斯定律,由①×3+②-③可得S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g),则ΔH=(3a+b-c) kJ·mol-1。
(3)碳和水蒸气反应生成一氧化碳和氢气,该反应为C(s)+H2O(g)===CO(g)+H2(g)。根据盖斯定律,由①-②-③可得C(s)+H2O(g)===CO(g)+H2(g),则该反应的ΔH=(-393.5 kJ·mol-1)-(-242 kJ·mol-1)-(-283.0 kJ·mol-1)=+131.5 kJ·mol-1。标准状况下10 m3水煤气中CO(g)和H2(g)总物质的量为≈446.4 mol,则CO(g)和H2(g)总物质的量均约为223.2 mol,故完全燃烧放出的热量约为223.2 mol×(242 kJ·mol-1+283.0 kJ·mol-1)=117 180 kJ≈1.17×105 kJ。