- 2021-07-03 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习第5章物质结构元素周期律第17讲原子结构化学键教学案新人教版
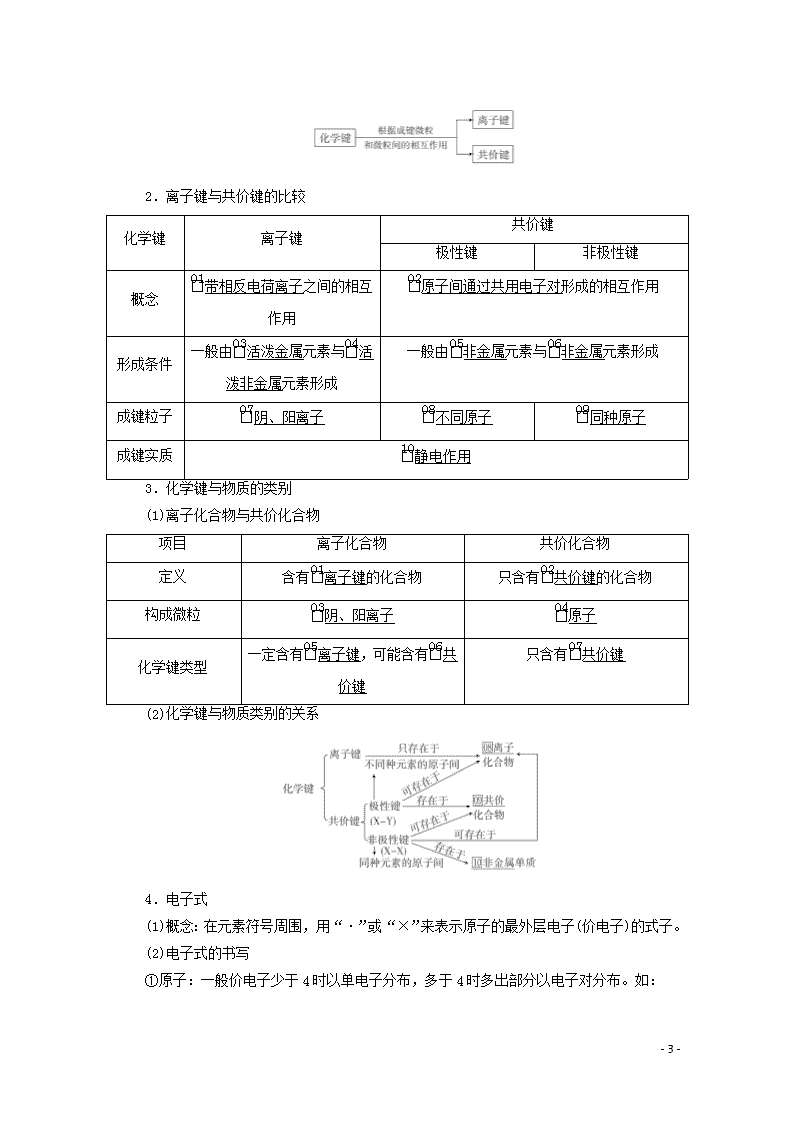
第五章 物质结构 元素周期律 [考纲解读] 1.了解元素、核素和同位素的含义。2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子排布;掌握原子结构示意图。4.掌握元素周期律的实质。了解元素周期表的结构(周期、族)及其应用。5.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。6.以第ⅠA和第ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。7.了解金属、非金属在元素周期表中的位置及其性质递变的规律。8.了解化学键的定义。了解离子键、共价键的形成。9.掌握电子式的表示方法。 第17讲 原子结构 化学键 一、原子的构成 1.原子的构成粒子 2.原子中的4个数量关系 (1)质子数(Z)=核电荷数=核外电子数=原子序数。 (2)质量数(A)=质子数+中子数。 (3)阳离子的核外电子数=质子数-所带电荷数。如Mg2+的核外电子数是10。 (4)阴离子的核外电子数=质子数+所带电荷数。如S2-的核外电子数是18。 3.“三素”——元素、核素、同位素 (1)元素、核素、同位素的概念及相互关系 (2)同位素的特征与应用 ①同位素的特征 - 19 - a.化学性质相同,物理性质不同。 b.天然存在的同一元素各核素所占的原子百分数一般固定。 ②常见的重要核素及其应用 核素 U C H H O 用途 核燃料 用于考古断代 制氢弹 示踪原子 二、原子核外电子排布规律 1.核外电子排布规律 2.原子结构示意图 3.核外电子排布与元素性质的关系 (1)金属元素原子的最外层电子数一般小于4,较易失电子,易形成阳离子,在化合物中显正化合价。 (2)非金属元素原子的最外层电子数一般大于或等于4,较易得电子,活泼非金属原子易形成阴离子。在化合物中主要显负化合价。 (3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,化合价通常显0价。 三、化学键 1.化学键 (1)概念:使离子相结合或原子相结合的作用力。 (2)分类 - 19 - 2.离子键与共价键的比较 化学键 离子键 共价键 极性键 非极性键 概念 带相反电荷离子之间的相互作用 原子间通过共用电子对形成的相互作用 形成条件 一般由活泼金属元素与活泼非金属元素形成 一般由非金属元素与非金属元素形成 成键粒子 阴、阳离子 不同原子 同种原子 成键实质 静电作用 3.化学键与物质的类别 (1)离子化合物与共价化合物 项目 离子化合物 共价化合物 定义 含有离子键的化合物 只含有共价键的化合物 构成微粒 阴、阳离子 原子 化学键类型 一定含有离子键,可能含有共价键 只含有共价键 (2)化学键与物质类别的关系 4.电子式 (1)概念:在元素符号周围,用“·”或“×”来表示原子的最外层电子(价电子)的式子。 (2)电子式的书写 ①原子:一般价电子少于4时以单电子分布,多于4时多出部分以电子对分布。如: - 19 - NaNa MgMg Al S Cl ②简单阳离子:其离子符号即电子式。如:Na+、Mg2+、Al3+。 ③简单阴离子:写出元素符号,然后在其上、下、左、右标出最外层(包括得到的)电子数,并加“[ ]”围起来,然后在其右上角标出电荷。如: S2- Cl- ④原子团:按原子间连接顺序将各原子的元素符号写出,然后将它们的最外层电子(包括得到和失去的一并分析)的共用和单独占有(孤电子对)情况在各元素符号周围标出,并加“[ ]”围起来,最后在其右上角标出电荷,注意相同原子不合并。如: ⑤单质及共价化合物 按原子间连接顺序将各原子的元素符号写出,然后将它们的最外层电子(包括得到和失去的一并分析)的共用和单独占有(孤电子对)情况在各元素符合周围标出,注意相同原子不合并,无“[ ]”,不标电荷。如: ⑥离子化合物:将化学式中离子的电子式按连接顺序写在一起,注意同性不相邻,相同不合并,离子合理分布。如: NaOH Na2O2 (3)用电子式表示化合物的形成过程 ①离子化合物:左边是原子的电子式,右边是离子化合物的电子式,中间用“― - 19 - →”连接,用弯箭头表示出电子的转移方向,相同的原子或离子不合并。 如NaCl: MgCl2: ②共价化合物:左边是原子的电子式,右边是共价化合物的电子式,中间用“―→”连接。 如HCl:。 四、范德华力、氢键 1.分子间作用力 (1)定义:把分子聚集在一起的作用力,又称范德华力。 (2)特点 分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。 (3)变化规律 一般来说,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。 2.氢键 (1)定义:分子间存在的一种比分子间作用力稍强的相互作用。 (2)存在 氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点升高。 1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)通过化学变化可以实现16O与18O间的相互转化。(×) 错因:同位素之间的转化不是化学变化,是核反应。 (2)所有物质中都存在化学键。(×) 错因:稀有气体中不存在化学键。 (3)原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键。(×) - 19 - 错因:H与卤素原子结合时形成共价键。 (4)非金属元素原子之间一定形成共价键,不可能形成离子键。(×) 错因:NH4Cl中NH与Cl-之间为离子键。 (5)最外层电子数为8的粒子一定是稀有气体元素原子。(×) 错因:Na+等最外层电子数为8,其不是稀有气体。 (6)CaCl2的电子式:。(×) 错因:CaCl2的电子式为。 (7)次氯酸(HClO)的电子式:。(×) 错因:HClO的电子式为。 2.教材改编题 (据人教必修二P11T4)放射性同位素铀U的原子核内的中子数与核外电子数之差为( ) A.143 B.92 C.51 D.32 答案 C 解析 U的原子核内的中子数与核外电子数之差为:235-92-92=51。 3.教材改编题 (据人教必修二P25T9)有以下9种物质:①Ne ②NH4Cl ③KNO3 ④NaOH ⑤Cl2 ⑥SO2 ⑦H2S ⑧Na2O2 ⑨MgCl2 (1)既存在离子键又存在共价键的是________。 (2)不存在化学键的是________。 (3)属于共价化合物的是________。 (4)属于离子化合物的是________。 答案 (1)②③④⑧ (2)① (3)⑥⑦ (4)②③④⑧⑨ 考点一 原子结构 核素 - 19 - [解析] 40K的质子数是19,中子数是21,40Ca的质子数是20,中子数是20,A错误;原子最外层只有一个电子的元素不一定是金属元素,如氢元素是非金属元素,B错误;原子是由原子核和核外电子构成的,原子核由质子和中子构成,原子变成离子,变化的是核外电子,但核内质子不变,所以任何原子或离子的组成中都含有质子,C正确;互为同位素的不同核素间核外电子数相同,电子层排布相同,所以化学性质相同,但物理性质不同,D错误。 [答案] C 1.正确理解微粒的组成和结构 (1)有质子的原子不一定有中子,有质子的微粒不一定有电子。如H只有一个质子和一个电子,不含中子;H+只有一个质子,既没有中子也没有电子。 (2)质子数相同的粒子不一定属于同种元素,如Ne和H2O。 (3)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中。 (4)核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH与OH-等。 (5)一个信息丰富的符号 2.正确理解元素、核素、同位素的概念 (1)元素、核素、同位素之间的关系 (2)不同核素可能具有相同的质子数,如H、H;也可能具有相同的中子数,如C、O;也可能具有相同的质量数,如C、N。 (3)核素之间的转化,既不是物理变化也不是化学变化,是核反应。 - 19 - (4)同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同“单质”间的关系。 3.两种相对原子质量 (1)原子(即核素)的相对原子质量 一个原子(即核素)的质量与12C质量的的比值。一种元素有几种核素,就有几种不同核素的相对原子质量。 (2)元素的相对原子质量 是按该元素各种核素的相对原子质量和所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。 1.下列说法不正确的是( ) ①质子数相同的粒子一定是同一元素 ②质子数相同且电子数也相同的两种粒子不可能一种是分子,另一种是离子 ③电子数相同的粒子不一定是同种元素 ④一种元素不能形成不同单质 ⑤某元素的相对原子质量取整数值就是质量数 A.②④⑤ B.①④⑤ C.②③④ D.②③ 答案 B 解析 注意微观粒子包括原子、分子、离子等,H2O、NH3、Ne等微粒的质子数相同,不是同一种元素,所以①不正确,分析选项,选B(巧答)。 2.氢包括两种稳定核素:H和D,氧常见的核素有16O、17O和18O,下列有关说法正确的是( ) A.H2和D2互为同分异构体,其化学性质完全相同 B.HO、HO、HO互为同位素,都能与金属钠发生反应 C.18O2和18O3互为同素异形体,其密度之比为2∶3 D.电解一定量的DO时,阴、阳两极所得气体的质量之比约为2∶9 答案 D 解析 同分异构体的分子式相同,结构不同,H2和D2结构相同,A错误;16O、17O、18O互为同位素,HO、HO、HO既不互为同位素,也不是同素异形体,B错误;18O2和18O3互为同素异形体,但只有在同温同压下,它们的密度之比才为2∶3,C错误;电解一定量的DO时,阴、阳两极会收集到物质的量之比为2∶1的D2和18O2,其质量之比约为2∶9,D正确。 考点二 核外电子排布规律及应用 - 19 - [解析] X、Y、Z是短周期主族元素,原子序数X查看更多