- 2021-07-03 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届一轮复习鲁科版铝及其重要化合物作业
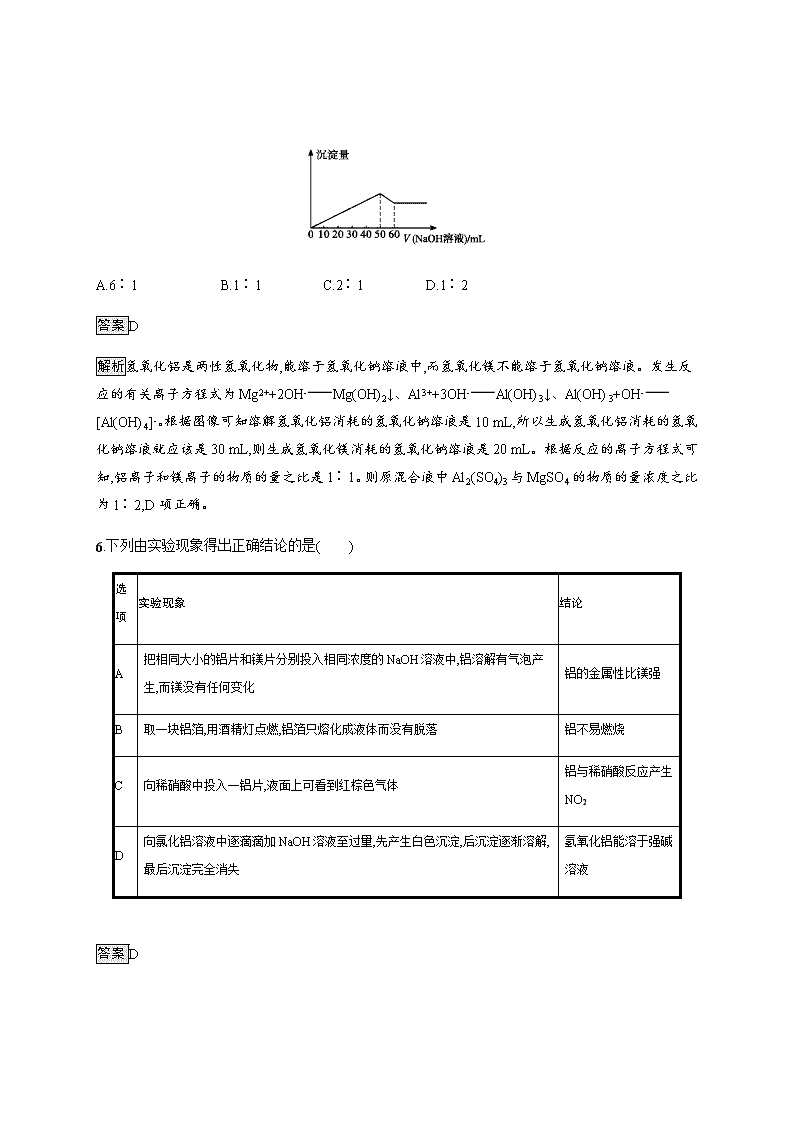
铝及其重要化合物 基础巩固 1.(2020江西上饶月考)下列说法中正确的是( ) A.Al2O3、MgO可用作耐高温材料,二氧化硅是生产光纤制品的基本原料 B.铝、铁、铜相比较,在自然界中铜元素的含量最低、铁元素含量最高 C.工业上采用电解熔融态Al2O3、MgO的方法冶炼Al、Mg D.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵的反应都会产生温室气体 答案A 解析氧化铝和氧化镁的熔点都很高,所以可以作耐高温材料,光纤制品的基本原料是二氧化硅,故A正确;自然界中元素的含量高低依次是O、Si、Al、Fe等,所以铝、铁、铜相比较,自然界中含量最低的是Cu,最高的是Al而不是Fe,故B错误;MgO的熔点很高,电解熔融态MgO冶炼Mg会增大生产成本,工业上是电解熔融的氯化镁来冶炼镁,故C错误;用纯碱制玻璃、用铁矿石炼铁都会产生二氧化碳,用氨制碳酸铵,制备原理为:2NH3+CO2+H2O(NH4)2CO3,不产生二氧化碳,故D错误。 2.(2020四川广安月考)在加热固体NH4Al(SO4)2·12H2O时,固体质量随温度的变化曲线如图所示。已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4)3,下列判断正确的是( ) A.0~T ℃的过程变化是物理变化 B.C点物质是工业上冶炼铝的原料 C.A~B反应中生成物只有Al2(SO4)3和NH3两种 D.Al2(SO4)3能够净水,可用离子方程式表示为Al3++3OH-Al(OH)3 答案B 解析因为A点物质为NH4Al(SO4)2,则0~T ℃的过程变化是失去结晶水生成NH4Al(SO4)2,是化学变化,A错误;B点物质为硫酸铝,升温时又会分解,则在C点生成氧化铝,所以C点物质是工业上冶炼铝的原料,B正确;A~B发生的反应为硫酸铝铵分解生成硫酸铝、氨气和硫酸,所以除生成的硫酸铝和氨气两种物质外,还有硫酸,故C错误;硫酸铝能够净水,其原理是铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,可以吸附水中悬浮的杂质,故D错误。 3.下列叙述正确的是( ) A.向氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3·3H2OAl(OH)3↓+3NH4+ B.存在于污水中的重金属离子,常用加入明矾等电解质的方法进行处理 C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 D.依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O3 答案A 解析B项中明矾只能使污水中的悬浮物沉降,不能除去重金属离子;C项中Mg不能溶于NaOH溶液;D项中Mg的金属性比Al强,故Al与MgO不能发生铝热反应。 4.(2019河南新乡调研测试)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ) A.3 mol·L-1HCl溶液 B.4 mol·L-1HNO3溶液 C.8 mol·L-1NaOH溶液 D.18 mol·L-1H2SO4溶液 答案A 解析在镁、铝混合物中加入HNO3和浓硫酸都不产生H2;加入NaOH溶液,只有Al与NaOH溶液反应生成H2,而镁不反应;加入盐酸,镁、铝都与盐酸反应生成H2,所以加入盐酸时放出H2的量最多。 5.(2019山西范亭中学第二次月考)在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( ) A.6∶1 B.1∶1 C.2∶1 D.1∶2 答案D 解析氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,而氢氧化镁不能溶于氢氧化钠溶液。发生反应的有关离子方程式为Mg2++2OH-Mg(OH)2↓、Al3++3OH-Al(OH)3↓、Al(OH)3+OH-[Al(OH)4]-。根据图像可知溶解氢氧化铝消耗的氢氧化钠溶液是10 mL,所以生成氢氧化铝消耗的氢氧化钠溶液就应该是30 mL,则生成氢氧化镁消耗的氢氧化钠溶液是20 mL。根据反应的离子方程式可知,铝离子和镁离子的物质的量之比是1∶1。则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为1∶2,D项正确。 6.下列由实验现象得出正确结论的是( ) 选项 实验现象 结论 A 把相同大小的铝片和镁片分别投入相同浓度的NaOH溶液中,铝溶解有气泡产生,而镁没有任何变化 铝的金属性比镁强 B 取一块铝箔,用酒精灯点燃,铝箔只熔化成液体而没有脱落 铝不易燃烧 C 向稀硝酸中投入一铝片,液面上可看到红棕色气体 铝与稀硝酸反应产生NO2 D 向氯化铝溶液中逐滴滴加NaOH溶液至过量,先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 氢氧化铝能溶于强碱溶液 答案D 解析金属性的强弱可根据金属与酸反应时金属失电子的能力强弱判断,而不是与碱反应,故A项错误;没有脱落表明氧化铝的熔点高,故B项错误;稀硝酸与铝反应时生成NO,NO与空气中的O2反应生成NO2,故C项错误;氯化铝和氢氧化钠溶液反应先生成氢氧化铝白色沉淀,氢氧化铝再和氢氧化钠溶液反应生成可溶性的偏铝酸钠,故D项正确。 7.铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。 (1)在滤液A中加入漂白液,所得滤液B显酸性。 ①滤液A中加入漂白液的目的是 (用离子方程式表示)。 ②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号) 。 A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳 离子方程式为 。 (2)由滤液B制备少量无水AlCl3(AlCl3极易水解)涉及的操作为 、冷却结晶、 (填操作名称)、洗涤。 (3)若将铝土矿溶于足量的氢氧化钠溶液,则对应的离子方程式为 。 答案(1)①2Fe2++ClO-+5H2O2Fe(OH)3↓+Cl-+4H+ ②C Al3++3NH3·H2OAl(OH)3↓+3NH4+ (2)边滴加浓盐酸边蒸发浓缩 过滤 (3)SiO2+2OH-SiO32-+H2O,Al2O3+2OH-+3H2O2[Al(OH)4]- 解析(1)①滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,次氯酸根离子具有氧化性氧化亚铁离子生成铁离子在溶液中形成氢氧化铁沉淀除去,次氯酸根离子被还原为氯离子,反应的离子方程式为2Fe2++ClO-+5H2O2Fe(OH)3↓+Cl-+4H+。②氢氧化钠溶液可以沉淀铝离子但过量又会溶解氢氧化铝,故A项不是最好;硫酸溶液不能沉淀铝离子,故B项不符合;氨水是弱碱溶液不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,反应的离子方程式为 Al3++3NH3·H2OAl(OH)3↓+3NH4+,故C项符合;二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故D项不符合。 (2)由滤液B制备少量无水AlCl3,由于AlCl3极易水解,需要边滴加浓盐酸边蒸发浓缩、冷却结晶、过滤、洗涤。 (3)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,离子反应分别为Al2O3+2OH-+3H2O2[Al(OH)4]-、SiO2+2OH-SiO32-+H2O。 能力提升 8.(2020浙江温州调研)把一块镁铝合金投入20 mL 1 mol·L-1的盐酸中,待合金完全溶解后,向溶液中加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积(mL)变化的关系如图所示。下列说法中正确的是( ) A.镁铝合金具有很强的抗腐蚀能力,它不能溶解在任何酸、碱或盐中 B.c值越大,合金中Al的含量越高 C.b值越大,合金中Mg的含量越高 D.假设c=25,整个实验过程中,只发生了4个离子反应 答案B 解析镁铝合金表面因形成致密的氧化膜而具有很强的抗腐蚀能力,但MgO、Al2O3、Mg、Al都可与盐酸、硫酸等反应,Al、Al2O3也能溶解在NaOH溶液中,A项错误;b点对应的沉淀为Al(OH)3和Mg(OH)2的混合物,溶液中溶质只有氯化钠,故b为固定值20,因而无法根据b值判断合金中Mg的含量,C项错误;根据图示,c值越大,溶解Al(OH)3消耗的NaOH越多,说明合金中Al的含量越高,B项正确;根据图示,当c=25时,整个反应过程中包含Mg、Al分别与盐酸的反应,H+与OH-的反应,Mg2+、Al3+分别与OH-的反应,Al(OH)3与OH-的反应,有6个离子反应,D项错误。 9.(2020河北沧州调研)某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质并尽可能减少AlCl3的损失。 下列说法正确的是( ) A.NaOH溶液可以用氨水来代替 B.溶液a中含有Al3+、K+、Cl-、Na+、OH- C.溶液b中只含有NaCl D.向溶液a中滴加盐酸需控制溶液的pH 答案D 解析A项,氨水不能使Al3+转化为[Al(OH)4]-,不能使含铝化合物与Mg(OH)2分离,则不能用氨水代替NaOH溶液;B项,溶液a中不含Al3+;C项,溶液b也含有KCl。 10.氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应,前后两种情况下生成的气体的质量比是( ) A.1∶1 B.2∶3 C.3∶2 D.28∶9 答案A 解析把FeO和铝粉配成铝热剂,分成两等份,一份在高温下恰好完全反应生成铁与氧化铝,由电子转移守恒可知,2n(Fe)=3n(Al),然后将生成物与足量的稀盐酸反应,铁与盐酸反应生成氯化亚铁与氢气,由电子转移守恒可知n(H2)=n(Fe),所以n(H2)=32n(Al);另一份直接加入足量的NaOH溶液使之充分反应,铝与氢氧化钠反应生成偏铝酸钠与氢气,由电子转移守恒可知2n(H2)=3n(Al),所以n(H2)=32n(Al)。故两种情况下生成气体的物质的量之比为1∶1,质量比等于物质的量之比也是1∶1。 11.(2019广东汕头质检)a g镁铝合金投入x mL 2 mol·L-1的盐酸中,金属完全溶解,再加入y mL 1 mol·L-1 NaOH溶液,沉淀达到最大值,质量为(a+1.7) g,则下列说法不正确的是( ) A.镁铝合金与盐酸反应转移电子数为0.1NA B.沉淀为Mg(OH)2和Al(OH)3的混合物 C.x=2y D.a的取值范围为0.9查看更多
相关文章
- 当前文档收益归属上传用户