- 2021-07-03 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省实验中学2019-2020学年高一下学期期中考试化学试题 Word版含解析
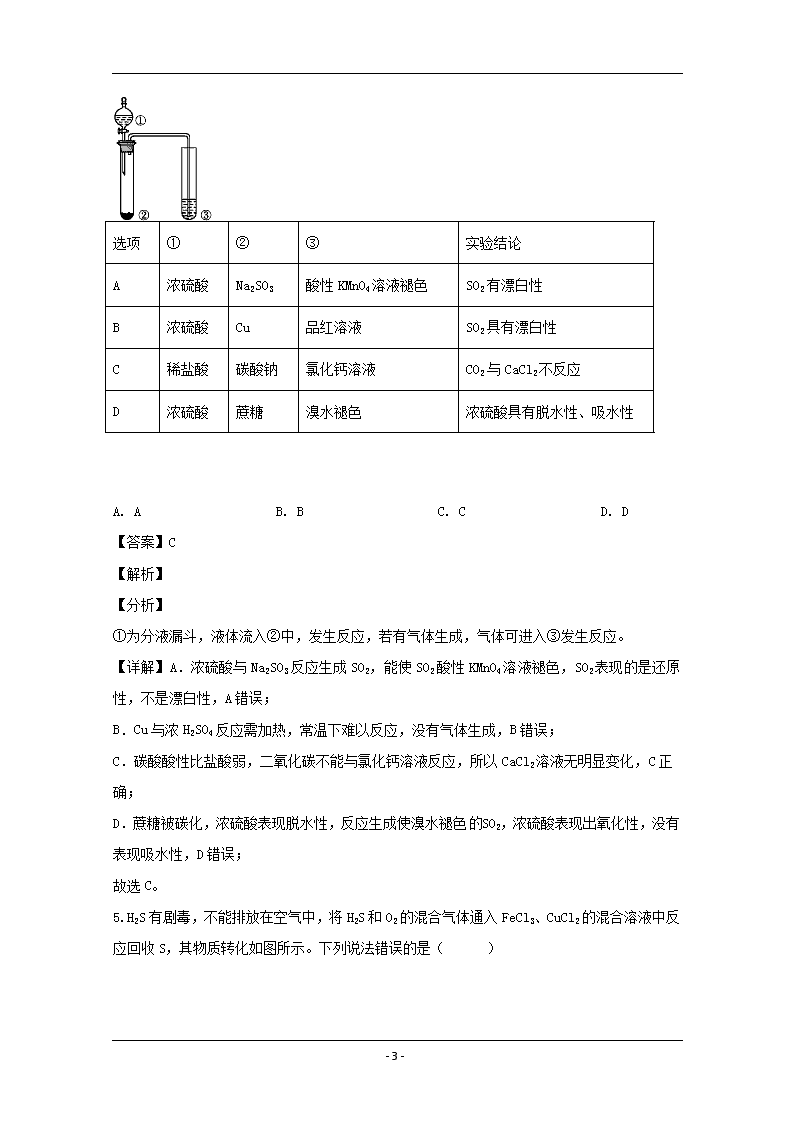
www.ks5u.com 辽宁省实验中学2019—2020学年度下学期期中阶段测试 高一化学试卷 第Ⅰ卷(选择题,共50分) 可能用到的相对原子质量:H-1 C-12 O-16 Li-7 Na-23 Al-27 一、选择题(每题有1个选项符合题设要求,1-10每小题2分,11-20每小题3分) 1.《厉害了,我的国》展示了中国探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是( ) A. 为打造生态文明建设,我国大力发展核电、光电、风电、水电,电能属于一次能源 B. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐 C. 我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D. C919大型客机使用了大量先进复合材料、铝锂合金等,铝锂合金可减轻机身自重 【答案】D 【解析】 【详解】A.一次能源是从自然界取得未经改变或转变而直接利用的能源,如原煤、天然气、风能、太阳能等;二次能源是指由一次能源经过加工转换以后得到的能源,如电能、氢能等,A错误; B.高温结构陶瓷耐高温、耐腐蚀,是新型无机非金属材料,不是传统的硅酸盐,B错误: C.光缆的主要成分是二氧化硅, C错误; D.铝和锂均为金属材料,故铝锂合金也为金属材料,D正确; 故选D。 2.下列说法正确的是( ) A. 医用酒精的浓度越高杀菌消毒效果越好 B. pH小于7降水通常称为酸雨 C. 燃煤中加入适量石灰石,可减少废气中的SO2 D. SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ 【答案】C 【解析】 【详解】A.医用酒精主要用于消毒,当酒精浓度为75%时消毒效果最好,A错误; - 23 - B.pH小于5.6的降水通常称为酸雨,B错误; C.高温下石灰石分解生成CaO,可与SO2以及氧气反应生成硫酸钙:SO2+CaO=CaSO3;2CaSO3+O2=2CaSO4,减少废气中SO2的量,C正确; D.SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色:SO2+ 2H2O +2Fe3+ = SO42- + 2Fe2+ + 4H+,说明Fe3+的氧化性强于稀硫酸,但在硝酸存在的作用下立即又变成棕黄色:3Fe+8H++2NO3—=3Fe3++2NO↑+4H2O,说明Fe2+迅速被氧化成Fe3+,故HNO3的氧化性强Fe3+,综上所述氧化性:HNO3>Fe3+>稀硫酸,D错误; 故选C。 3.一定温度下,探究铜与稀HNO3的反应过程如图,下列说法不正确的是( ) A. 过程Ⅰ中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O B. 步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大 C. 由实验可知,NO2可能对该反应具有催化作用 D. 当活塞不再移动时,再抽入空气,铜可以继续溶解 【答案】B 【解析】 【详解】A.过程I的反应是Cu和稀HNO3的反应,离子方程式为: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O, A正确; B.根据氮元素守恒,有一部分HNO3已转化为NO,故步骤I中c(HNO3)不会增大,B错误; C.加入NO2后,反应速率加快,说明NO2可能对该反应具有催化作用,C正确; D.再抽入空气,NO和O2反应生成NO2,NO2和水反应生成HNO3,铜可以与HNO3继续反应而溶解,D正确; 故选B。 4.利用如图所示装置进行下列实验,能得到相应实验结论的是( ) - 23 - 选项 ① ② ③ 实验结论 A 浓硫酸 Na2SO3 酸性KMnO4溶液褪色 SO2有漂白性 B 浓硫酸 Cu 品红溶液 SO2具有漂白性 C 稀盐酸 碳酸钠 氯化钙溶液 CO2与CaCl2不反应 D 浓硫酸 蔗糖 溴水褪色 浓硫酸具有脱水性、吸水性 A. A B. B C. C D. D 【答案】C 【解析】 【分析】 ①为分液漏斗,液体流入②中,发生反应,若有气体生成,气体可进入③发生反应。 【详解】A.浓硫酸与Na2SO3反应生成SO2,能使SO2酸性KMnO4溶液褪色,SO2表现的是还原性,不是漂白性,A错误; B.Cu与浓H2SO4反应需加热,常温下难以反应,没有气体生成,B错误; C.碳酸酸性比盐酸弱,二氧化碳不能与氯化钙溶液反应,所以CaCl2溶液无明显变化,C正确; D.蔗糖被碳化,浓硫酸表现脱水性,反应生成使溴水褪色SO2,浓硫酸表现出氧化性,没有表现吸水性,D错误; 故选C。 5.H2S有剧毒,不能排放在空气中,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( ) - 23 - A. 腐败的鱼、肉、蛋中都有硫化氢气体产生 B. O2在转化过程中发生的反应为O2+4Fe2++4H+=4Fe3++2H2O C. 图示转化中,有三种元素的化合价未发生改变 D. 为避免混合液失效,混合气体中H2S和O2的比例应大于2:1 【答案】D 【解析】 【详解】A.H2S是一种有臭鸡蛋气味的气体,鱼、肉、蛋都是有机物组成的,含有S元素,腐败时在微生物的作用下产生H2S,A正确; B.由图可以看出,Fe2+在O2的作用下变成Fe3+,发生反应为:O2+4Fe2++4H+=4Fe3++2H2O,B正确; C.图示转化中,Cu、H、Cl的化合价没有变化,C正确; D.由图可知,总反应为:2H2S+O2=2S+H2O,Fe3+是混合液的成分之一,为避免混合液失效,混合气体中O2的含量要大一些,以保证Fe3+不会损失,故H2S和O2的比例应小于2:1,D错误; 故选D。 6.将1gH2和4gO2混合点燃,充分反应,放出71.45kJ热量,同样条件下2molH2在O2中完全燃烧放出的热量是( ) A. 71.45kJ B. 142.9kJ C. 571.6kJ D. 285.8KJ 【答案】C 【解析】 【详解】1g H2 的物质的量为= 0.5mol , 4g O2的物质的量为= 0.125mol, 反应2H2+O 2= 2H2O,由方程式可以知道,0.125mol氧气完全反应需要消耗氢气为0.125mol×2 = 0.25mol ,小于0.5mol ,故氢气过量,所以放出71.45kJ热量时参加反应的氢气的物质的量为0.25mol ,同样条件下2mol H2 在O2中完全燃烧放出的热量是: 71.45kJ×8= - 23 - 571.6kJ。 故选C。 【点睛】本题一定要注意1gH2和4gO2反应时谁过量,谁完全反应。反应热一定要按照完全反应的物质计算。 7.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是 A. 加催化剂同时升高温度 B. 加催化剂同时增大压强 C. 升高温度同时充入N2 D. 降低温度同时增大压强 【答案】B 【解析】 【分析】 提高该反应的NO的转化率只需让平衡正向移动,据此分析判断。 【详解】A.加催化剂能使反应速率加快,但平衡不移动,由于该反应为放热反应,升高温度,虽反应速率加快,但反应逆向进行,因此NO的转化率减小,A项错误; B.加催化剂能使反应速率加快,但平衡不移动,由于该反应为气体体积缩小的反应,增大压强,反应速率加快,且平衡正向移动,因此加催化剂同时增大压强能提高该反应的速率和NO的转化率,B项正确; C.由于该反应为放热反应,升高温度,虽反应速率加快,但反应逆向进行, NO的转化率减小,充入N2,增大了生成物的浓度,反应速率加快但平衡逆向移动,NO的转化率减小,C项错误; D.由于该反应为放热反应,降低温度,反应速率减慢,反应正向进行,NO的转化率增大,由于该反应为气体体积缩小的反应,增大压强,反应速率加快,且平衡正向移动,NO的转化率增大,D项错误; 答案选B。 8.对于反应4NH3+5O24NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( ) A. v(NH3)=0.2mol/(L·s) B. v(O2)=10mol/(L·min) C. v(H2O)=0.25mol/(L·s) D. v(NO)=8mol/(L·min) 【答案】A - 23 - 【解析】 【分析】 由于化学反应速率之比等于化学计量数之比,所以在用不同物质比较化学反应速率的时候,一定要统一单位,并转化为同一种物质进行比较。本题比较时我们选取的单位为mol/(L·min),选取的物质为NH3。 【详解】A.v(NH3)=0.2mol/(L·s)=12 mol/(L·min); B.由v(O2)=10mol/(L·min)且v(NH3):v(O2)=4:5得,v(NH3)= 8mol/(L·min); C.v(H2O)=0.25mol/(L·s)=15 mol/(L·min),由v(NH3):v(H2O)=2:3得,v(NH3)= 10mol/(L·min); D.由v(NO)=8mol/(L·min)且v(NH3):v(NO)=1:1得,v(NH3)= 8mol/(L·min); 综上所述,反应进行最快的是A, 故选A。 【点睛】比较反应速率,切不可只看数值,一定要结合物质和单位去看,才能比较出正确的结果。 9.对于可逆反应:2A(g)+B(g)3C(g) △H<0下列正确的是( ) A. B. C. D. 【答案】A 【解析】 【详解】A.500℃时,反应速率快,先达到平衡,所以500℃的曲线先拐;该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,图像符合变化趋势,A正确; B.温度升高,化学反应速率增大,B错误; C.反应2A(g)+B(g)3C(g)中,三种物质都是气体,因此都受压强变化的影响,压强越大,反应速率越大,C错误; - 23 - D.该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低;根据反应前后的化学计量数的大小可以看出,增大压强不影响平衡的移动,本选项曲线不符合变化规律,D错误; 故选A。 【点睛】本题易错选项为B,温度升高,正逆反应速率都会增大。本选项考查的是外界因素对反应速率的影响,而不是考查温度对平衡移动的影响,千万不要混淆。 10.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700 -900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是 A. 电极甲发生还原反应 B. 电池内的O2-由电极乙移向电极甲 C. 电池总反应为N2H4 +2O2= 2NO +2H2O D. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4L O2参与反应 【答案】B 【解析】 【分析】 根据原电池的工作原理进行分析,负极上发生氧化反应,正极上发生还原反应,阴离子向负极移动,阳离子向正极移动,然后进行分析。 【详解】A、通氧气一极为正极,通N2H4的一极为负极,即电极甲为负极,依据原电池的工作原理,电极甲上发生氧化反应,故A错误;B、根据原电池的工作原理,O2-从正极移向负极,故B正确;C、因为反应生成无毒无害物质,即N2H4转化成N2和H2O,故C错误;D、题目中没有说明条件是否为标准状况下,因此无法计算气体的体积,故D错误。 【点睛】本题的易错点是选项D,学生容易根据得失电子数目守恒计算出氧气的物质的量,即1×2×2=n(O2)×4,解得n(O2 - 23 - )=1mol,然后判断出体积为22.4L,忽略了题目中并没有说明条件是否是标准状况,因此遇到这样的问题,需要先判断条件。 11.现取铝镁合金,使其在一定浓度的稀硝酸中恰好完全溶解假定硝酸的还原产物只有,向反应后的混合溶液中滴加溶液,当滴加时,得到沉淀的质量恰好为最大值,则下列有关说法不正确的是 A. 沉淀中氢氧根离子的质量为 B. 恰好溶解后溶液中的的物质的量为 C. 生成标准状况下NO气体的体积为 D. 与合金反应的硝酸的物质的量为 【答案】C 【解析】 【详解】A.沉淀为氢氧化铝和氢氧化镁,沉淀质量等于原铝镁合金质量与沉淀中氢氧根离子质量之和,所以沉淀中氢氧根离子的质量为,故A正确; B.恰好溶解后溶液中的的物质的量等于沉淀质量最大时溶液中的物质的量,当沉淀质量最大时,溶液中的溶质只有硝酸钠,溶液中硝酸根离子与钠离子的物质的量相等,,故B正确; C.根据以上分析可知,沉淀中氢氧根离子的物质的量等于、所带电荷的物质的量,也等于合金失去电子的物质的量,即等于反应过程中转移电子的物质的量,,根据得失电子守恒,生成NO时,中价的N元素转变为价,因此生成NO的物质的量为,所以生成标准状况下NO气体的体积为,故C错误; D.与合金反应的硝酸分别起酸的作用和氧化剂的作用,作为酸的硝酸生成硝酸盐的物质的量等于反应后硝酸钠的物质的量,为 - 23 - ,作为氧化剂的硝酸的物质的量等于生成的NO的物质的量,为,所以与合金反应的硝酸的物质的量为,故D正确; 答案选C。 12.向含amolNaClO的溶液通入bmolSO2充分反应(不考虑二氧化硫与水之间的反应以及次氯酸的分解)。下列说法不正确的是( ) A. 当0查看更多
相关文章
- 当前文档收益归属上传用户