- 2021-07-02 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版江苏新高考选考化学(苏教版)一轮复习同步练习:专题4 4 小专题突破3 无机框图推断题的解题策略
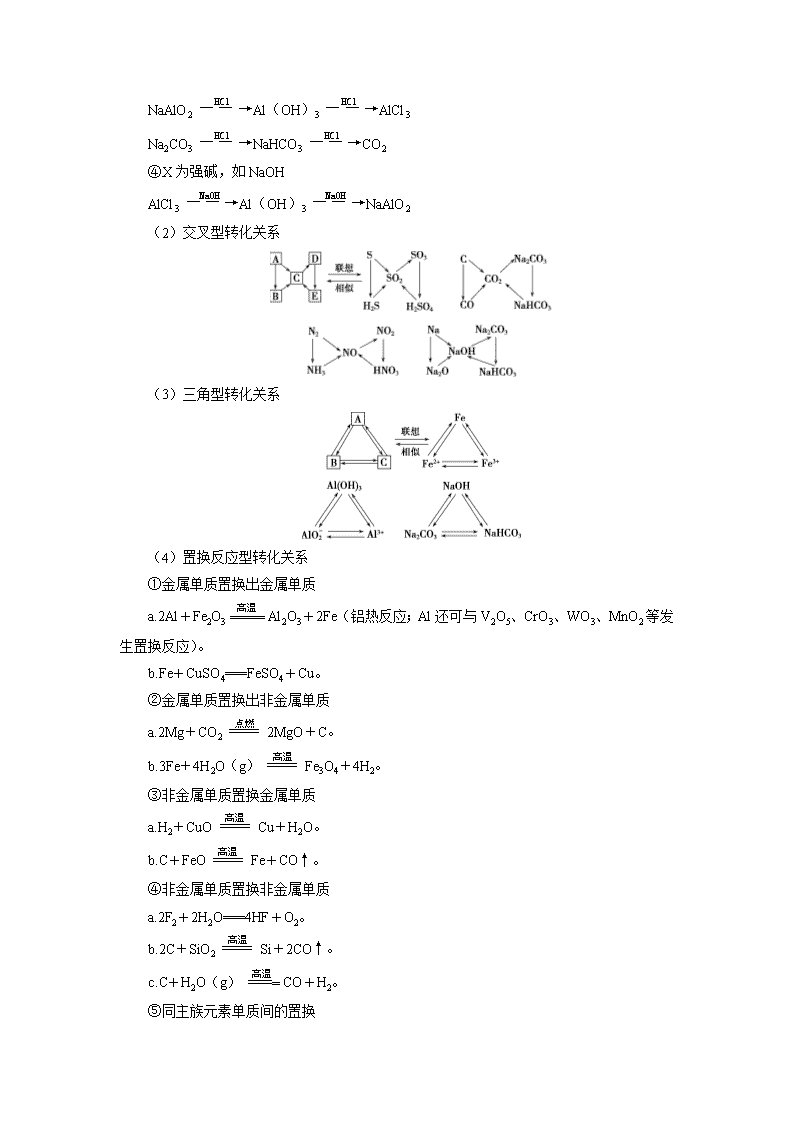
小专题突破3 无机框图推断题的解题策略 [专题精讲] 无机推断题集元素及其化合物知识、基本概念和基本理论等知识为一体,具有考查知识面广、综合性强、思考容量大的特点。这种题型不但综合考查学生在中学阶段所学的元素及其化合物、物质结构、元素周期律、电解质溶液、化学平衡、氧化还原反应、化学用语等知识,而且更重要的是它能突出考查学生的综合分析判断能力、逻辑推理能力,且结构紧凑、文字表述少,包含信息多,思维能力要求高。 推断题的解题方法及推理过程表示如下: 解题“突破口” 1.物质的特殊颜色 (1)有色固体 ①红色:Cu、Cu2O、Fe2O3; ②红褐色:Fe(OH)3; ③黄色:AgI、Ag3PO4; ④淡黄色:S、Na2O2、AgBr; ⑤蓝色:Cu(OH)2、CuSO4·5H2O; ⑥黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS; ⑦紫黑色:KMnO4、I2。 (2)有色溶液 Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO(紫红色)、Fe3+与苯酚(紫色)、Fe3+与SCN-(红色)、I2与淀粉(蓝色)等。 水(溶剂) 苯(溶剂) CCl4(溶剂) Br2 黄→橙 黄→红棕 I2 深黄→褐 淡紫→紫红 紫→深紫 (3)有色气体 Cl2(黄绿色)、Br2(g)(红棕色)、NO2(红棕色)、I2(g)(紫色)、O3(淡蓝色)等。 (4)火焰颜色 ①焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)、Ca2+(砖红色)等; ②淡蓝色:S、H2、H2S、CH4等在空气中燃烧; ③苍白色:H2在Cl2中燃烧。 2.物质的特征性质 (1)能使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。 (2)沉淀特殊的颜色变化 ①白色沉淀先变成灰绿色,再变成红褐色: Fe(OH)2Fe(OH)3; ②白色沉淀迅速变为棕褐色:AgOH→Ag2O。 (3)在空气中变为红棕色:NO(无色)NO2(红棕色)。 (4)能使澄清石灰水变浑浊的气体:CO2、SO2。 (5)通入CO2气体变浑浊的溶液:澄清石灰水(CO2过量则又变澄清)、Na2SiO3溶液、饱和Na2CO3溶液、浓苯酚钠溶液、NaAlO2溶液等。 (6)使湿润的红色石蕊试纸变蓝的气体:NH3。 (7)使湿润的淀粉KI试纸变蓝:NO2、Cl2、Br2、FeCl3等。 (8)能与SO2、Cl2、O2等氧化性较强的气体(或其水溶液)反应析出淡黄色沉淀:H2S。 (9)在一定条件下具有漂白性的物质:Na2O2、H2O2、SO2、氯水、O3、活性炭等。 (10)常温下能溶解SiO2固体的物质:氢氟酸和NaOH溶液。 (11)能与浓硫酸、铜片共热产生红棕色气体(NO2)的溶液:硝酸盐(或硝酸)溶液。 (12)滴入沸水中可得到红褐色胶体的溶液:含Fe3+的盐溶液。 (13)烟雾现象 ①棕(黄)色的烟:Cu或Fe在Cl2中燃烧; ②白烟:Na在Cl2中或P在空气中燃烧;NH3遇到HCl气体; ③白雾:由HX等极易溶于水的气体产生。 3.物质之间的特征转化关系 (1)直线型转化关系 ABC ①X为O2 Na―→Na2O―→Na2O2 N2―→NO―→NO2或NH3―→NO―→NO2 S―→SO2―→SO3或H2S―→SO2―→SO3 C―→CO―→CO2或CH4―→CO―→CO2 醇―→醛―→羧酸 ②X为CO2 NaOHNa2CO3NaHCO3 ③X为强酸,如HCl NaAlO2Al(OH)3AlCl3 Na2CO3NaHCO3CO2 ④X为强碱,如NaOH AlCl3Al(OH)3NaAlO2 (2)交叉型转化关系 (3)三角型转化关系 (4)置换反应型转化关系 ①金属单质置换出金属单质 a.2Al+Fe2O3Al2O3+2Fe(铝热反应;Al还可与V2O5、CrO3、WO3、MnO2等发生置换反应)。 b.Fe+CuSO4===FeSO4+Cu。 ②金属单质置换出非金属单质 a.2Mg+CO22MgO+C。 b.3Fe+4H2O(g)Fe3O4+4H2。 ③非金属单质置换金属单质 a.H2+CuOCu+H2O。 b.C+FeOFe+CO↑。 ④非金属单质置换非金属单质 a.2F2+2H2O===4HF+O2。 b.2C+SiO2Si+2CO↑。 c.C+H2O(g)CO+H2。 ⑤同主族元素单质间的置换 a.2Na+2H2O===2NaOH+H2↑。 b.2C+SiO2Si+2CO↑。 c.2H2S+O22S↓+2H2O。 d.Cl2+2HI===2HCl+I2。 ⑥不同主族元素单质间的置换 a.H2S+Cl2===S↓+2HCl。 b.3Cl2+8NH3===6NH4Cl+N2。 4.特殊反应条件 (1)高温、高压和催化剂条件 N2+3H22NH3。 (2)加热、催化剂条件 ①4NH3+5O24NO+6H2O。 ②2SO2+O22SO3。 (3)通电条件 ①2NaCl+2H2O2NaOH+H2↑+Cl2↑。 ②2H2O2H2↑+O2↑。 5.不能一步实现的反应归纳 (1)H2S(或S)不能一步转化为SO3。 (2)N2(或NH3)不能一步转化为NO2。 (3)SiO2不能与水反应生成H2SiO3。 (4)Fe2O3、Al2O3、CuO等不溶性金属氧化物都不能一步生成相应的氢氧化物。 [专题精练] 1.(2018·高考江苏卷)在给定条件下,下列选项所示的物质间转化均能实现的是( ) A.NaHCO3(s)Na2CO3(s)NaOH(aq) B.Al(s)NaAlO2(aq)Al(OH)3(s) C.AgNO3(aq)[Ag(NH3)2]+(aq)Ag(s) D.Fe2O3(s)Fe(s)FeCl3(aq) 解析:选A。2NaHCO3Na2CO3+CO2↑+H2O,Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,A项正确;2Al+2NaOH+2H2O===2NaAlO2+3H2↑,NaAlO2与过量HCl反应生成Al3+,即AlO+4H+===Al3++2H2O,B项错误;蔗糖分子中不含醛基,无还原性, 不能发生银镜反应,C项错误;Fe2O3+2AlAl2O3+2Fe,而Fe与HCl反应只能生成FeCl2:Fe+2HCl===FeCl2+H2↑,D项错误。 2.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( ) A.淀粉葡萄糖CH3CH2OHCH3CHO B.NH3NO2HNO3 C.Fe2O3FeCl3(aq)无水FeCl3 D.H2SSO3H2SO4 解析:选A。A选项,可以实现相关转化,所以正确;B选项,NH3催化氧化生成NO,而不是NO2,所以错误;C选项,FeCl3能发生水解反应,因此蒸发FeCl3溶液不能得到无水FeCl3,所以错误;D选项,H2S燃烧不能一步生成SO3,所以错误。 3.下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( ) 选项 X Y Z 箭头上所标数字的 反应条件 A Na NaOH NaCl ①加水 B NaCl NaHCO3 Na2CO3 ②加热 C N2 NO2 HNO3 ③加热 D C CO CO2 ④灼热炭粉 解析:选C。A项,①2Na+2H2O===2NaOH+H2↑,NaNaOHNaClNa;B项,②2NaHCO3Na2CO3+CO2↑+H2O,NaClNaHCO3Na2CO3NaCl;C项,N2不能直接与O2反应生成NO2;D项,④CO2+C2CO,CCOCO2C。 4.已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。 请回答下列问题: (1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式是 ;工业上制取A的离子方程式为________________________________________________________________________。 (2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。 (3)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为________________________________________________________________________。 某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:_________________。 解析:(1)氯气常用于自来水消毒,则A为Cl2;铁是使用最广泛的金属单质,D是铁,则B为FeCl3,C是FeCl2。 (2)碱性气体为NH3,汽车尾气中遇空气会变色的气体是NO。 (3)导致酸雨的主要气体是SO2,A与SO2均含有硫元素,且二者反应生成硫单质,故A为H2S。酸雨的主要成分是H2SO3,在放置过程中被氧化为H2SO4,酸性增强。 答案:(1)FeCl3 2Cl-+2H2O2OH-+Cl2↑+H2↑ (2)4NH3+5O24NO+6H2O (3)2H2S+SO2===3S↓+2H2O 2H2SO3+O2===4H++2SO查看更多