- 2021-07-02 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版铝及其重要化合物学案
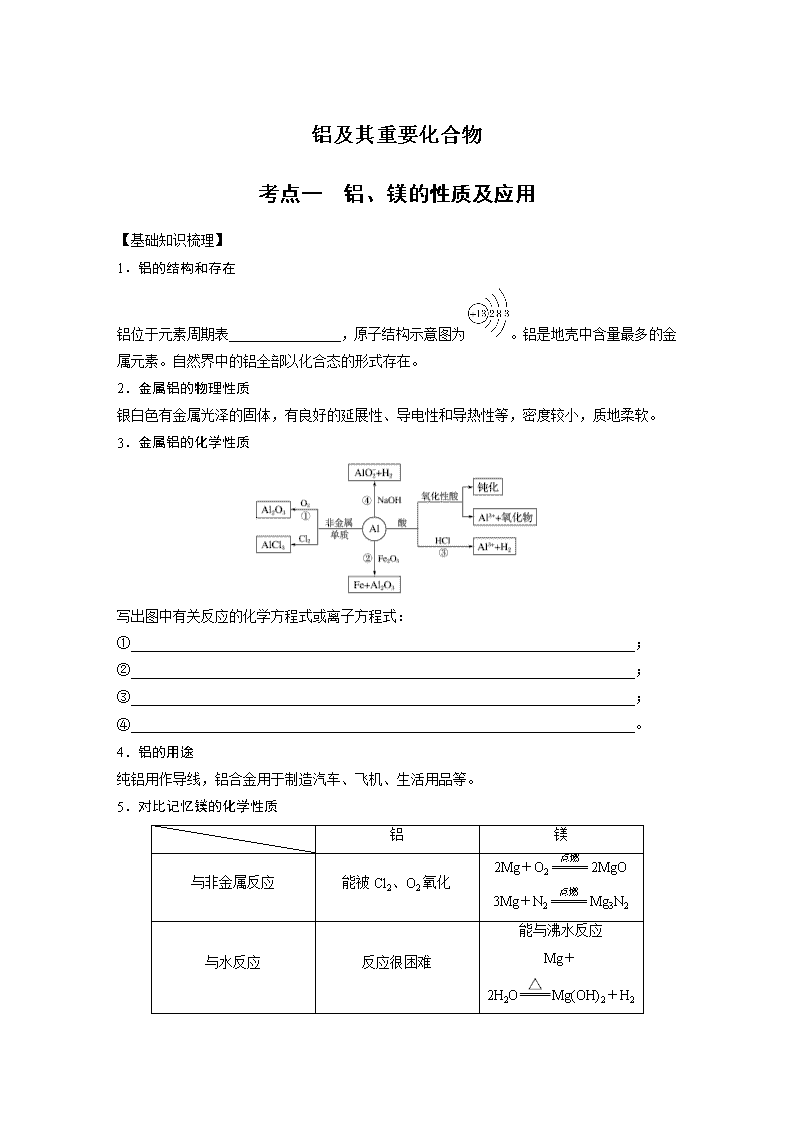
铝及其重要化合物 考点一 铝、镁的性质及应用 【基础知识梳理】 1.铝的结构和存在 铝位于元素周期表________________,原子结构示意图为。铝是地壳中含量最多的金属元素。自然界中的铝全部以化合态的形式存在。 2.金属铝的物理性质 银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。 3.金属铝的化学性质 写出图中有关反应的化学方程式或离子方程式: ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________; ④________________________________________________________________________。 4.铝的用途 纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。 5.对比记忆镁的化学性质 铝 镁 与非金属反应 能被Cl2、O2氧化 2Mg+O22MgO 3Mg+N2Mg3N2 与水反应 反应很困难 能与沸水反应 Mg+2H2OMg(OH)2+H2↑ 与碱反应 能溶于强碱溶液 不反应 与某些氧化物反应 能与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应 能在CO2中燃烧:2Mg+CO22MgO+C 深度思考 1.正误判断,正确的打“√”,错误的打“×” (1)铝在自然界中有游离态和化合态两种形式( ) (2)MgO与Al粉的混合物也可称为铝热剂( ) (3)Mg粉与浓NH4Cl溶液反应放出H2和NH3( ) (4)冶炼铝时常用焦炭作还原剂( ) (5)1molAl与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( ) (6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐( ) 2.镁在空气中充分燃烧,所得固体产物可能有________(用化学式表示)。 【解题探究】 题组一 对比掌握铝、镁的性质 1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是( ) A.①和② B.②和③ C.③和④ D.④和⑤ 2.下列关于铝单质的叙述中正确的是( ) A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长 B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属 C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层 D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆 题组二 铝与酸或碱反应的计算 3.(2016·河北衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( ) A.3mol·L-1HCl B.4mol·L-1HNO3 C.8mol·L-1NaOH D.18mol·L-1H2SO4 4.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题: (1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。 (2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生H2的体积之比是____________________________________________________________________。 (3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。 (4)甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为________(填字母)。 A.5.4gB.3.6gC.2.7gD.1.8g 【归纳总结】 铝与酸或碱反应生成H2的量的关系 2Al+6HCl===2AlCl3+3H2↑ 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ (1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应: ①产生H2的物质的量相等。 ②消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=3∶1。 (2)足量的铝分别与等物质的量的HCl和NaOH反应: ①消耗Al的物质的量之比为1∶3。 ②生成H2的物质的量之比为1∶3。 (3)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应: 若产生氢气的体积比为<<1,则必定 ①铝与盐酸反应时,铝过量而HCl不足。 ②铝与氢氧化钠溶液反应时,铝不足而NaOH过量。 考点二 铝的重要化合物 【基础知识梳理】 1.氧化铝 (1)物理性质:白色固体,难溶于水,有很高的熔点。 (2)化学性质 2.氢氧化铝 (1)物理性质:白色胶状不溶于水的固体,有较强的________性。 (2)化学性质(用化学方程式表示) Al(OH)3的电离方程式为 写出图中有关反应的化学方程式或离子方程式: ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________。 (3)制备 ①向铝盐中加入氨水,离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH。 ②NaAlO2溶液中通入足量CO2,离子方程式为AlO+CO2+2H2O===Al(OH)3↓+HCO。 ③NaAlO2溶液与AlCl3溶液混合:3AlO+Al3++6H2O===4Al(OH)3↓。 3.常见的铝盐 (1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。 (2)明矾的化学式_______________________________________________________________, 它是无色晶体,可溶于水,水溶液pH______7(填“<”、“>”或“=”)。明矾可以净水,其净水的原理是Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中杂质形成沉淀而净水。 (3)明矾溶液与Ba(OH)2溶液反应的离子方程式: ①Al3+恰好完全沉淀 ________________________________________________________________________ ________________________________________________________________________ ②SO恰好完全沉淀 ________________________________________________________________________ ________________________________________________________________________ 深度思考 1.在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。原因是_____________________________ ________________________________________________________________________。 2.中学化学学习阶段接触到许多既能与酸反应又能与碱反应的物质,除了Al及其重要化合物外,你还知道哪些? ________________________________________________________________________ ________________________________________________________________________ 【归纳总结】 两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物,上述物质中只有Al2O3、 Al(OH)3、氨基酸是两性物质。 【解题探究】 题组一 Al2O3和Al(OH)3的两性 1.(2016·日照调研)将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( ) A.稀硝酸 .稀盐酸 C.硝酸铜 .氢氧化钠 2.下列除去杂质的方法不正确的是( ) A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B.用过量氨水除去Fe3+溶液中的少量Al3+ C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO 【归纳总结】 含铝杂质的提纯方法归类 利用Al、Al2O3、Al(OH)3可溶于强碱的特性,可除去许多物质中的含铝杂质,如: (1)Mg(Al):加足量NaOH溶液。 (2)Fe2O3(Al2O3):加足量NaOH溶液。 (3)Mg(OH)2[Al(OH)3]:加足量NaOH溶液。 (4)Mg2+(Al3+):加过量NaOH溶液,过滤,再加酸充分溶解。 题组二 制备Al(OH)3的最佳途径 3.用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( ) ①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液 A.①⑥⑤③ .②③④③ C.②③⑤③ .①③⑤③ 4.若甲、乙、丙三位同学用规定的药品制备Al(OH)3。规定必用的药品如下:350g70%H2SO4溶液,NaOH固体240g,足量铝屑、水(不能用其他药品)。 甲、乙、丙用各自设计的方案制得Al(OH)3的质量分别是W1、W2、W3。三种实验方案如下: 甲:铝→加NaOH溶液→加H2SO4溶液→W1gAl(OH)3 乙:铝→加H2SO4溶液→加NaOH溶液→W2gAl(OH)3 丙:→W3gAl(OH)3 试回答: (1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是____________。 (2)三位学生制得的Al(OH)3,W1、W2、W3其质量由大到小的顺序是 ________________________。 (3)制得Al(OH)3的最大质量是________。 【归纳总结】 Al(OH)3的三种制备方法 方法一:可溶性铝盐溶液与过量氨水反应 反应原理:Al3++3NH3·H2O===Al(OH)3↓+3NH 方法二:向可溶性偏铝酸盐溶液中通入过量CO2 反应原理:AlO+2H2O+CO2===Al(OH)3↓+HCO 方法三:相互促进水解法 题组三 有关Al3+、AlO的离子反应 5.常温下,下列各组离子在指定溶液中能大量共存的是( ) A.中性溶液中:Cl-、Mg2+、Al3+、K+ B.1.0mol·L-1的NaAlO2溶液中:Cl-、HCO、K+、Ca2+ C.在强碱性环境中:AlO、SiO、Na+、K+ D.0.1mol·L-1明矾溶液中:NH、AlO、HCO、Na+ 6.(2016·济宁期中)下列反应中的离子方程式书写正确的是( ) A.向氯化铝溶液中滴加过量氨水:4NH3·H2O+Al3+===AlO+4NH+2H2O B.NH4Al(SO4)2溶液中滴加少量NaOH溶液:NH+OH-===NH3·H2O C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO+2Ba2++4OH-===2BaSO4↓+AlO+2H2O D.向NaAlO2溶液中通入足量CO2:2AlO+CO2+3H2O===2Al(OH)3↓+CO 【解题指导】 1.离子共存问题 (1)Al3+水解呈酸性,与OH-、AlO、CO(HCO)、S2-等不能大量共存。 (2)AlO水解呈碱性,与H+、HCO、Al3+、Fe3+等不能大量共存。 2.含Al3+的溶液与碱反应的先后顺序 当溶液中有多种离子时,要考虑离子之间的反应顺序,如向含有H+、NH、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,NaOH先与H+反应,再与Mg2+、Al3+反应生成沉淀,再与NH反应,最后才溶解Al(OH)3沉淀。 考点三 用数形结合思想理解“铝三角” 【基础知识梳理】 1.Al3+、Al(OH)3、AlO之间的转化关系 写出实现上述各步转化的离子方程式。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 2.与Al(OH)3沉淀生成有关的图像分析 (1)可溶性铝盐溶液与NaOH溶液反应的图像(从上述转化关系中选择符合图像变化的离子方程式,下同) 操作 可溶性铝盐溶液中逐滴加入NaOH溶液至过量 NaOH溶液中逐滴加入可溶性铝盐溶液至过量 现象 立即产生白色沉淀→渐多→最多→渐少→消失 无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失 图像 方程式 序号 AB:________ BD:________ AB:________ BC:________ (2)偏铝酸盐溶液与盐酸反应的图像 操作 偏铝酸盐溶液中逐滴加入稀盐酸至过量 稀盐酸中逐滴加入偏铝酸盐溶液至过量 现象 立即产生白色沉淀→渐多→最多→渐少→消失 无沉淀→出现沉淀→渐多→最多→沉淀不消失 图像 方程式序号 AB:________ BC:________ AB:________ BC:________ 深度思考 按要求画出图像。 (1)向MgCl2、AlCl3溶液中(假设各1mol),逐滴加入NaOH溶液,画出沉淀的物质的量随NaOH溶液体积变化的图像。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ (2)向HCl、MgCl2、AlCl3、NH4Cl溶液中(假设各1mol),逐滴加入NaOH溶液,画出沉淀的物质的量随NaOH溶液体积变化的图像。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ (3)向NaOH、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,画出沉淀的物质的量随HCl溶液体积变化的图像。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ (4)向NaOH、Na2CO3、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,画出沉淀的物质的量随HCl溶液体积变化的图像。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ (5)向NaOH、Ca(OH)2、NaAlO2溶液中(假设各1mol),通入CO2气体,画出沉淀的物质的量随CO2通入的变化图像。 ________________________________________________________________________ ________________________________________________________________________ ________________________________________________________________________ 【解题探究】 题组一 Al3+、AlO形成Al(OH)3图像的综合分析 1.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( ) A.①线表示Al3+的物质的量的变化 B.x表示AlCl3的物质的量 C.③线表示Al(OH)3的物质的量的变化 D.④线表示AlO的物质的量的变化 2. 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题: (1)溶液中一定含有的溶质是________________(填化学式,下同),一定不含有的溶质是 ________________________________________________________________________。 (2)溶液中可能含有的溶质是________(填名称),判断该物质是否存在的实验方法是 ________________________________________________________________________, 现象是__________________________________________________________________。 (3)分别写出AB段、BC段发生反应的离子方程式: ①AB段为________________________________________________________________; ②BC段为_______________________________________________________________。 题组二 Al3+形成Al(OH)3的简单计算 3.(2016·贵州高三模拟)向30mL1mol·L-1的AlCl3溶液中逐渐加入浓度为4mol·L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( ) A.3mLB.7.5mLC.15mLD.17.5mL 4.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示。原溶液中Cl-与SO的物质的量之比为( ) A.1∶3B.2∶3C.6∶1D.3∶1 【反思归纳】 可溶性铝盐与强碱反应的计算规律 (1)求产物Al(OH)3的量 ①当n(OH-)≤3n(Al3+)时,n[Al(OH)3]=n(OH-); ②当3n(Al3+)<n(OH-)<4n(Al3+)时, n[Al(OH)3]=4n(Al3+)-n(OH-); ③当n(OH-)≥4n(Al3+)时,n[Al(OH)3]=0,无沉淀。 (2)求反应物碱的量 ①若碱不足(Al3+未完全沉淀): n(OH-)=3n[Al(OH)3]; ②若碱使生成的Al(OH)3部分溶解: n(OH-)=4n(Al3+)-n[Al(OH)3]。 答案精析 考点一 基础知识梳理 1.第三周期ⅢA族 3.①4Al+3O22Al2O3 ②2Al+Fe2O32Fe+Al2O3 ③2Al+6H+===2Al3++3H2↑ ④2Al+2OH-+2H2O===2AlO+3H2↑ 深度思考 1.(1)× (2)× (3)√ (4)× (5)√ (6)× 2.MgO、Mg3N2、C 解题探究 1.C 2.B 3.A 4.(1)1∶1 (2)1∶3 (3)3∶1 (4)A 考点二 基础知识梳理 1.(2)Al2O3+6HCl===2AlCl3+3H2O Al2O3+2NaOH===2NaAlO2+H2O 2.(1)吸附 (2)①Al(OH)3+3H+===Al3++3H2O ②Al(OH)3+OH-===AlO+2H2O ③2Al(OH)3Al2O3+3H2O 3.(2)KAl(SO4)2·12H2O < ①2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓ ②Al3++2SO+2Ba2++4OH-===AlO+2BaSO4↓+2H2O 深度思考 1.铝箔与O2发生反应生成熔点很高的Al2O3薄膜,使内部的铝被Al2O3包裹着,所以熔化的铝不易滴下 2.①弱酸的铵盐,如:NH4HCO3、CH3COONH4、(NH4)2S等;②弱酸的酸式盐,如:NaHCO3、KHS、NaHSO3等;③氨基酸。 解题探究 1.C 2.B [Al(OH)3不溶于氨水,故向含少量Al3+的Fe3+溶液中加入过量氨水时,Fe3+、Al3+均转化为氢氧化物沉淀,达不到除杂的目的。] 3.B [若先用盐酸溶解,Mg、Al均溶解,制取Al(OH)3的步骤较多;从NaAlO2制备Al(OH)3,加盐酸不容易控制量的多少。故B项操作步骤为最佳顺序。] 4.(1)丙 (2)W3>W1>W2 (3)520g 5.C [A项,Al3+易水解,在中性溶液中水解生成Al(OH)3沉淀;B项,HCO+AlO+H2O===Al(OH)3↓+CO;D项,Al3+与AlO、HCO因发生双水解反应不能大量共存。] 6.C [A项,氨水不能溶解Al(OH)3;B项,NH、Al3+同时存在时,Al3+与OH-先反应;D项,通足量CO2时,应生成HCO。] 考点三 基础知识梳理 1.(1)①Al3++3NH3·H2O===Al(OH)3↓+3NH ②Al3++3AlO+6H2O===4Al(OH)3↓ ③Al3++3OH-===Al(OH)3↓ (2)Al(OH)3+3H+===Al3++3H2O (3)Al3++4OH-===AlO+2H2O (4)AlO+4H+===Al3++2H2O (5)①AlO+CO2+2H2O===Al(OH)3↓+HCO ②AlO+H++H2O===Al(OH)3↓ (6)Al(OH)3+OH-===AlO+2H2O 2.(1)(从左到右)(1)③ (6) (3) (1)② (2)(从左到右)(5)② (2) (4) (1)② 深度思考 (1) (2) (3) (4) (5) 解题探究 1.B 2.(1)HCl、AlCl3、NH4Cl MgCl2、Na2CO3 (2)氯化钾 焰色反应 透过蓝色钴玻璃观察火焰颜色是否为紫色 (3)①Al3++3OH-===Al(OH)3↓②NH+OH-===NH3·H2O 解析 首先分析图像中的拐点、斜线及水平线所表示的化学意义。OA段是NaOH溶液中和HCl;加入过量NaOH溶液,沉淀全部溶解,说明无MgCl2,所以沉淀只有Al(OH)3;BC段是NaOH溶液与NH4Cl反应,故原溶液中一定含有HCl和NH4Cl,一定无MgCl2;又因为HCl与Na2CO3不能大量共存,所以一定无Na2CO3,可能含有KCl,可用焰色反应进行确定。 3.B 4.C [OA上升的直线表示Al(OH)3和Mg(OH)2一起沉淀,AB下降的直线表示Al(OH)3沉淀溶解,B点表示Al(OH)3完全溶解。AB段完全溶解Al(OH)3消耗NaOH溶液0.1L,则Al3+生成Al(OH)3消耗NaOH溶液0.3L,沉淀Mg2+消耗NaOH溶液0.1L,因而n(AlCl3)∶n(MgSO4)=2∶1,所以,n(Cl-)∶n(SO)=6∶1。]查看更多