- 2021-07-02 发布 |
- 37.5 KB |
- 87页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习物质结构与性质课件(87张)(江苏专用)
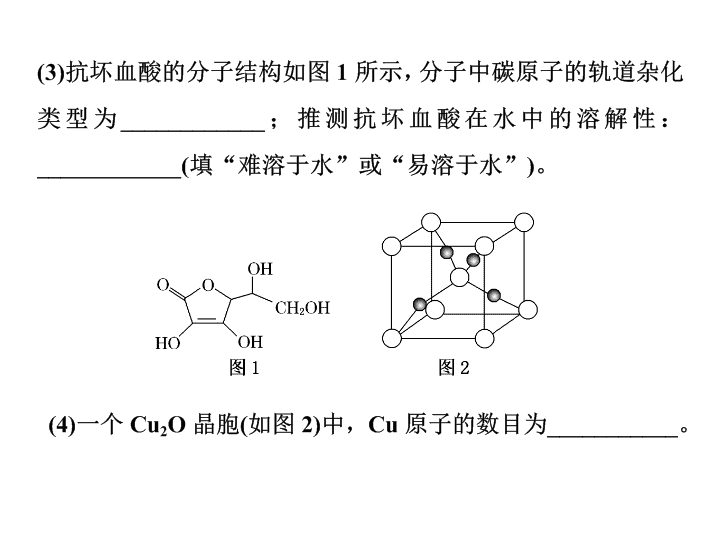
第 (1) 问 考查核外电子排布式的书写 第 (2) 问 考查离子的空间构型、配离子中的配位原子 第 (3) 问 考查中心原子的杂化方式、羟基对物质溶解性的影响 第 (4) 问 考查晶胞中原子的数目 第 (1) 问 考查中心原子的杂化方式、离子的空间构型 第 (2) 问 考查核外电子排布式的书写 第 (3) 问 考查等电子体 第 (4) 问 考查化学键类型的判断 第 (5) 问 考查配合物的结构 第 (1) 问 考查核外电子排布式的书写 第 (2) 问 考查中心原子的杂化轨道类型、化学键类型的判断 第 (3) 问 考查元素电负性大小的比较 第 (4) 问 考查氢键对物质熔沸点的影响 第 (5) 问 考查晶体的化学式 第 (1) 问 考查核外电子排布式的书写 第 (2) 问 考查化学键类型的判断 第 (3) 问 考查中心原子的杂化方式 第 (4) 问 考查等电子体 第 (5) 问 考查配合物的结构 能量最低原理 原子核外电子总是先占有能量最低的原子轨道,即 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s … 泡利 原理 每个原子轨道上最多只容纳 2 个自旋状态相反的电子 洪特 规则 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同 表示方法 举例 电子排布式 Cr : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 简化表示式 Cu : [Ar] 3d 10 4s 1 价电子排布式 Fe : 3d 6 4s 2 电子排布图 ( 或轨道表示式 ) 一般规律 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势,稀有气体元素的第一电离能最大,碱金属元素的第一电离能最小 同一主族,随着电子层数的增加,元素的第一电离能逐渐减小 特殊情况 第一电离能的变化与元素原子的核外电子排布有关。通常情况下,当原子核外电子排布在能量相等的轨道上形成全空 (p 0 、 d 0 、 f 0 ) 、半满 (p 3 、 d 5 、 f 7 ) 和全满 (p 6 、 d 10 、 f 14 ) 结构时,原子的能量较低,该元素具有较大的第一电离能 判断元素金 属性的强弱 电离能越小,金属越容易失去电子,金属性越强;反之越弱 判断元素的化合价 如果某元素的 I n + 1 ≫ I n ,则该元素的常见化合价为+ n ,如钠元素 I 2 ≫ I 1 ,所以钠元素的化合价为+ 1 分子 ( A 为中心 原子 ) 中心原子孤电子对数 中心原子杂化方式 分子构型 示例 AB 2 0 sp 直线形 BeCl 2 、 CO 2 、 HCN 1 sp 2 V 形 SO 2 、 O 3 2 sp 3 V 形 H 2 O 、 H 2 S AB 3 0 sp 2 平面三角形 BF 3 、 CH 2 O 、 SO 3 1 sp 3 三角锥形 NH 3 、 H 3 O + 、 PCl 3 AB 4 0 sp 3 正四面体形 CH 4 、 NH 、 SO 化学式 中心原子 杂化方式 分子 的空 间构型 分子的 极性 键的极性 键角 H 2 O sp 3 V 形 极性 极性 105° NH 3 sp 3 三角锥形 极性 极性 107° CO 2 sp 直线形 非极性 极性 180° CH 4 sp 3 正四面体形 非极性 极性 109°28 ′ C 2 H 4 sp 2 平面四边形 非极性 极性、非极性 120° 化学式 中心原子 杂化方式 分子的空 间构型 分子的 极性 键的极性 键角 C 2 H 2 sp 直线形 非极性 极性、非极性 180° sp 2 平面六边形 非极性 极性、非极性 120° BF 3 sp 2 平面三角形 非极性 极性 120° BeCl 2 sp 直线形 非极性 极性 180° 作用力 范德华力 氢键 共价键 作用粒子 分子或原子 ( 稀有气体 ) 氢原子与氟、氮、氧原子 ( 分子内、分子间 ) 原子 特征 无方向性、 无饱和性 有方向性、 有饱和性 有方向性、 有饱和性 强度比较 共价键>氢键>范德华力 作用力 范德华力 氢键 共价键 影响 强度 的因素 ① 随着分子极性和相对分子质量的增大而增大 ② 组成和结构相似的物质,相对分子质量越大,范德华力越大 对于 A—H … B— , A 、 B 的电负性越大, B 原子的半径越小,氢键强度越大 成键原子半径越小,键长越短,键能越大,共价键越稳定 对物质性 质的影响 ① 影响物质的熔沸点、溶解度等物理性质 ② 组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高 分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大 ① 影响分子的稳定性,共价键键能越大,分子稳定性越强 ② 影响原子晶体的熔沸点、硬度 物质 MnCl 2 MnS MnO 熔点 650 ℃ 1 610 ℃ 2 800 ℃ 谢谢观看查看更多