- 2021-07-02 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省信阳第一高级中学高二上学期期中联考化学试题(Word版)
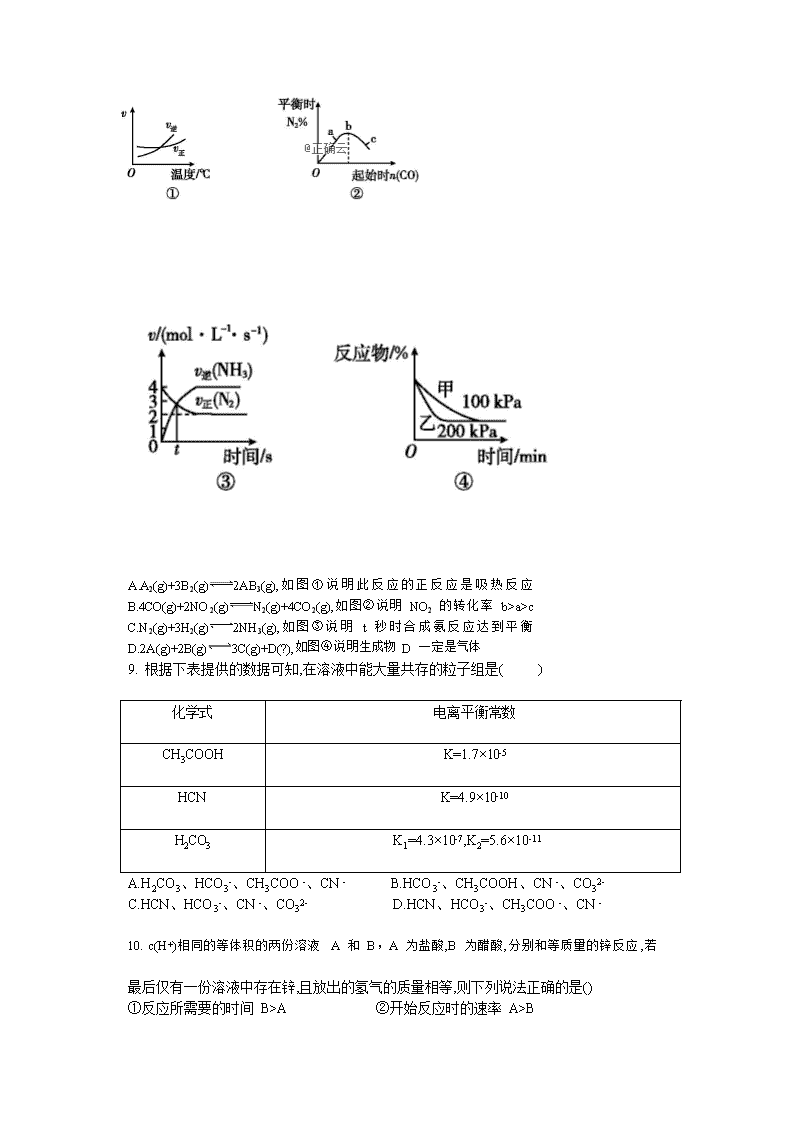
2018-2019学年河南省信阳第一高级中学高二上学期期中联考化学试题 命题人:史丽斐 说明: 1、本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)满分100分,考试时间90分钟。 2、将第Ⅰ卷的答案代表字母填(涂)在第Ⅱ卷的答题表(答题卡)中。 3、可能用到的相对原子质量:H-1 N-14 Ag-108 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-164 第Ⅰ卷(选择题 共 48 分)一、单项选择题:本题共 16 个小题,每小题 3 分,共 48 分。 1.人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能、太阳能的转换),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是( ) A.目前研究菠菜蛋白质“发电”不属于“太阳能文明” B.发展太阳能经济有助于减缓温室效应C.太阳能电池可将太阳能直接转化为电能 D.煤、石油和天然气都属于碳素燃料2.下列表述中正确的是( ) A.现在人们使用的能源正向多元化发展,许多新能源不断被开发利用,其中氢能和太阳能均属于清洁能源 B.已知反应 CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-802.3 kJ/mol,说明甲烷的燃烧热为 802.3 kJ/mol C.反应热的大小与反应物和生成物的键能无关 D.1 mol NaOH 分别和 1 mol CH3COOH、1 mol HNO3 反应,放出的热量相等 3.如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是( ) A.a 与 b 相比,b 的活化能更高B.反应物断键吸收的总能量大于生成物成键释放的总能量 C.a 与 b 相比,反应的平衡常数一定不同 D.a 与 b 相比,b 的反应速率更快 高二 化学第 1 页(共 8 页) 4. 以下可逆反应,在给定的条件下一定达到了化学平衡状态的是( ) A.N2(g)+3H2(g)2NH3(g)(在混合气体中 NH3 体积分数为 33.3%) B.CO(g)+H2O(g)CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变) C.2SO2(g)+O2(g)2SO3(g)(在恒压条件下,总质量不再改变) D.2NO2(g)2NO(g)+O2(g)(在恒容条件下,气体颜色不再改变) 5. 等质量的三份锌 a、b 和 c,分别加入足量的稀硫酸中, 同时,a 中加入适量 CuSO4 溶液,b中加入适量 CH3COONa 溶液,c 中不加入其他物质。下列各图中表示其产生 H2 的总体积(V)与 时间(t)的关系中正确的是( ) 6. 用惰性电极电解下列溶液,其中随着电解的进行,溶液 pH 逐渐减小的是( ) ①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液 A.①③⑤ B.②④⑤ C.②④ D.②④⑥ 7.2016 年 1 月《自然》杂志刊发了中科大科研组研究出一种新型电催化材料使 CO2 高效清洁地转化为液体燃料 HCOOH。则下列说法不正确的是( ) A.将 CO2 转化为燃料可减少 CO2 温室气体的排放 B.CO2 转化为 HCOOH 过程是 CO2 被还原的过程C.新型电催化材料降低了 CO2 催化还原的活化能 D.新型电催化材料提高了 CO2 还原为 HCOOH 的平衡常数8.化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是( ) A.A2(g)+3B2(g)2AB3(g),如图①说明此反应的正反应是吸热反应 B.4CO(g)+2NO2(g)N2(g)+4CO2(g),如图②说明 NO2 的转化率 b>a>c C.N2(g)+3H2(g)2NH3(g),如图③说明 t 秒时合成氨反应达到平衡 D.2A(g)+2B(g)3C(g)+D(?),如图④说明生成物 D 一定是气体 9. 根据下表提供的数据可知,在溶液中能大量共存的粒子组是( ) 化学式 电离平衡常数 CH3COOH K=1.7×10-5 HCN K=4.9×10-10 H2CO3 K1=4.3×10-7,K2=5.6×10-11 A.H2CO3、HCO3-、CH3COO -、CN - B.HCO3-、CH3COOH、CN -、CO32- C.HCN、HCO3-、CN -、CO32- D.HCN、HCO3-、CH3COO -、CN - 10. c(H+)相同的等体积的两份溶液 A 和 B,A 为盐酸,B 为醋酸,分别和等质量的锌反应,若 最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是() ①反应所需要的时间 B>A ②开始反应时的速率 A>B ③参加反应的锌的物质的量 A=B ④反应过程的平均速率 B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余 A.③④⑤ B.③④⑥ C.②③⑤ D.②③⑤⑥ 11. 黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为 S(s)+2KNO3(s)+3C(s)K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。 已知碳的燃烧热ΔH1=a kJ·mol-1; S(s)+2K(s) K2S(s) ΔH2=b kJ·mol-1; 2K(s)+N2(g)+3O2(g)2KNO3(s) ΔH3=c kJ·mol-1。则 x 为( ) A.3a+b-c B.c+3a-b C.a+b-c D.c+a-b 12. 两个惰性电极插入 500 mL AgNO3 溶液中,通电电解。当电解液的 pH 从 6.0 变为 3.0 时 (设电解过程中阴极没有 H2 放出,且电解液在电解前后体积变化可以忽略不计),电极上析 出银的质量最大为( ) A.27 mg B.54 mg C.106 mg D.216 mg 13. 化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是( ) 高二 化学第 3 页(共 8 页) A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 B.图②表示压强对可逆反应 2A(g)+2B(g)3C(g)+D(g)的影响,且甲的压强大 C.图③表示向 Al2(SO4)3 和 MgSO4 的混合液中滴加 NaOH 溶液,生成沉淀的量与滴入 NaOH 溶液体积的关系D.图④表示在 2 L 的密闭容器中发生合成氨反应时 N2 的物质的量随时间的变化曲线,0~10 min 内该反应的平均速率 v(H2)=0.045 mol·L-1· min-1,从 11 min 起其他条件不变,压缩容器的体积为 1 L,则 n(N2)的变化曲线为 d 14.2016 年 10 月 17 日“神舟”十一号飞船发射成功,19 日凌晨“神舟”十一号飞船与天 宫二号自动交会对接成功,在载人空间站的生态系统中,要求分离人呼出的二氧化碳,同时需要提供氧气。某电化学装置利用太阳能转化的电能可以实现上述要求,同时还有燃料一氧化碳生成,该电化学装置中得电子的电极发生的反应是 2CO2+4e-+2H2O2CO+4OH-。下列判断错误的是( ) A.上述电化学装置相当于电解池 B.上述装置进行的总反应为 2CO22CO+O2 C.反应结束后该电化学装置中的电解质溶液碱性增强 D.失电子的电极发生的反应是 4OH--4e-2H2O+O2↑ 15. 下列各可逆反应达平衡后,改变反应条件,其图像变化趋势正确的是( ) 高二 化学第 4 页(共 8 页) 16. CO2 溶于水生成碳酸。已知下列数据: 弱电解质 H2CO3 NH3·H2O 电离平衡常数(25 ℃) Ka1=4.30×10-7 Kb=1.77×10-5 Ka2=5.61×10-11 现有常温下 1 mol·L-1 的(NH4)2CO3 溶液,已知 NH4+的水解平衡常数 Kh= ,CO32-第一步水解的 平衡常数 Kh= 。下列说法正确的是( ) A.由数据可判断该溶液呈酸性 B.c(NH4+)>c(HCO3-)>c(CO32-)>c(NH3·H2O) C.c(NH4+)+c(NH3·H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) D.c(NH4+)+c(H+)=c(HCO3-)+c(OH -)+c(CO32-) 第Ⅱ卷(非选择题 共 52 分) 二、非选择题:包括第 17 题~第 21 题 5 个大题,共 52 分。 17.用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答: (1)准确称取 4.1 g 烧碱样品,所用主要仪器是________________________。 (2)将样品配成 250 mL 待测液,需要的仪器有__________________________。 (3)取 10.00 mL 待测液,用________量取。 (4)用 0.2010 mol/L 标准盐酸滴定待测烧碱溶液,滴定时________手旋转________式滴定管的玻璃活塞,________手不停地摇动锥形瓶,两眼注视______________________,直到滴定终点。 (5)根据下列数据,计算待测烧碱的纯度:____________。(以百分数表示,精确至小数点后两位) 高二 化学第 5 页(共 8 页) (6)以下滴定操作中,导致实验结果偏低的是________(填序号)。 ①酸式滴定管用蒸馏水洗净后没有用标准液润洗 ②酚酞指示剂变色时立即停止滴定 ③锥形瓶用蒸馏水洗净后没有用待测液润洗 ④滴定前滴定管尖端有气泡,滴定后气泡消失 ⑤终点读数时俯视,其他读数方法正确 18.为迎接 G20 峰会的到来,浙江加大了对环境治理的力度。其中对含氮化物的处理是一个重要的课题。 Ⅰ.氮氧化物 (1)已知:N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化情况如下: ①2NO(g) N2(g)+O2(g) ΔH= 。 ②你认为该反应能否自发,并说明理由: (2)科学家利用 2NO(g)N2(g)+O2(g)来消除 NO 的污染。1 mol NO 在恒温、容积恒定为 1 L 的密闭容器中反应,10 min 后达到平衡,NO 的物质的量为 0.4 mol。在第 15 min 时,保持温度不变,将容器的体积迅速增大至 2 L 并保持恒容,第 25 min 时到达平衡;第 30 min 时,保持温度和体积不变,向容器中再通入 0.2 mol NO,第 50 min 时达到平衡,请在图中下画出从第 15 min 起到 70 min NO 的物质的量随时间变化的曲线。 Ⅱ.亚硝酸盐 电化学处理:用电解法降解 NO2-其原理如下图所示,电源正极为 (填“A”或“B”), 阴极反应式为 。 高二 化学第 6 页(共 8 页) 19. 目前城市空气质量恶化的原因之一是机动车尾气和燃煤产生的烟气。NO 和 CO 均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: 2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=-a kJ· mol-1,在一定温度下,将 2.0 mol NO、 2.4 mol CO 气体通入固定容积为 2 L 的密闭容器中,反应过程中部分物质的浓度变化如图所示(计算结果保留三位有效数字): (1)0~15 min NO 的平均速率 v(NO)= ; CO 的转化为 (以 百分数表示,精确至小数点后一位)。 (2)15 min 后反应达到平衡,若将此时得到的 CO2 气体用含有 0.8 mol KOH 的溶液吸收,则电 解质溶液中各种离子的物质的量浓度由大到小的顺序是 。 (3)20 min 时,若改变某一反应条件,导致 CO 浓度增大,则改变的条件可能是 (填序 号)。 a.缩小容器体积 b.扩大容器体积 c.增加 NO 的量 d.降低温度 e.增加 CO 的量 f.使 用催化剂 (4)若保持反应体系的温度不变,20 min 时再向容器中充入 CO、CO2 各 0.4 mol,化学平衡将 (填“向左”“向右”或“不”)移动,重新达到平衡后,该反应的化学平衡常数为 (精 确至小数点后四位)。 20.(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在实际中可以设计成原电池的是 。 A.C(s)+H2O(g)CO(g)+H2(g) ΔH>0 B.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH<0 C.2H2(g)+O2(g)2H2O(l) ΔH<0 (2)以 KOH 溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为 。 高二 化学第 7 页(共 8 页) (3)电解原理在化学工业中有着广泛的应用。如图所示装置,C、D、E、F、X、Y 都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B 为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答: ①外接直流电源中 A 为 极,甲中电解时的化学反应方程式为 , 通过一段时间后向所得溶液中加入 0.2 mol Cu(OH)2 粉末,恰好恢复到电解前的浓度和 pH, 则电解过程中转移的电子的物质的量为 。 ②现用丙装置给铜件镀银,H 为 (填“镀件”或“镀层”),当乙中溶液的 pH 是 13 时(此时乙溶液体积为 500 mL),丙中镀件上析出银的质量为 。 ③电解一段时间后,发现丁中 Y 极附近溶液红褐色加深,则 Fe(OH)3 胶粒带 (填“正” 或“负”)电荷。 21. 某二元酸(化学式用 H2A 表示)在水中的电离方程式: H2A===H++HA- HA- H++A2- 回答下列问题: (1)Na2A 溶液显________(填“酸性”、“中性”或“碱性”),理由是____________(用离 子方程式或必要的文字说明表示)。 (2)常温下,已知 0.1 mol·L-1 NaHA 溶液 pH=2,则 0.1 mol·L-1 H2A 溶液中氢离子的物质的量浓度可能________0.11 mol·L-1(填“大于”、“等于”或“小于”),理由是 ________________________________________________________________________。 (3)0.1 mol·L-1 NaHA 的溶液中各种离子浓度由大到小的顺序是_________________。 高二 化学第 8 页(共 8 页) 2018-2019 学年(上)期中联考 高二化学 参考答案 第Ⅰ卷(选择题,共48分) 一、单项选择题:本题共 16 个小题,每小题 3 分,共 48 分。 题号 1 2 3 4 5 6 7 8 9 10 答案 A A D D A C D D D A 题号 11 12 13 14 15 16 答案 A B D C D C 第Ⅱ卷(非选择题 共 52 分)二、非选择题:包括第 17 题~第 21 题 5 个大题,共 52 分。 17.(共 10 分(1)托盘天平、小烧杯、药匙(1 分) (2)250 mL 容量瓶、小烧杯、玻璃棒、胶头滴管(1 分) (3)碱式滴定管或移液管(1 分) (4)左 酸 右 锥形瓶中溶液颜色变化(每空 1 分) (5)98.05%(1 分)(6)②⑤(2 分) 18.(共 8 分)Ⅰ.(1)①-180 kJ·mol-1 (1 分) ②该反应ΔH<0,若ΔS>0 则反应一定自发;若ΔS<0 则反应在低温下自发。(ΔS>0 和ΔS<0 讨论) (1 分) (2) (分段计分,改变容积图像或充入 NO 图像得一半的分)(2 分) Ⅱ.A(2 分) 2NO2-+6e-+4H2ON2↑+8OH-(2 分) (NaNO2 溶液显碱性,写成 2NO2-+6e-+8H+N2↑+4H2O 错) 1 19.(每空 2 分,共 12 分)(1)0.026 7 mol·L-1·min-1 33.3% (2)c(K+)>c(HCO3-)>c(OH-)> c(CO3-)> c(H+) (3)ae (4)向左 或 0.138 9 20.(每空 2 分,共 16 分)(1)C (2)H2+2OH--2e- 2H2O (3)①正 2CuSO4+2H2O 2Cu+O2↑+2H2SO4 0.8 mol ②镀件 5.4 g ③正 21.(共 6 分)(1)碱性(1 分) A2-+H2O HA-+OH-(1 分) (2)小于(1 分) H2A 第一步电离出的 H+对 HA-的电离起到抑制作用,使 HA-更难电离出 H+(2 分) (3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)(1 分)查看更多