- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年云南省曲靖市沾益区一中高二上学期第三次月考化学试题
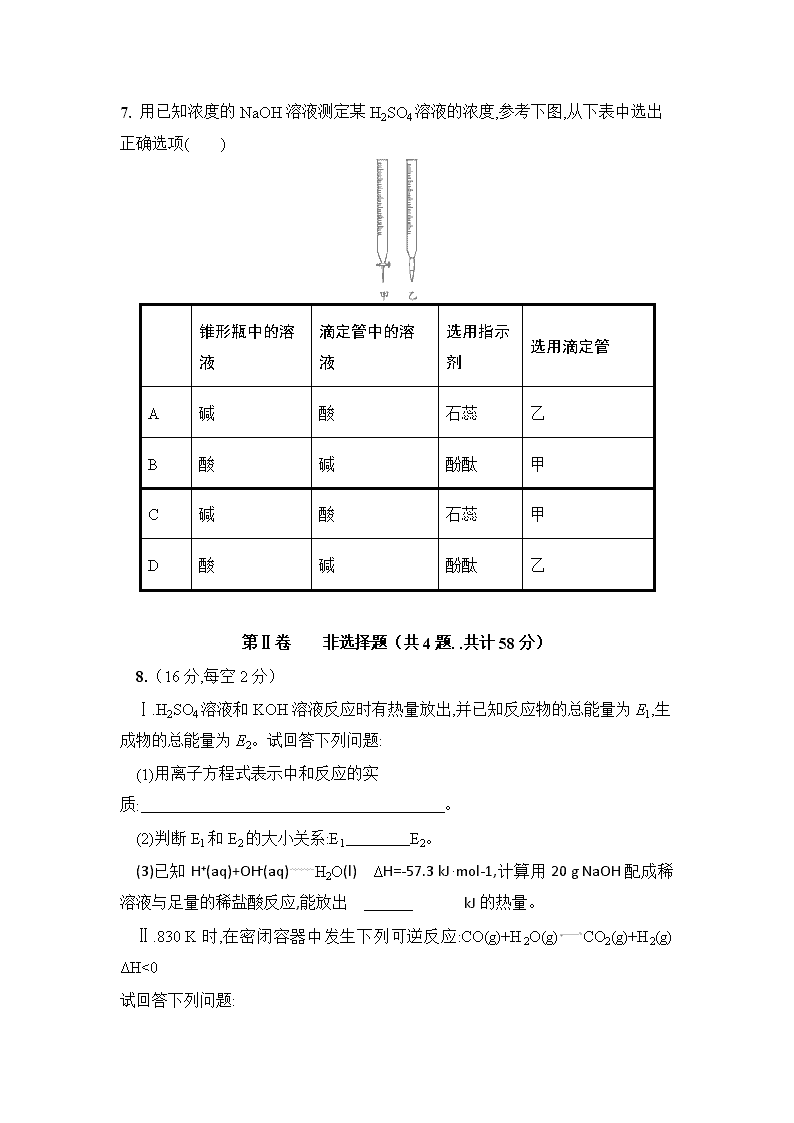
2017-2018学年云南省曲靖市沾益区一中高二上学期第三次月考 化学试卷 本卷可能用到的相对原子质量:H-1 C-12 O-16 N-14 Cl-35.5 Na-23 第Ⅰ卷 选择题(共42分) (下列每个小题只有一个选项符合题意;请将正确的选择填入答题卡,每小题6分,共7小题. 共记42分) 1. 25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( ) A.CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1 B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1 C.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1 D.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=+1 452 kJ·mol-1 2. 对达到化学平衡状态的可逆反应:A+BC+D。若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( ) A.A、B、C是气体,D不是气体 B.A、B是气体,C、D有一种是气体 C.C、D是气体,A、B有一种是气体 D.C、D有一种是气体,A、B都不是气体 3. 在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 物质 X Y Z 初始浓度/(mol·L-1) 0.1 0.2 0 平衡浓度/(mol·L-1) 0.05 0.05 0.1 下列说法错误的是( ) A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y2Z,其平衡常数为1 600 C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变温度可以改变此反应的平衡常数 4. 从植物花汁中提取的一种有机物HIn,可作酸碱指示剂,在水溶液中存在电离平衡:HIn(红色)H++In-(黄色),对上述平衡解释不正确的是( ) A.升高温度平衡正向移动 B.加入盐酸后平衡逆向移动,溶液显红色 C.加入NaOH溶液后平衡正向移动,溶液显黄色 D.加入NaHSO4溶液后平衡正向移动,溶液显黄色 5. 250c时,将某强酸和某强碱溶液按1:10的体积比混合后,溶液恰好呈中性,则混合前此强酸和强碱的pH和为( ) A.12 B.13 C.14 D.15 6. 100 mL pH=1的盐酸中逐渐加入NaOH溶液时,溶液pH的变化图像,根据如图所得结论正确的是( ) A.原来盐酸的物质的量浓度为0.1 mol·L-1 B.NaOH溶液的物质的量浓度为0.1 mol·L-1 C.原来盐酸的物质的量浓度为1 mol·L-1 D.NaOH溶液的物质的量浓度为0.01 mol·L-1 7. 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( ) 锥形瓶中的溶液 滴定管中的溶液 选用指示剂 选用滴定管 A 碱 酸 石蕊 乙 B 酸 碱 酚酞 甲 C 碱 酸 石蕊 甲 D 酸 碱 酚酞 乙 第Ⅱ卷 非选择题(共4题. .共计58分) 8.(16分,每空2分) Ⅰ.H2SO4溶液和KOH溶液反应时有热量放出,并已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题: (1)用离子方程式表示中和反应的实质: 。 (2)判断E1和E2的大小关系:E1 E2。 (3)已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,计算用20 g NaOH配成稀溶液与足量的稀盐酸反应,能放出 kJ的热量。 Ⅱ.830 K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0 试回答下列问题: (1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,4 s后达到平衡,此时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 。用H2O表示的化学反应速率为 。 (2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态? (填“是”或“否”),此时v(正) (填“大于”“小于”或“等于”)v(逆)。 (3)若降低温度,该反应的K值可能为 。 a.1 b.2 c.0.5 9. (12分,每空2分)下表是几种常见弱酸的电离平衡常数(25 ℃): 酸 电离方程式 电离平衡常数K CH3COOH CH3COOH CH3COO-+H+ 1.76×10-5 H2CO3 H2CO3H++HCO3- HCO3-H++CO32- K1=4.4×10-7 K2=4.7×10-11 H2S H2SH++HS- HS-H++S2- K1=1.3×10-7 K2=7.1×10-15 H3PO4 H3PO4H++H2PO4- H2PO4-H++HPO42- HPO42-H++PO43- K1=7.1×10-3 K2=6.3×10-8 K3=4.20×10-13 回答下列问题: (1)当温度升高时,K值 (填“增大”“减小”或“不变”)。 (2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? 。 (3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42- 都看作是酸,其中酸性最强的是 ,最弱的是 。 (4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是 ,产生此规律的原因是 。 10.(16分,每空2分) Ⅰ.pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图所示。回答下列问题:(纵坐标表示PH,横坐标表示加水的体积) (1)若a=5,则A为 (填“强”或“弱”,下同)酸,B为 酸,若再稀释100倍,则A的pH (填“<”“>”或“=”)7。 (2)若A、B都是弱酸,则a的范围是 。 Ⅱ.求下列溶液在25℃时,水电离的C(H+)或C(OH-)的浓度。 (1)0.001mol·L-1的HCl溶液,水电离的C(H+)= mol·L-1。 (2) PH=11的NaOH溶液,水电离的C(OH-)= mol·L-1。 (3) PH=9的Na2CO3溶液,水电离的C(OH-)= mol·L-1。 (4) PH=5的NH4Cl溶液,水电离的C(H+)= mol·L-1。 11. (14分,每空2分)某同学欲用已知物质的量浓度为0.100 0 mol·L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白: (1)用标准盐酸滴定待测氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到因加入一滴盐酸,溶液的颜色由 色变为 色,半分钟不恢复原色,立即停止滴定。 (2)下列操作中可能使所测氢氧化钠溶液的浓度偏低的是 (填序号)。 A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 C.酸式滴定管在滴定前有气泡,滴定后气泡消失 D.读取盐酸体积时,开始俯视读数,滴定结束时仰视读数 E.滴定过程中,振荡锥形瓶过于剧烈,使少量溶液溅出 (3)若第一次滴定开始和结束时,酸式滴定管中的液面如下图所示。则起始读数为V1= mL,终点读数V2= mL。 (4)再结合下表数据,计算被测氢氧化钠溶液的物质的量浓度是 mol·L-1。 滴定 次数 待测溶液 体积/mL 标准酸体积 滴定前的刻度/mL 滴定后的刻度/mL 第一次 10.00 V1 V2 第二次 10.00 4.10 21.10 第三次 10.00 0.40 17.60 参考答案 第Ⅰ卷 选择题(共42分) (下列每个小题只有一个选项符合题意;请将正确的选择填入答题卡,(共7题,每题6分,共42分) 题目 1 2 3 4 5 6 7 答案 B C C D B A D 第Ⅱ卷 (共4题,共计58分) 8.(16分,每空2分) Ⅰ.(1)H+(aq)+OH-(aq)H2O(l) (2) > 。 (3) 28.65 。 Ⅱ.(1) 1 , 0.3 mol·L-1·s-1_。 (2) 否 、 大于 。 (3) b 。 9、(12分,每空2分) (1) 增大____。 (2)K值越大,电离出的氢离子浓度越大,所以酸性越强。 (3) H3PO4 、 HS- 。 (4) K1≫K2≫K3.上一级电离产生的H+对下一级电离起抑制作用。 10.(16分,每空2分) Ⅰ.(1)强 、弱 、 < 。 (2) 2查看更多
相关文章
- 当前文档收益归属上传用户