- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版8-专项突破(十五)滴定曲线(pH曲线)分析教案
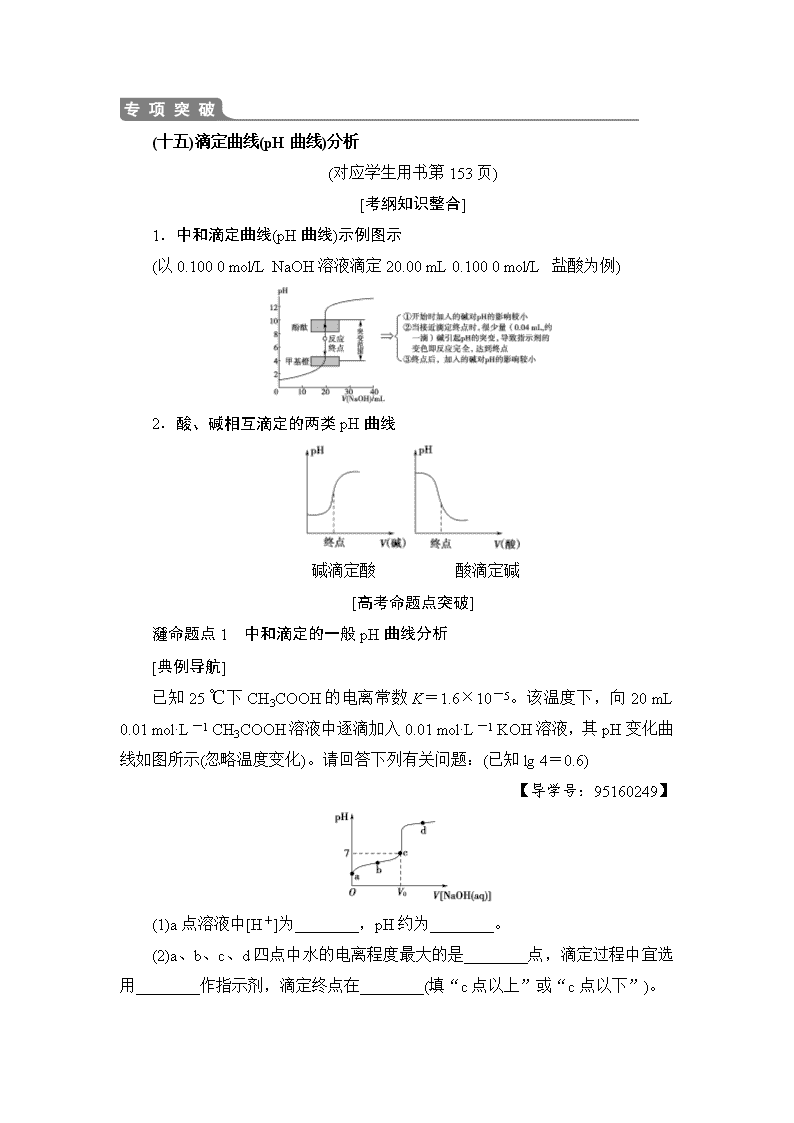
(十五)滴定曲线(pH曲线)分析 (对应学生用书第153页) [考纲知识整合] 1.中和滴定曲线(pH曲线)示例图示 (以0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L 盐酸为例) 2.酸、碱相互滴定的两类pH曲线 碱滴定酸 酸滴定碱 [高考命题点突破] 命题点1 中和滴定的一般pH曲线分析 [典例导航] 已知25 ℃下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg 4=0.6) 【导学号:95160249】 (1)a点溶液中[H+]为________,pH约为________。 (2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。 (3)V0________ 20 mL(填“>”“<”或“=”)。 (4)c点溶液中离子浓度大小顺序为___________________________________。 【解析】 (1)电离消耗的醋酸在计算醋酸的电离平衡浓度时可以忽略不计。由K=得,[H+]≈ mol·L-1=4×10-4 mol·L-1。 (2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点是CH3COOK和少量醋酸的混合溶液,d点是CH3COOK和KOH的混合溶液,酸、碱均能抑制水的电离,CH3COOK水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。滴定终点应在c点以上。 (3)恰好反应时,滴入KOH溶液的体积为20 mL,此溶液呈碱性,当pH=7时,KOH溶液加入的少,故V0<20 mL。 (4)根据电荷守恒知,[K+]+[H+]=[CH3COO-]+[OH-],又因pH=7,故[K+]=[CH3COO-]>[H+]=[OH-]。 【答案】 (1)4×10-4 mol·L-1 3.4 (2)c 酚酞 c点以上 (3)< (4)[K+]=[CH3COO-]>[H+]=[OH-] [对点训练] 1.(2016·全国Ⅰ卷)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( ) A.该滴定过程应该选择酚酞作为指示剂 B.M点对应的盐酸体积为20.0 mL C.M点处的溶液中[NH]=[Cl-]=[H+]=[OH-] D.N点处的溶液中pH<12 D [A项用0.10 mol·L-1盐酸滴定20.0 mL 0.10 mol·L-1 氨水,二者恰好完全反应时生成强酸弱碱盐NH4Cl,应选用甲基橙作指示剂。B项当V(HCl)=20.0 mL时,二者恰好完全反应生成NH4Cl,此时溶液呈酸性,而图中M点溶液的pH=7,故M点对应盐酸的体积小于20.0 mL。C项M点溶液呈中性,则有[H+]=[OH-];据电荷守恒可得[H+]+[NH]=[OH-]+[Cl-],则有[NH]=[Cl-],此时溶液中离子浓度关系为[NH]=[Cl-]>[H+]=[OH-]。D项NH3·H2O为弱电解质,部分发生电离,N点时V(HCl)=0,此时氨水的电离度为1.32%,则有[OH-]=0.10 mol·L-1×1.32%=1.32×10-3mol·L-1,[H+]==mol·L-1≈7.58×10-12mol·L-1,故N点处的溶液中pH<12。] 2.(2018·太原模拟)室温下,向a点(pH=XT)的20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是( ) 【导学号:95160250】 A.将此氨水稀释,溶液的导电能力减弱 B.b点溶液中离子浓度大小可能存在:[NH]>[Cl-]> [OH-]>[H+] C.c点时消耗盐酸体积V(HCl)<20.00 mL D.a、d两点的溶液,水的离子积KW(a)>KW(d) D [A项,稀释氨水,虽然促进一水合氨的电离,但溶液中离子浓度减小,导电能力降低,正确;B项,b点pH>7,[OH-]>[H+],溶液中电荷守恒为[NH]+[H+]=[Cl-]+[OH-],则[NH]>[Cl-],即[NH]>[Cl-]>[OH-]>[H+],正确;C项,溶液显中性时,HCl的物质的量小于一水合氨,所以c点消耗盐酸体积V(HCl)<20.00 mL,正确;D项,d点温度高于a点,水的离子积KW(a)查看更多