2017-2018学年湖北省湖北大学附属中学高二年级上学期期中考试化学试题
湖大附中2017-2018学年高二期中考试
化学试题
1.本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间90分钟,共100分。
第Ⅰ卷(选择题 共48分)
本卷含16小题,每小题3分,共48分,每小题只有一个选项符合题意。
你可能用到的相对原子质量:N-14 H-1
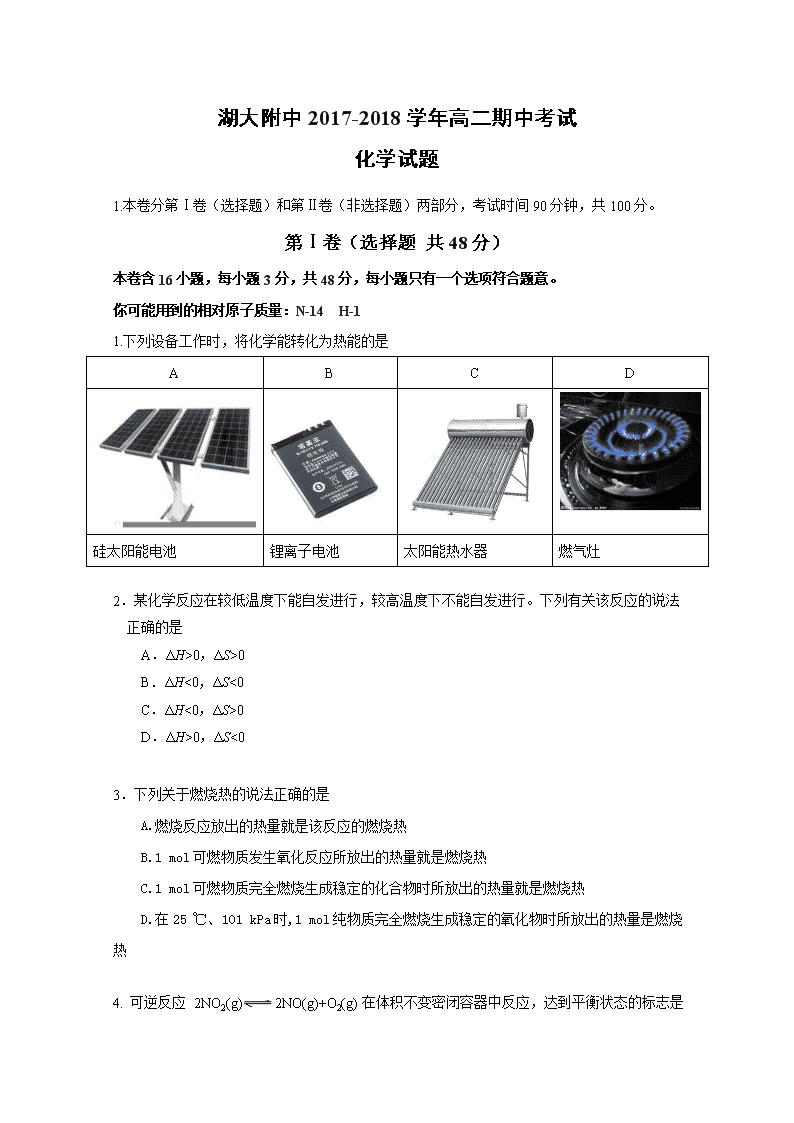
1.下列设备工作时,将化学能转化为热能的是
A
B
C
D
硅太阳能电池
锂离子电池
太阳能热水器
燃气灶
2.某化学反应在较低温度下能自发进行,较高温度下不能自发进行。下列有关该反应的说法正确的是
A.ΔH>0,ΔS>0
B.ΔH<0,ΔS<0
C.ΔH<0,ΔS>0
D.ΔH>0,ΔS<0
3.下列关于燃烧热的说法正确的是
A.燃烧反应放出的热量就是该反应的燃烧热
B.1 mol可燃物质发生氧化反应所放出的热量就是燃烧热
C.1 mol可燃物质完全燃烧生成稳定的化合物时所放出的热量就是燃烧热
D.在25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量是燃烧热
4. 可逆反应 2NO2(g)2NO(g)+O2(g) 在体积不变密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
5. 下列说法不正确的是
A.化学反应中的能量变化都表现为热量的变化
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.反应物的总能量低于生成物的总能量时,发生吸热反应
D.同温同压下,H2(g)+Cl2(g) == 2HCl(g)在光照和点燃条件下的ΔH相同
6.对于合成氨N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1反应,达到平衡后,以下分析正确的是
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
7.下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s)△H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=+285.8 kJ/mol
D.氢氧化钡晶体与氯化铵晶体混合吸热,反应物的总键能之和高于生成物的总键能之和
8.可逆反应aA(g)+bB(g)cC(g)+dD(g)符合下图.则下列叙述正确的是
A.a+b<c+d;正反应吸热
B.a+b>c+d;正反应放热
C.a+b<c+d;正反应放热
D.a+b>c+d;正反应吸热
9.下列热化学方程式或叙述正确的是
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:
N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ的热量:
2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,
则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D.已知N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
10. 在密闭容器中,反应2X(g)+ Y2(g) 2XY(g) △H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
A.图I中,甲、乙的平衡常数分别为K1、K2,则K1
v(逆)
D.相同温度下,若起始时向容器中充入1.0molCH3OH,达到平衡时CH3OH转化率大于1/3
14.一密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m+n>p B.平衡向正反应方向移动了
C.物质B的转化率增大了 D.物质C的质量分数增加了
15. 已知:2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
16.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
题号
1
2
3
4
5
6
7
8
答案
错误!链接无效。
9
10
11
12
13
14
15
16
错误!链接无效。
第Ⅱ卷 (非选择题 共52分)
17.(8分)Ⅰ.(1)当1 g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:__________ ____________________________________________________________________
高二 班 姓名 考号
(2)HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和NaOH反应的中和热的热化学方程式为___________________________________________________________________________
Ⅱ.已知下列反应,回答下列问题:
2CO(g)+O2(g)=2CO2(g) △H=﹣566kJ/mol ①
Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g) △H=﹣266kJ/mol ②
(1)CO的燃烧热为 .
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为: 。
(3)已知反应①中的相关的化学键键能数据如下:则a= kJ/mol
化学键
C=O(CO2)
C O(CO)
O=O
E/(kJ.mol-1)
803.5
1076
a
18.(4分)已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)2NH3(g) ΔH=-92kJ/mol
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量___________92kJ(填“大于”、“等于”或“小于”);若升高温度,上述反应中ΔH___________(填“变大”、“变小”或“不变”)。
(2)已知:分别破坏1molNH键、1mol HH键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol NN键需要吸收的能量为___________。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(L•min),则N2(g)+3H2(g)2NH3(g) 反应的平衡常数为___________。
19. (18分) NO是一种性质活泼的大气污染物,它能与很多物质发生反应。
(Ⅰ)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2 (g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)写出该反应的平衡常数表达式:
K= 。
已知:>,则该反应是 热反应。
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0-2 s内该反应的平均速率
v = 。
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(Ⅱ
)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO2CO2+N2。
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s)
0
1
2
3
4
5
c(NO)(mol/L)
1.00×10-3
4.50×10-4
2.50×10-4
1.50×10-4
1.00×10-4
1.00×10-4
c(CO)(mol/L)
3.60×10-3
3.05×10-3
2.85×10-3
2.75×10-3
2.70×10-3
2.70×10-3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)上述条件下反应能够自发进行,则该反应的△H 0(填写“>”、“<”、“=”)。
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究 和 对化学反应速率的影响。
实验编号
T(℃)
NO初始浓(mol/L)
CO初始浓度(mol/L)
催化剂的比表面积(m2/g)
Ⅰ
280
1.20×10-3
5.80×10-3
82
Ⅱ
280
1.20×10-3
5.80×10-3
124
Ⅲ
350
1.20×10-3
5.80×10-3
124
20.(16分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1,反应的平衡常数K1为_________
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是___________________________________
______________________________________________________________________。
②温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积压缩到原体积的一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________________
______________________________________________________________________。
21.(6分)二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I. CO(g)+2H2(g)CH3OH(g)
II. 2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为______反应(填”吸热”’或”放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是____(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4molCO和8molH2,4min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。
湖大附中2017-2018学年高二期中
化学试题参考答案
一、选择题
1
2
3
4
5
6
7
8
D
B
D
A
A
B
D
A
9
10
11
12
13
14
15
16
C
D
D
C
C
A
C
C
二、填空题
17. (8分,热化学方程式2分,其他1分)
Ⅰ.(1) 2NH3(g) N2(g)+3H2(g) ΔH=+91.8kJ/mol
(2) H2SO4(aq)+NaOH(aq)= Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol
Ⅱ.(1)283kJ/mol;
(2)CO(g)+Na2O2(s)=Na2CO3(s) △H=﹣549 kJ/mol;
(3)496
18. (4分,每空1分)
(1)小于,不变;(2)946kJ;(3)100/3(或33.3或100/3mol-2.L2或33.3mol-2.L2)。
19.(18分,每空2分)
(Ⅰ)(1) K= ;放
(2)b 1.5×10-3mol·L-1·s-1 (3) c
(Ⅱ)(1)< (2)C、D; (3)温度; 催化剂比表面积
20. (16分,每空2分)(1)大于 0.001 0.36
(2)大于 c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高 1.28
(3)逆反应 增大压强平衡向气体体积减小的方向移动即逆反应方向
21. (6分,每空1分)
(1)放热
(2) ①a ②AC
(3)①0.8 mol·L-1·min-1 1.25
②80%