2018届高考一轮复习人教版物质结构与性质原子结构与性质学案(1)
第一讲 原子结构与性质
[2017高考导航]
考纲要求
真题统计
命题趋势
1.了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子、价电子的排布。了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某些性质。
3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
2015,卷Ⅰ 37T(1);
2015,卷Ⅱ 37T(1);
2014,卷Ⅰ 37T(2);
2014,卷Ⅱ 37T(1);
2013,卷Ⅰ 37T(1);
2013,卷Ⅱ 37T(1)(2)
高考对本部分的考查主要有三个方面:前四周期元素核外电子排布式的书写与推断;运用电离能、电负性解释推断某些元素的性质;原子结构与性质的应用。考查题型为非选择题,分数约为3~6分。预计2017年高考将会稳中有变,可能与元素周期律、元素周期表的知识或元素及其化合物的知识相结合进行考查。注意本部分考查内容的规律性强,因此命题空间广阔,考查方式也会向多方位、多层次发展。
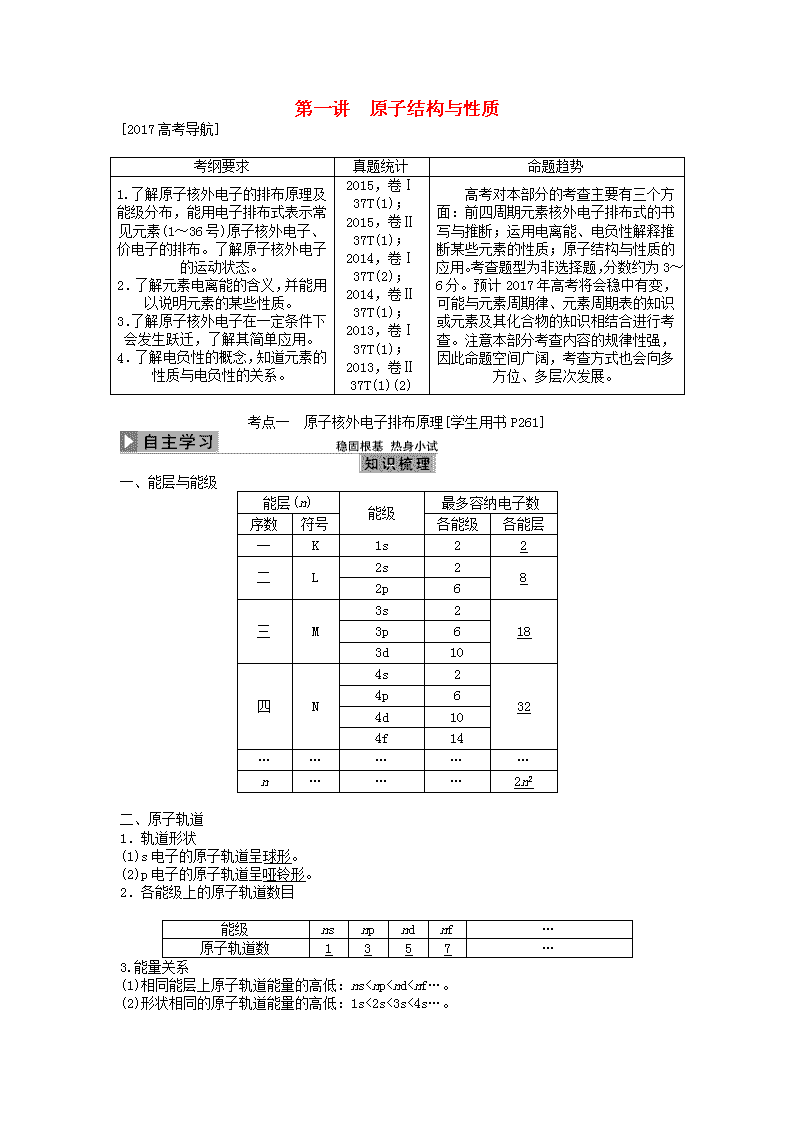
考点一 原子核外电子排布原理[学生用书P261]
一、能层与能级
能层(n)
能级
最多容纳电子数
序数
符号
各能级
各能层
一
K
1s
2
2
二
L
2s
2
8
2p
6
三
M
3s
2
18
3p
6
3d
10
四
N
4s
2
32
4p
6
4d
10
4f
14
…
…
…
…
…
n
…
…
…
2n2
二、原子轨道
1.轨道形状
(1)s电子的原子轨道呈球形。
(2)p电子的原子轨道呈哑铃形。
2.各能级上的原子轨道数目
能级
ns
np
nd
nf
…
原子轨道数
1
3
5
7
…
3.能量关系
(1)相同能层上原子轨道能量的高低:ns
SiH4
B.离子半径:Na+>S2-
C.第一电离能:N>O
D.元素电负性:C>H
解析:选B。Si、S在同一周期,S在Si的右侧,非金属性S大于Si,故热稳定性H2S比SiH4强,A项正确;S2-有三个电子层,Na+有两个电子层,故离子半径S2->Na+,B项错误;氮原子的2p轨道电子处于半满状态,结构较稳定,其第一电离能大于氧的,C项正确;碳的非金属性比氢的强,故电负性碳大于氢,D项正确。
名师点拨
(2016·潍坊高三模拟)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)元素p为26号元素,请写出其基态原子的电子排布式:______________。
(2)d与a的单质发生反应,生成产物的分子式为________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________________________________________
________________________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素
o
p
电离能/kJ·mol-1
I1
717
759
I2
1 509
1 561
I3
3 248
2 957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是________________________________________________________________________
________________________________________________________________________。
(5)第三周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____________(填下图中的序号)。
(6)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是____________(填元素符号)。
[解析] (1)26号为铁元素,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。
(2)d为N元素,a为H元素,二者单质发生反应生成物的分子式为NH3。
(3)h为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,原因是电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量。
(4)o元素为Mn,其基态原子的电子排布式为1s22s22p63s23p63d54s2,Mn2+的基态离子的电子排布式为1s22s22p63s23p63d5,其3d能级为半充满结构,相对比较稳定,当其失去第三个电子时比较困难,而p2+的基态离子的电子排布式为1s22s22p63s23p63d6,其3d能级再失去一个电子即为半充满结构,形成相对比较稳定的结构,故其失去第三个电子比较容易。
(5)第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氯气、氩气为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。
(6)由图可知,该元素的电离能I4远大于I3,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
[答案] (1)1s22s22p63s23p63d64s2或[Ar]3d64s2 (2)NH3
(3)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量
(4)Mn2+的3d轨道电子排布为半满状态,比较稳定
(5)2 (6)Al
1.为什么一个原子的逐级电离能是逐渐增大的?
答案:随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的电性吸力也越来越大,消耗的能量越来越多。
2.为什么Na容易形成+1价离子,而Mg、Al易形成+2价、+3 价离子?说明了什么?
答案:Na的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子形成+1价离子;Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成+2价离子;Al的I1、I2、I3相差不多,而I3比I4小很多,所以Al容易失去三个电子形成+3价离子。而电离能的突跃变化,说明核外电子是分能层排布的。
第二、三、四周期的同周期主族元素,第ⅡA族(ns2np0)和第ⅤA族(ns2np3),因p轨道处于全空或半充满状态,比较稳定,所以其第一电离能大于同周期相邻的ⅢA和ⅥA族元素,如第一电离能Mg>Al,P>S。
题组一 由原子序数确定其在元素周期表中的
位置
1.某元素的原子序数为29,试问:
(1)写出该元素的名称及元素符号。
(2)写出该元素基态原子的电子排布式。
(3)它有多少个电子层?有多少个能级?
(4)它的价电子排布式是什么?
(5)它属于第几周期?第几族?主族还是副族?属于哪一个分区?
(6)它有多少个未成对电子?
解析:29号元素为铜(Cu)元素,其原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故有4个电子层,7个能级,价电子排布式为3d104s1,属于第ⅠB族,为ds区。其价电子的电子排布图为,故有1个未成对电子。
答案:(1)铜;Cu。
(2)1s22s22p63s23p63d104s1或[Ar]3d104s1。
(3)4个电子层;7个能级。
(4)3d104s1。
(5)第四周期;ⅠB族;副族;ds区。
(6)有1个未成对电子。
题组二 电离能及其应用
2.下列关于元素第一电离能的说法不正确的是( )
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的电离能I1O、Mg>Al,B项错;C项所述元素为0族元素,性质稳定,第一电离能都较大。
3.(2016·开封高三模拟)下列有关微粒性质的排列顺序中,错误的是( )
A.元素的电负性:PNa+>Mg2+
D.原子的未成对电子数:Mn>Si>Cl
解析:选B。得电子能力:PNa+>Mg2+,故C正确;Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:Mn>Si>Cl,故D正确。
题组三 电负性及其应用
4.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度。下列关于电负性的变化规律正确的是( )
A.元素周期表从左到右,元素的电负性逐渐变大
B.元素周期表从上到下,元素的电负性逐渐变大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
解析:选A。利用同周期从左至右元素电负性逐渐增大,同主族从上至下元素电负性逐渐减小的规律来判断。电负性越大,金属性越弱,非金属性越强。
5.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
元素
符号
Li
Be
B
C
O
F
Na
Al
Si
P
S
Cl
电负性
0.98
1.57
2.04
2.55
3.44
3.98
0.93
1.61
1.90
2.19
2.58
3.16
(1)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是________________________________________________________________________。
(2)通过分析电负性变化规律,确定Mg元素电负性的最小范围:__________。
(3)从电负性角度,判断AlCl3
是离子化合物还是共价化合物?请说出理由,并设计一个实验方案证明上述所得结论。
答案:(1)Be(OH)2+2H+===Be2++2H2O,Be(OH)2+2OH-===BeO+2H2O
(2)0.93~1.57
(3)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物。将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物。
一、选择题
1.下列说法正确的是( )
A.同一原子中,2p、3p、4p能级的轨道依次增多
B.当碳原子的核外电子排布由 转变为 时,这一过程中释放能量
C.3p2表示3p能级有两个轨道
D.在同一能级上运动的电子,其运动状态可能相同
解析:选B。A项,2p、3p、4p能级的轨道一样多,均有3个轨道;B项,由激发态到基态,释放能量,正确;C项,3p2表示3p轨道上有2个电子;D项,在同一能级上运动的电子,其运动状态不可能相同。
2.下列关于第一电离能和电负性的说法不正确的是( )
A.第一电离能的大小:Mg>Al
B.锗的第一电离能高于碳而电负性低于碳
C.Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳
D.F、K、Fe、Ni四种元素中电负性最大的是F
解析:选B。锗是金属元素而碳是非金属元素,锗的第一电离能低于碳,B不正确。
3.如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
解析:选B。对于第三周期11~17号元素,随着原子序数的增大,第一电离能呈现增大的趋势,但Mg、P特殊,A项错误;原子半径逐渐减小,C项错误;形成基态离子转移的电子数依次为Na为1,Mg为2,Al为3,Si不易形成离子,P为3,S为2,Cl为1,D项错误。
4.下列有关说法正确的是( )
A.C、N、O三种元素第一电离能从大到小的顺序是O>N>C
B.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D.Ni原子的核外电子排布式为1s22s22p63s23p63d84s2
解析:选D。同一周期自左向右,元素的第一电离能呈现增大趋势,但由于p轨道处于全空、半充满或全充满时相对稳定,这使得第ⅡA族、第ⅤA族元素反常,故第一电离能N>O,Mg>Al,A、B不正确;F没有正化合价,C不正确。
5.(2016·秦皇岛高三模拟)下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
元素
I1
I2
I3
I4
……
R
740
1 500
7 700
10 500
①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2
A.①② B.②③
C.③④ D.①④
解析:选B。由表中数据可知,R元素的第三电离能与第二电离能的差距最大,故最外层有两个电子,最高正价为+2价,位于第ⅡA族,可能为Be或Mg元素,因此①不正确,②正确,④不确定;短周期第ⅡA族(ns2np0)的元素,因p轨道处于全空状态,比较稳定,所以其第一电离能大于同周期相邻主族元素,③正确。
6.(2016·西安高三模拟)在第二周期中,B、C、N、O四种元素的第一电离能由大到小的排列顺序正确的是( )
A.I1(N)>I1(C)>I1(O)>I1(B)
B.I1(N)>I1(O)>I1(B)>I1(C)
C.I1(N)>I1(O)>I1(C)>I1(B)
D.I1(O)>I1(N)>I1(C)>I1(B)
解析:选C。B、C、N、O是第二周期原子序数依次增大的元素,第一电离能呈增大趋势,但是N元素电子亚层结构为半满,其第一电离能比C和O要大。
7.若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法正确的是( )
A.该元素原子最外层共有3个电子
B.该元素处于第五周期ⅡA族
C.该元素原子核外第N层上共有9个不同状态的电子
D.该元素原子第四电子层上有5个空轨道
解析:选C。该元素位于第五周期第ⅢB族,为39号元素,N层电子排布式4s24p64d1,共有9个不同状态的电子,该电子层共有4个空轨道。
8.(2016·武汉高三调研)在核电荷数为26的元素Fe的原子核外3d、4s轨道内,下列电子排布图正确的是( )
解析:选C。核电荷数为26的Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,3d有5个轨道,只有1个轨道排满两个电子,且自旋方向相反,其他4个轨道各排1个电子,且自旋方向相同,4s轨道排满2个电子,且自旋方向相反,即C项正确。
9.(2016·徐州高三质检)已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成的化合物中,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性X的弱于Y的
D.气态氢化物的稳定性HmY弱于HnX
解析:选C。由题意,非金属性X>Y,所以最高价含氧酸的酸性X的强于Y的。
二、非选择题
10.现有部分前36号元素的性质或原子结构如下表:
元素编号
元素的性质或原子结构
R
基态原子的最外层有3个未成对电子,次外层有2个电子
S
单质能与水剧烈反应,所得溶液呈弱酸性
T
基态原子3d轨道上有1个电子
X
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是____________________________。
(2)S元素的常见化合价为________,原因是____________________________。
(3)T元素的原子N电子层上电子数为________________________________________________________________________。
(4)X的核外电子排布图违背了________________________________________________________________________。
解析:(1)由R的核外电子排布可知为N,N原子2p轨道半充满,能量低,较稳定,所以其第一电离能较大。(2)由题知S为氟元素,F的电负性最强,只能得电子,无正价,其常见化合价为-1价。(3)T原子核外电子排布式为1s22s22p63s23p63d14s2,由能量最低原理先排4s轨道再排3d轨道,则N电子层有2个电子。(4)X元素的核外电子排布应先排能量低的3s轨道。
答案:(1)氮原子2p轨道半充满,能量低,较稳定 (2)-1价 F的电负性最强,只能得电子 (3)2 (4)能量最低原理
11.已知A、B、C、D、E原子序数依次增大,且满足下表中条件,请推断各元素并回答相关问题。
A
基态原子有3个不同的能级,各能级中电子数相等
B
在D的上一周期
C
基态原子2p能级上的未成对电子数与A原子相同
D
在同周期元素中,D形成的简单离子半径最小
E
基态原子的M电子层上有4个未成对电子
(1)E元素的基态原子的外围电子排布式为________________________________________________________________________;
E可形成E2+和E3+,其中较稳定的是E3+,原因是________________________________________________________________________
________________________________________________________________________。
(2)A、B、C元素中,电负性最大的是________(填元素符号,下同),第一电离能最大的是________。
(3)D元素的基态原子的价电子的电子排布图为________。
解析:由A的基态原子有3个不同的能级,各能级中电子数相等,可知A的基态原子电子排布式为1s22s22p2,为碳元素;由C的基态原子2p能级上的未成对电子数与A原子相同(为2个),故其基态原子的电子排布式为1s22s22p4,为氧元素,依据A、B、C的原子序数逐渐增大可知B为氮元素;由D位于氮元素的下一周期,且形成的简单离子半径最小,则D为铝元素;由E的基态原子的M电子层上有4个未成对电子,可知其基态原子电子排布式为[Ar]3d64s2,为铁元素。(1)Fe3+的核外电子排布式为[Ar]3d5,其d能级处于半满状态,较为稳定;(2)氮原子的2p能级处于半满状态,较为稳定,难以失去电子,故其第一电离能较大。
答案:(1)3d64s2 Fe3+的d能级处于半满状态,较为稳定
(2)O N
12.(2016·马鞍山高三质检)A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素
相关信息
A
原子核外有6种不同运动状态的电子
C
基态原子中s电子总数与p电子总数相等
D
原子半径在同周期元素中最大
E
基态原子最外层电子排布式为3s23p1
F
基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反
G
基态原子核外有7个能级且能量最高的能级上有6个电子
H
是我国使用最早的合金中的最主要元素
请用化学用语填空:
(1)A元素位于元素周期表第________周期________族;B元素和C元素的第一电离能比较,较大的是________;C元素和F元素的电负性比较,较小的是________。
(2)G元素的低价阳离子的结构示意图是__________,F元素原子的价电子的电子排布图是________________,H元素的基态原子核外电子排布式是________________________________________________________________________。
(3)G的高价阳离子的溶液与H单质反应的离子方程式为__________________________;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式:
________________________________________________________________________。
解析:A的原子核外有6种不同运动状态的电子,即核外共有6个电子,A为碳元素。C的基态原子中s电子总数与p电子总数相等,则核外电子排布式为1s22s22p4,C是氧元素。由于A、B、C原子序数依次增大,故B是氮元素。E的基态原子最外层电子排布式为3s23p1,是铝元素。D的原子半径在同周期元素中最大,且D的原子序数比C大比E小,故D是钠元素。F的基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反,说明p轨道上有5个电子,是氯元素。G的基态原子核外有7个能级且能量最高的能级上有6个电子,则其电子排布式为1s22s22p63s23p63d64s2,是铁元素。H是我国使用最早的合金中的最主要元素,是铜元素。
答案:(1)二 ⅣA N Cl
1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)2Fe3++Cu===2Fe2++Cu2+ Be(OH)2+2NaOH===Na2BeO2+2H2O
13.根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________
查看更多