- 2021-07-02 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版高考化学一轮复习核心素养测评七钠及其化合物含解析新人教版
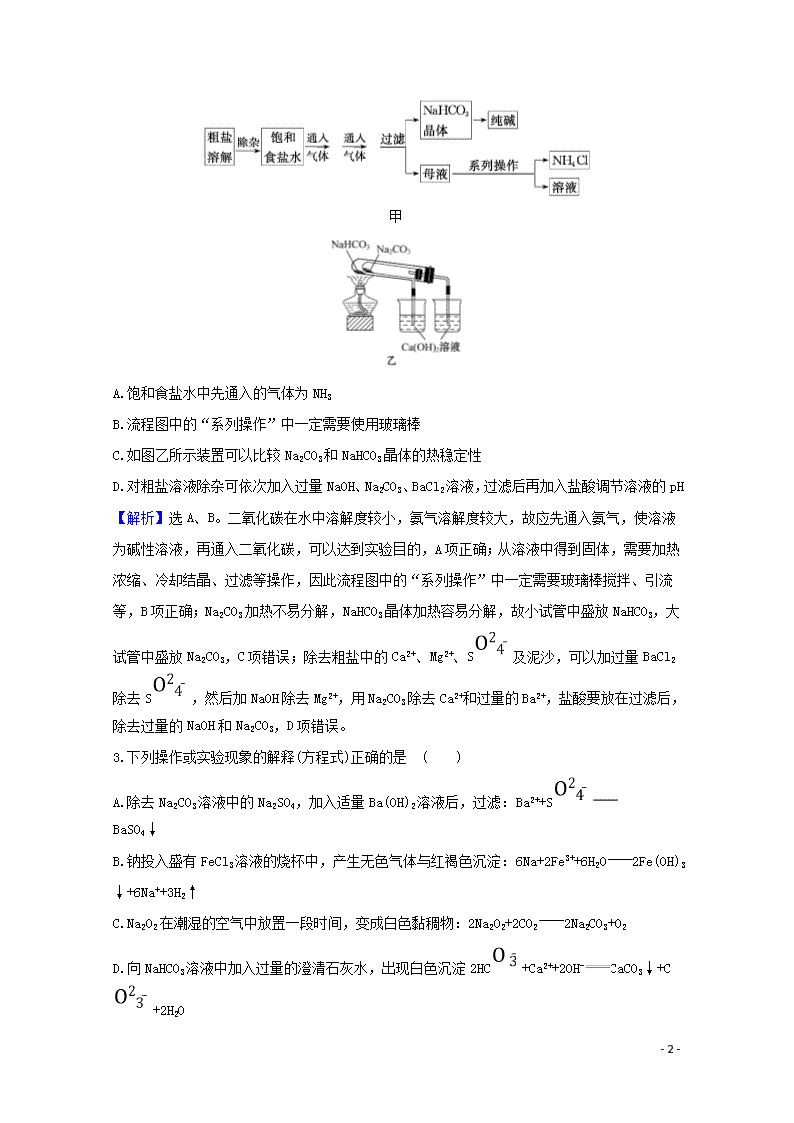
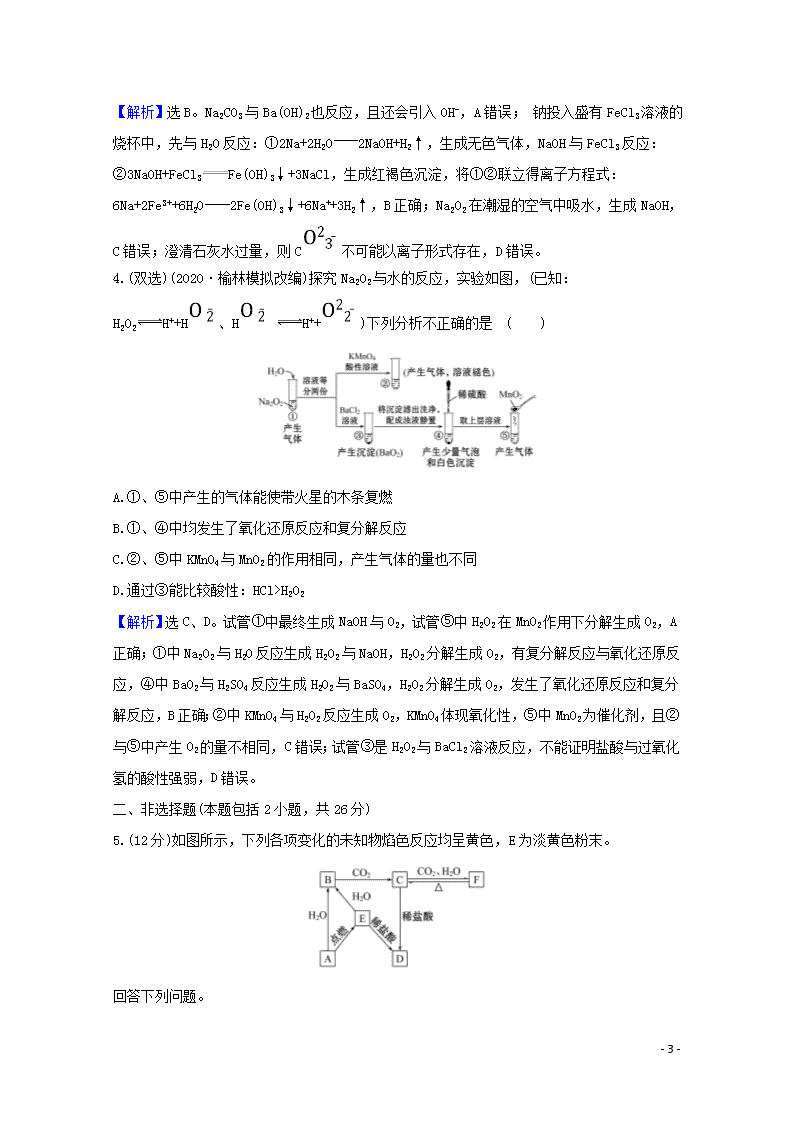
钠及其化合物 一、选择题(本题包括4小题,每题6分,共24分) 1.碱金属及其化合物在生活和化工生产中具有广泛的用途,下列说法正确的 是 ( ) A.钠-钾合金能用作原子反应堆的导热剂是由于二者是活泼金属易失去电子 B.用饱和碳酸氢钠制造灭火剂比用饱和碳酸钠制造灭火剂的效果好 C.碳酸钠可用于制造洗涤剂,因为碳酸钠是碱 D.五彩缤纷的焰火是K单质燃烧所致 【解析】选B。钠-钾合金能用作原子反应堆的导热剂是因为其具有良好的导热性,利用了二者的物理性质,A错误;相同质量的碳酸氢钠和碳酸钠中碳酸氢钠反应放出的气体更多,且反应的速率更快,故用饱和碳酸氢钠制造灭火剂的效果好,B正确;碳酸钠是盐,不是碱,C错误;五彩缤纷的焰火是金属元素的焰色反应所致,不一定是单质燃烧所致,也不一定是钾元素所致,D错误。 【加固训练】 利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是 ( ) A.非金属单质燃烧时火焰均为无色 B.NaCl与Na2CO3灼烧时火焰颜色相同 C.焰色反应均应透过蓝色钴玻璃观察 D.只有金属单质灼烧时火焰才有颜色 【解析】选B。氢气在氧气中燃烧发出淡蓝色火焰,A错误;NaCl与Na2CO3灼烧时均表现为钠元素的焰色,均为黄色,B正确;只有钾元素的焰色反应需要透过蓝色钴玻璃观察,以避免钠元素的干扰,C错误;焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征颜色的反应,很多非金属单质燃烧时火焰也会有颜色,D错误。 2.(双选)(2020·永州模拟改编)工业上以粗盐(含Ca2+、Mg2+、S等杂质)为主要原料,采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如图甲所示。下列说法正确的是 ( ) - 8 - 甲 A.饱和食盐水中先通入的气体为NH3 B.流程图中的“系列操作”中一定需要使用玻璃棒 C.如图乙所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 D.对粗盐溶液除杂可依次加入过量NaOH、Na2CO3、BaCl2溶液,过滤后再加入盐酸调节溶液的pH 【解析】选A、B。二氧化碳在水中溶解度较小,氨气溶解度较大,故应先通入氨气,使溶液为碱性溶液,再通入二氧化碳,可以达到实验目的,A项正确;从溶液中得到固体,需要加热浓缩、冷却结晶、过滤等操作,因此流程图中的“系列操作”中一定需要玻璃棒搅拌、引流等,B项正确; Na2CO3加热不易分解,NaHCO3晶体加热容易分解,故小试管中盛放NaHCO3,大试管中盛放Na2CO3,C项错误;除去粗盐中的Ca2+、Mg2+、S及泥沙,可以加过量BaCl2除去S,然后加NaOH除去Mg2+,用Na2CO3除去Ca2+和过量的Ba2+,盐酸要放在过滤后,除去过量的NaOH和Na2CO3,D项错误。 3.下列操作或实验现象的解释(方程式)正确的是 ( ) A.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,过滤:Ba2++S BaSO4↓ B.钠投入盛有FeCl3溶液的烧杯中,产生无色气体与红褐色沉淀:6Na+2Fe3++6H2O2Fe(OH)3↓+6Na++3H2↑ C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO22Na2CO3+O2 D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HC+Ca2++2OH-CaCO3↓+C+2H2O - 8 - 【解析】选B。Na2CO3与Ba(OH)2也反应,且还会引入OH-,A错误; 钠投入盛有FeCl3溶液的烧杯中,先与H2O反应:①2Na+2H2O2NaOH+H2↑,生成无色气体,NaOH与FeCl3反应:②3NaOH+FeCl3Fe(OH)3↓+3NaCl,生成红褐色沉淀,将①②联立得离子方程式:6Na+2Fe3++6H2O2Fe(OH)3↓+6Na++3H2↑,B正确;Na2O2在潮湿的空气中吸水,生成NaOH,C错误;澄清石灰水过量,则C不可能以离子形式存在,D错误。 4.(双选)(2020·榆林模拟改编)探究Na2O2与水的反应,实验如图,(已知:H2O2H++H、H H++)下列分析不正确的是 ( ) A.①、⑤中产生的气体能使带火星的木条复燃 B.①、④中均发生了氧化还原反应和复分解反应 C.②、⑤中KMnO4与MnO2的作用相同,产生气体的量也不同 D.通过③能比较酸性:HCl>H2O2 【解析】选C、D。试管①中最终生成NaOH与O2,试管⑤中H2O2在MnO2作用下分解生成O2,A正确;①中Na2O2与H2O反应生成H2O2与NaOH,H2O2分解生成O2,有复分解反应与氧化还原反应,④中BaO2与H2SO4反应生成H2O2与BaSO4,H2O2分解生成O2,发生了氧化还原反应和复分解反应,B正确;②中KMnO4与H2O2反应生成O2,KMnO4体现氧化性,⑤中MnO2为催化剂,且②与⑤中产生O2的量不相同,C错误;试管③是H2O2与BaCl2溶液反应,不能证明盐酸与过氧化氢的酸性强弱,D错误。 二、非选择题(本题包括2小题,共26分) 5.(12分)如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末。 回答下列问题。 - 8 - (1)写出A→B的化学方程式,___________________。 (2)写出C→D的离子方程式_____________________。 (3)在B→C的变化中,所得C的溶液往往不纯,其中的杂质(不包括水)可能是__________,主要原因是__ ___________________; 还可能是______________________, 主要原因是_______________________。 【解析】由于物质的焰色反应均呈黄色,从而确定各物质中均含有钠元素。又由于E为淡黄色粉末从而确定E为Na2O2。然后根据框图关系,可知A为Na,B为NaOH,C为Na2CO3,D为NaCl,F为NaHCO3。 答案:(1)2Na+2H2O2NaOH+H2↑ (2)C+2H+CO2↑+H2O (3)NaOH 通入CO2的量不足 NaHCO3 通入的CO2过量 6.(14分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。 (1)加热前通入空气的目的是____________________________。 (2)装置C、D中盛放的试剂为C________,D________。 (3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将__________(填“偏高”“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中 NaHCO3的含量将__________;若撤去E装置,则测得Na2CO3·10H2O的含量将__________。 (4)若样品的质量为25.0 g,反应后C、D的质量差分别为 9.9 g 、2.2 g,由此可知混合物中NaHCO3的质量分数为__________。 【解析】(1) Na2CO3·10H2O可通过H2O的量确定,NaHCO3可通过CO2的量确定,故必须先把装置中的水蒸气和二氧化碳排出去,防止干扰实验。 (2)C装置是吸收水的装置,所以应该盛放吸水的物质,浓硫酸是液体,一般U形管盛放固体,所以C中盛放无水氯化钙(或P2O5等);碱石灰能吸收二氧化碳,D装置可盛放碱石灰。 - 8 - (3)若将A装置换成盛放NaOH溶液的洗气瓶,氢氧化钠溶液中的部分水蒸气进入C装置中,导致水的含量增大,则测得氯化钠的含量偏低;因NaHCO3的含量由D吸收的CO2测定,则B中反应管右侧有水蒸气冷凝,对D吸收CO2无影响,测定结果中NaHCO3的含量无影响;若撤去E装置,则测定结果中NaHCO3的含量偏高,导致Na2CO3·10H2O的含量偏低。 (4)C吸收的是水,是Na2CO3·10H2O和NaHCO3分解得到,D吸收的是CO2,是NaHCO3分解得到,故通过2.2 g CO2可知NaHCO3为8.4 g,则混合物中NaHCO3的质量分数为×100%=33.6%。 答案:(1)除去装置中的水蒸气和二氧化碳 (2)CaCl2(或P2O5等) 碱石灰 (3)偏低 无影响 偏低 (4)33.6% 一、选择题(本题包括3小题,每题6分,共18分) 1.(双选)(2020·衡水模拟改编)某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( ) A.黑色固体是Na2O2 B.钠在燃烧时只发生了一个反应 C.钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO22MgO+C) D.钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳 【解析】选A、B。Na2O2是淡黄色固体,A不合理;钠及其化合物没有黑色的,所以黑色物质所含元素只能来自煤油或空气,所以选项B不合理。 2.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是 ( ) - 8 - 【解析】选C。滴加盐酸先发生反应OH-+H+H2O,再发生反应C+H+HC,最后发生反应:HC+H+CO2↑+H2O;因n(OH-)=n(C)=0.01 mol,故加入 0.02 mol HCl后开始有气体生成,C正确。 3.(2020·厦门模拟)如图是Na2O2和CO2定性、定量实验的装置示意图。注射器1中抽取了100 mL CO2,U形管中装有适量玻璃珠和约1.5 g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U形管中,注射器2活塞缓缓向外移动。下列叙述中不正确的是( ) A.U形管内的玻璃珠可防止过氧化钠粉末被吹和增大过氧化钠和二氧化碳的接触面积 B.U形管内淡黄色粉末渐渐变白 C.注射器1活塞推到底后,注射器2中收集到的气体大于50 mL,只是因为还含有CO2 D.打开胶塞,立即将带火星的木条伸入U形管中,可验证反应产物之一为氧气 【解析】选C。玻璃珠可起到增大Na2O2与CO2接触面积、使之反应完全的作用,A正确;U形管中Na2O2与CO2反应生成Na2CO3和O2,故U形管内淡黄色粉末渐渐变白,B正确;由2Na2O2+2CO22Na2CO3+O2可知,100 mL CO2理论上应产生50 mL O2,收集到的气体大于50 mL,除部分CO2没反应外,还可能是反应放热,气体受热膨胀,C错误;可利用O2支持燃烧、能使带火星的木条复燃的性质证明,D正确。 二、非选择题(本题包括2小题,共32分) - 8 - 4.(16分)(2020·海口模拟)锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题: (1)用碳酸锂和________反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为___________。 (2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是 _______。 (3)硬脂酸锂是锂肥皂的主要成分,可作为高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是 __________。 (4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF5和________________。 【解析】(1)碳酸锂与盐酸反应可制备氯化锂,根据电解原理,阴极上发生还原反应,得到电子,电极反应式为Li++e-Li。 (2)根据元素周期表中对角线规则,Li和Mg的性质相似,Mg能在CO2中燃烧,Mg与CO2反应生成MgO和C,则锂也能与CO2反应,因此不能用CO2灭火。 (3)阳离子不同,因此采用焰色反应进行鉴别。 (4)LiPF6中Li显+1价,P显+5价,F显-1价,PF5中P显+5价,F显-1价,因此LiPF6分解不属于氧化还原反应,根据原子守恒,另一种产物中含有Li和F,即另一种产物是LiF。 答案:(1)盐酸 Li++e-Li (2)金属锂在CO2中仍可燃烧 (3)分别取样品进行焰色反应,锂盐焰色为深红色,钠盐焰色为黄色,钾盐焰色为紫色(透过蓝色钴玻璃) (4)LiF 5.(16分)(2020·榆林模拟)化学兴趣小组同学想用金属钠和空气制备纯度较高的Na2O2(N2不与金属钠反应),可利用的装置如下。回答下列问题: (1)装置Ⅳ中盛放的药品是________,若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为__ ___________________。 (2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:空气进入h, ________接________,________接________,________接________,d。 (3)装置Ⅱ的作用是____________。 - 8 - (4)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。 ①使酚酞溶液变红是因为_____________________,红色褪去的可能原因是___________________。 ②加入MnO2反应的化学方程式为 __________________。 【解析】(1)装置Ⅳ是利用NaOH溶液除去空气中的CO2,若没有该装置,空气中的CO2和Na2O2反应会生成Na2CO3。 (2)组合实验装置时各仪器的正确连接顺序为Ⅳ、Ⅲ、Ⅰ、Ⅱ。 (3)利用装置Ⅱ中的碱石灰防止空气中的水分和二氧化碳进入装置Ⅰ。 (4)①过氧化钠和水反应生成的氢氧化钠是碱,碱使酚酞变红;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性,能氧化有色物质。 ②过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气。 答案:(1)NaOH溶液 2Na2O2+2CO22Na2CO3+O2 (2)g f e a b c (3)防止空气中的水蒸气和二氧化碳进入装置Ⅰ (4)①过氧化钠和水反应生成氢氧化钠 反应生成的H2O2具有漂白作用 ②2H2O22H2O+O2↑ - 8 -查看更多