- 2021-07-02 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
离子键(教案,必修)
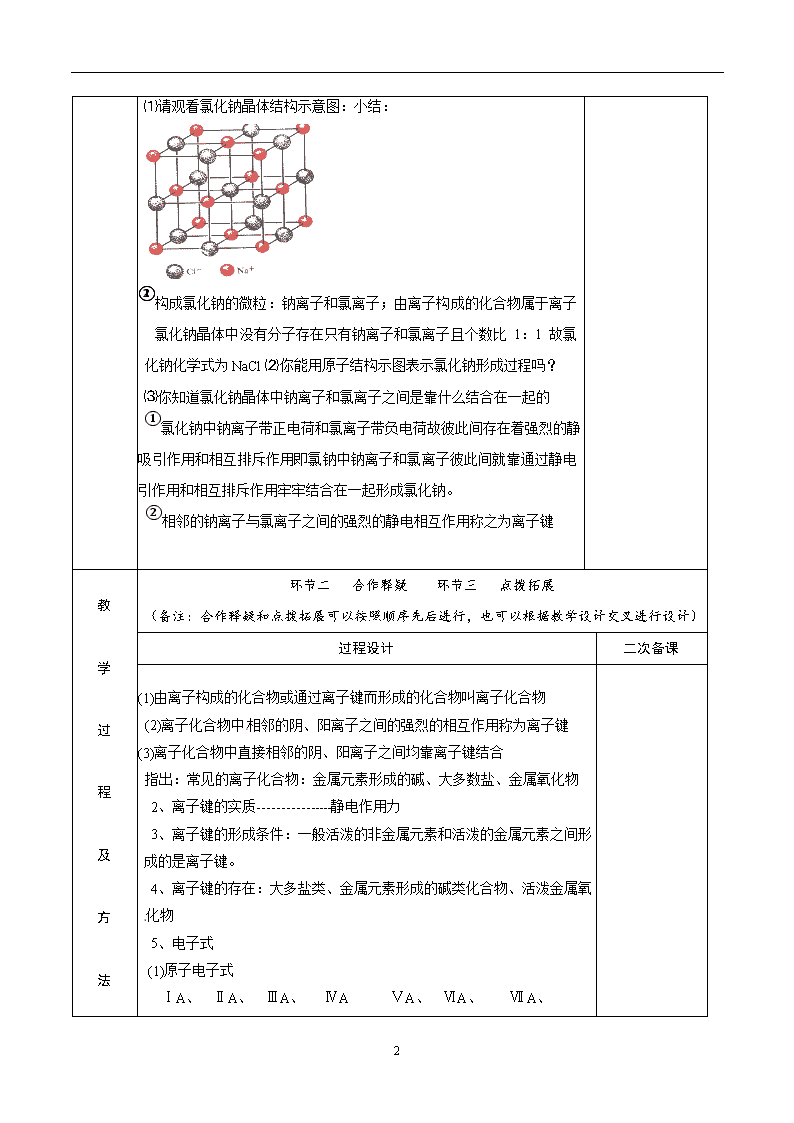
年级 组别 高一化学 审阅 (备课组长) 审阅 (学科校长) 主备人 使用人 授课时间[ 课 题 苏教版化学必修二专题一第二单元离子键 课 型 新授课 课标 要求 1. 理解化学键的定义 2. 初步理解和掌握离子键的概念,本质,形成过程,形成条件 3. 学会书写常见原子、离子、分子、离子化合物的电子式,能够用电子式表示常见的简单的离子化合物、共价分子的形成过程。 教 学 目 标 知识与能力 理解和掌握离子键的概念,本质,形成过程和条件,并熟练运用电子式 过程与方法 学会从氯化钠和氧化镁形成过程得出离子键的概念,形成条件 情感、态度与价值观 通过小组讨论和交流,对离子键形成理解更透彻,促进对化学学习兴趣 教学 重点 理解离子键、离子化合物的概念 教学 难点 离子化合物电子式书写 教学 方法 三学一教 教学程序设计 教 学 过 程 及 方 法 环节一 明标自学 过程设计 二次备课 Ⅰ、引入 通过前面学习我们掌握了原子结构、元素周期律、元素周期表的知识,大家是否思考过水、金刚石、氯化钠这些物质各由什么微粒构成的?构成物质的微粒之间又靠什么牢牢结合在一起的? Ⅱ、新知 $2-1-2 微粒之间的相互作用力 一、 离子键 1、定义 以氯化钠为例 4 ⑴请观看氯化钠晶体结构示意图:小结: ①构成氯化钠的微粒:钠离子和氯离子;由离子构成的化合物属于离子化合物②氯化钠晶体中没有分子存在只有钠离子和氯离子且个数比 1:1 故氯化钠化 化钠化学式为NaCl ⑵你能用原子结构示图表示氯化钠形成过程吗? ⑶你知道氯化钠晶体中钠离子和氯离子之间是靠什么结合在一起的 小结: ①氯化钠中钠离子带正电荷和氯离子带负电荷故彼此间存在着强烈的静电相互吸引作用和相互排斥作用即氯钠中钠离子和氯离子彼此间就靠通过静电相互吸引作用和相互排斥作用牢牢结合在一起形成氯化钠。 ②相邻的钠离子与氯离子之间的强烈的静电相互作用称之为离子键 教 学 过 程 及 方 法 环节二 合作释疑 环节三 点拨拓展 (备注:合作释疑和点拨拓展可以按照顺序先后进行,也可以根据教学设计交叉进行设计) 过程设计 二次备课 (1)由离子构成的化合物或通过离子键而形成的化合物叫离子化合物 (2)离子化合物中相邻的阴、阳离子之间的强烈的相互作用称为离子键 (3)离子化合物中直接相邻的阴、阳离子之间均靠离子键结合 指出:常见的离子化合物:金属元素形成的碱、大多数盐、金属氧化物 2、离子键的实质----------------静电作用力 3、离子键的形成条件:一般活泼的非金属元素和活泼的金属元素之间形成的是离子键。 4、离子键的存在:大多盐类、金属元素形成的碱类化合物、活泼金属氧化物 5、电子式 (1)原子电子式 ⅠA、 ⅡA、 ⅢA、 ⅣA ⅤA、 ⅥA、 Ⅶ A、 4 (2)离子电子式 ①简单金属离子------------就是其离子符号 ②简单阴离子Cl- ③复杂阴离子OH - · · [ ∶O∶H]- 指出:注意 电荷数、中括号、最外层电子 ·· ④NH4+ H3O+ (3)离子化合物电子式-----由阴、阳离子电子式组成的。 注意:同种离子不得合并,应对称放好 如MgO ·· Mg2+[∶O∶] 2- ·· MgCl2 ·· ·· [∶Cl∶]-Mg2+[∶Cl∶]- ·· ·· Na2O ·· Na +[∶O∶] 2- Na+ ·· 指出:阴离子及复杂的阳离子的电子式要加一个中括号并标出离子的负电荷数; 教 学 过 程 及 方 环节四 当堂检测 二次备课 4 法 1、下列关于化学用语NH4Cl的意义,不正确的是---( ) A、氯化铵分子中含有一个NH4+和一个Cl- B、氯化铵由N、H、Cl三种元素组成 C、氯化铵晶体由NH4+和Cl-组成 D、氯化铵晶体中阴、阳离子个数比1:1 2、氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水反应可产生氨气。请回答: (1) Na3N的电子式 ,该化合物是由 键形成的。 (2) Na3N与盐酸反应生成 种盐,其电子式是 (3) Na3N与水反应属于 反应。 (4)比较Na3N中两种微粒的半径 课堂 小结 1、离子键 概念 2、离子键的实质是什么? 3、离子键形成的条件是什么? 4、电子式及其应用 课后 作业 同步练习例1,例2 板 书 设 计 1. 离子键的概念 2. 离子键的形成条件 3. 电子式及其应用 4. 离子键形成的条件 课 后 反 思 4查看更多