- 2021-07-02 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习鲁科版专题六原子结构化学键考点二化学键及分子间作用力学案
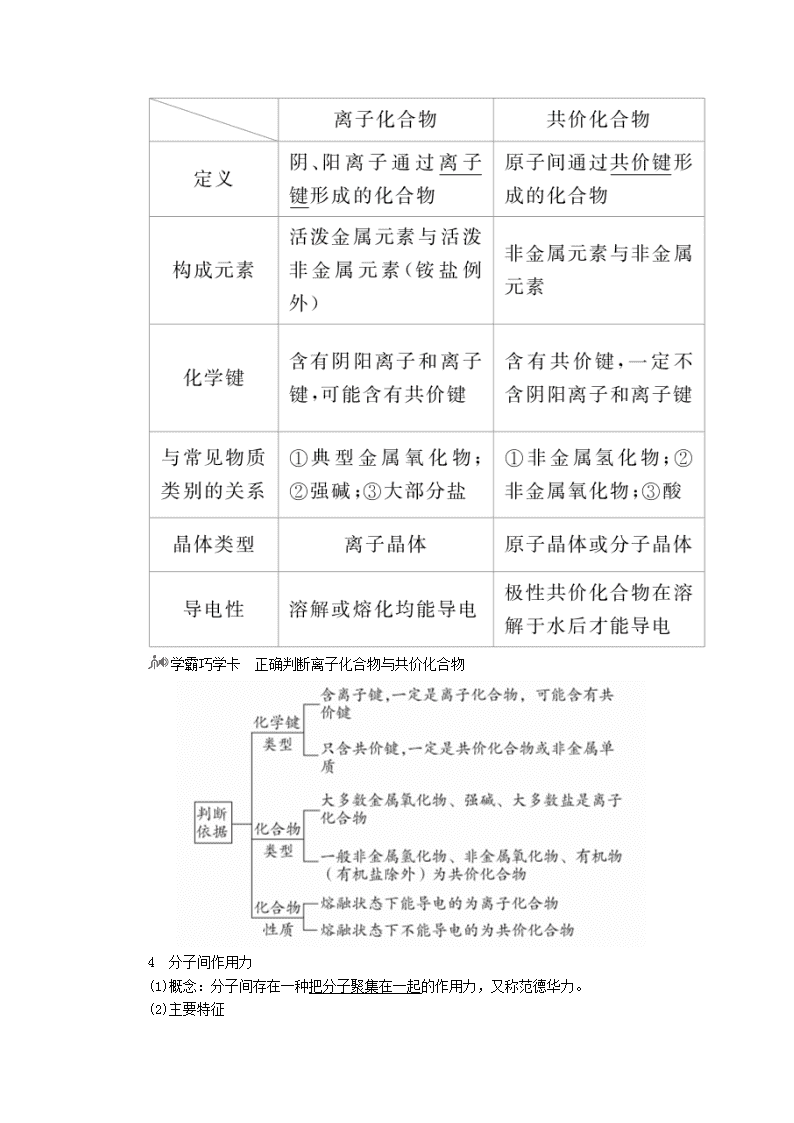
1 化学键 (1)定义 使离子相结合或原子相结合的作用力通称为化学键。即相邻原子(或离子)之间强烈的相互作用。 (2)分类 化学键 2 离子键与共价键 3 离子化合物与共价化合物 学霸巧学卡 正确判断离子化合物与共价化合物 4 分子间作用力 (1)概念:分子间存在一种把分子聚集在一起的作用力,又称范德华力。 (2)主要特征 ①分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。 ②只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。 ③分子间作用力的能量远远小于化学键。 ④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。 (3)变化规律 一般来说,对于组成与结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。 例如,熔、沸点:I2>Br2>Cl2>F2。 5 氢键 (1)定义:分子间存在的一种比分子间作用力稍强的相互作用。 (2)氢键的形成条件:分子中具有H—F、H—O、H—N等结构条件的分子间才能形成氢键。氢键不属于化学键,其强度比化学键弱得多,但它比分子间作用力稍强,通常把氢键看作是一种较强的分子间作用力。 (3)氢键对物质物理性质的影响:氢键的形成加强了分子间作用力,使物质的熔沸点升高,如HF、H2O、NH3的沸点都比它们各自同族元素的氢化物高。又如乙醇的沸点也比乙烷的沸点高出很多。此外,如NH3、C2H5OH、CH3COOH,由于它们能与水形成氢键,使得它们在水中的溶解度较其他同类物质大。 1.思维辨析 (1)形成离子键的阴、阳离子间只存在静电吸引力。( ) (2)全部由非金属元素形成的化合物一定是共价化合物。( ) (3)某些金属与非金属原子间能形成共价键。( ) (4)H2O的稳定性大于H2S,是因为H2O分子间存在氢键,H2S分子间只有范德华力。( ) (5)共价化合物中都存在分子间作用力。( ) (6)F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力逐渐增大。( ) (7)HF、HCl、HBr、HI的稳定性逐渐减弱,其熔沸点逐渐升高。( ) 答案 (1)× (2)× (3)√ (4)× (5)× (6)√ (7)× 2.下列各组物质中都既含有离子键又含有共价键的是( ) A.NaOH、H2O、NH4Cl B.KOH、Na2O2、(NH4)2S C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2 答案 B 解析 既含有离子键又含有共价键的化合物肯定是离子化合物。只含有共价键的是H2O、HCl,排除A、D项;只含有离子键的是MgO、CaBr2、NaCl、MgCl2,排除C、D项;既含有离子键又含有共价键的是NaOH、NH4Cl、KOH、Na2O2、(NH4)2S、Na2SO4。 [考法综述] 高考对本考点的考查除了要掌握基本的化学概念外,主要是结合元素化合物知识对化学键及化合物类型的判断和对常见物质的化学用语的考查,属中等难度。 命题法1 化学键与物质类别 典例1 下列关于化学键的叙述,正确的一项是( ) A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C.含有极性键的分子一定是极性分子 D.含有共价键的化合物一定是共价化合物 [解析] 离子化合物中一定含有离子键,A正确;只有单原子单质分子中不存在化学键,B错误;CO2分子含有极性键,但CO2是非极性分子,C错误;NaOH等离子化合物含有离子键和共价键,是离子化合物,不是共价化合物,D错误。 [答案] A 【解题法】 化学键与物质类别的关系 除稀有气体内部无化学键外,其他物质内部都存在化学键。化学键与物质的类别之间的关系可概括为: (1)只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。 (2)只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。 (3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。 (4)只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。 (5)既有离子键又有极性共价键的物质,如NaOH、K2SO4、NH4Cl等;既有离子键又有非极性共价键的物质,如Na2O2等;由离子键、极性共价键、非极性共价键共同构成的物质,如CH3COONa等。 图示如下: 命题法2 常见微粒的化学用语的判断 典例2 氯水中存在多种微粒,下列有关粒子的表示方法正确的是( ) A.氯气的电子式:ClCl B.氢氧根离子的电子式:H C.次氯酸分子的结构式:H—O—Cl D.HClO的电子式:HO [解析] A项,氯气的电子式为,故A错;B项,氢氧根离子的电子式为[H]-,故B错;D项,HClO的电子式为H,故D错。 [答案] C 【解题法】 电子式书写易错总结 (1)漏写孤电子对 (4)根、基电子式混淆不清 如OH-的电子式应为[H]-,易误写成H。 (5)原子结合顺序写错 如HClO的电子式应为H,易误写成H。 (6)错误使用括号 如HCl的电子式应为H,易误写成H+[]-。 (7)误将电荷数标成化合价 如Na2O的电子式应为Na+[]2-Na+,易误写成Na+[]-2Na+。 (8)“”或“×”使用混乱 如H2S的电子式应为HH,易误写成HH。 (9)复杂阳离子与简单阳离子混淆不淆 ①如Na+的电子式应为Na+,易误写成[]+。 命题法3 8e-稳定结构的判断 典例3 下列物质中所有原子均满足最外层8电子稳定结构的化合物是( ) A.PCl5 B.P4 C.CCl4 D.NH3 [解析] 判断原子满足最外层8电子结构的方法为最外层电子数+|化合价|=8,A、D项错误;P4为单质,而非化合物,B项错误;CCl4中5个原子最外层均为8电子稳定结构,C项正确。 [答案] C 【解题法】 8e-稳定结构的判断方法 (1)特殊排除法 若分子中含有H、B、Be等元素,一定不满足8电子稳定结构,要学会运用这一规律迅速判断。 (2)经验规律法 凡符合最外层电子数+|化合价|=8的元素的原子皆为8电子结构。 (3)试写电子式、结构式法 判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H2O,氧原子最外层有6个电子,H2O中每个氧原子又与两个氢原子形成两个共价键,所以H2O中的氧原子最外层有6+2=8个电子,但H2O中的氢原子最外层有2个电子;②N2,氮原子最外层有5个电子,N与N之间形成三个共价键,所以N2中的氮原子最外层达到8电子稳定结构。 1.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( ) A.元素的非金属性次序为c>b>a B.a和其他3种元素均能形成共价化合物 C.d和其他3种元素均能形成离子化合物 D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 答案 B 解析 H-与He的电子层结构相同,所以a为H;b、c的次外层电子数为8,最外层电子数分别为6、7,所以b、c分别为S和Cl;Cl-与K+的电子层结构相同,所以d为K。非金属性强弱顺序为Cl>S>H,A项正确;H2S、HCl为共价化合物,KH为离子化合物,B项错误;KH、K2S、KCl均为离子化合物,C项正确;最高化合价和最低化合价分别是:H为+1和-1,代数和为0,S为+6和-2,代数和为4,Cl为+7和-1,代数和为6,D项正确。 2. 碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图。下列有关该物质的说法正确的是( ) A.分子式为C3H2O3 B.分子中含6个σ键 C.分子中只有极性键 D.8.6 g该物质完全燃烧得到6.72 L CO2 答案 A 解析 A项正确,碳酸亚乙烯酯的分子式为C3H2O3;B项错误,该分子中有5个σC—O键、2个σC—H键、1个σC—C键,共8个σ键;C项错误,该分子中的碳碳双键为非极性键;D项错误,应用气体摩尔体积进行计算,气体需在标准状况下测定体积,6.72 L CO2存在状态没标明。 3.下列有关化学用语表示正确的是( ) A.过氧化钠的电子式:Na Na B.质子数为35、中子数为45的溴原子:Br C.硫离子的结构示意图: D.间二甲苯的结构简式: 答案 B 解析 过氧化钠的电子式:Na+[ ]2-Na+,A项错误;S2-的结构示意图为,C项错误;间二甲苯的结构简式为,D项错误。 4.CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应: 下列有关三聚氰酸的说法正确的是( ) A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键 C.属于共价化合物 D.生成该物质的上述反应为中和反应 答案 C 解析 三聚氰酸的分子式应为C3H3N3O3,A项错误;三聚氰酸分子中只含有极性共价键,属于共价化合物,则B项错误,C项正确;中和反应是酸和碱反应生成盐和水的反应,题中反应不符合此概念,D项错误。 5.(双选)下列化合物中,含有非极性共价键的离子化合物是( ) A.CaC2 B.N2H4 C.Na2S2 D.NH4NO3 答案 AC 解析 A项,CaC2为离子化合物,C中,C、C之间为非极性共价键;B项,N2H4为共价化合物;C项,Na2S2为离子化合物,S中S、S之间为非极性共价键;D项,NH4NO3为离子化合物,但不含非极性共价键。 6.关于化学键的各种叙述正确的是( ) A.在离子化合物里,只存在离子键,没有共价键 B.只由共价键形成的物质,不一定是共价化合物 C.非极性键只存在于双原子的单质分子中 D.由不同元素组成的多原子分子里,一定只存在极性键 答案 B 解析 A选项,由离子化合物NH4Cl可知错误;由H2、O2等单质可知B选项正确;由H2O2、Na2O2、C2H6可知C、D选项错误。 7.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。 (1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。 (2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________(已知该反应为置换反应)。 (3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,K的原子结构示意图为________。 (4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为________________________________________ ________________________________。 答案 (1)N⋮⋮N (2)Fe (3)离子键和共价键 (4)2NaHCO3Na2CO3+CO2↑+H2O 解析 (1)两个N原子之间形成3对共价键,其电子式为N⋮⋮N。 (2)Fe2O3与Na反应时,Na为还原剂,被氧化为Na2O,Fe2O3为氧化剂,被还原为Fe,故还原产物为Fe。 (3) KClO4中,K+与ClO之间以离子键结合,ClO中Cl原子与O原子之间以共价键结合,所以KClO4中既含有离子键又含有共价键。K的核电荷数为19,其原子结构示意图为。 (4)NaHCO3受热分解生成Na2CO3、CO2、H2O,反应方程式为2NaHCO3Na2CO3+CO2↑+H2O。 8.已知: 化合物 MgO Al2O3 MgCl2 AlCl3 类型 离子化合物 离子化合物 离子化合物 共价化合物 熔点/℃ 2800 2050 714 191 工业制镁时,电解MgCl2而不电解MgO的原因是____________________;制铝时,电解Al2O3而不电解AlCl3的原因是_______________________________________________________。 答案 MgO的熔点高,熔融时耗费更多能源,增加生产成本 AlCl3是共价化合物,熔融态难导电 解析 MgCl2、MgO均为离子化合物,且MgCl2熔点低,容易熔化;AlCl3是共价化合物,熔融状态下不导电,只能用Al2O3。 下列有关氯元素及其化合物的表示正确的是( ) A.质子数为17、中子数为20的氯原子:Cl B.氯离子(Cl-)的结构示意图: C.氯分子的电子式: D.氯乙烯分子的结构简式:H3C—CH2Cl [错解] B或D [错因分析] 不清楚各种化学用语的含义和表示方法,会导致错解。不清楚原子表示方法中各数字的含义,会错选A;不了解原子结构示意图和离子结构示意图的区别,会错选B;不熟悉有机物的命名,会错选D。 [解析] A项,符号X中,A代表质量数,Z代表质子数,题中氯原子的质量数=17+20=37,故该氯原子应表示为Cl,错误;B项,氯离子的最外层电子数应为8,错误;D项,氯乙烯分子中应存在碳碳双键,其结构简式应为CH2===CHCl,错误。 [答案] C [心得体会]查看更多