2019届二轮复习化学平衡的移动作业(全国通用)
化学平衡的移动
1.下列事实不能用平衡移动原理解释的是( )
A.蒸干AlCl3溶液,无法得到无水AlCl3
B.用稀H2SO4洗涤BaSO4沉淀,可减少沉淀损失量
C.氯水中加入少量CaCO3粉末,可以提高漂白能力
D.滴加CuSO4溶液可以加快Zn与稀H2SO4反应的速率
2.已知:xA(g)+yB(g) zC(g) ΔH=a kJ·mol-1。将x mol A和y mol B充入密闭容器中,在不同温度(T1>T2)及压强(p1>p2)下,C的物质的量与反应时间的关系如图所示。下列判断正确的是 ( )
A.x+y=z;a>0 B.x+y>z;a<0
C.x+y
0
3.(2017北京朝阳一模,11)探究浓度对化学平衡的影响,实验如下:
Ⅰ.向5 mL 0.05 mol/L FeCl3溶液中加入5 mL 0.05 mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份中加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份中加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法的是( )
A.反应a为:2Fe3++2I- 2Fe2++I2
B.Ⅱ中,反应a进行的程度大于反应b
C.比较氧化性:Ⅱ中,I2>Fe3+
D.比较水溶液中c(Fe2+):Ⅱ<Ⅲ
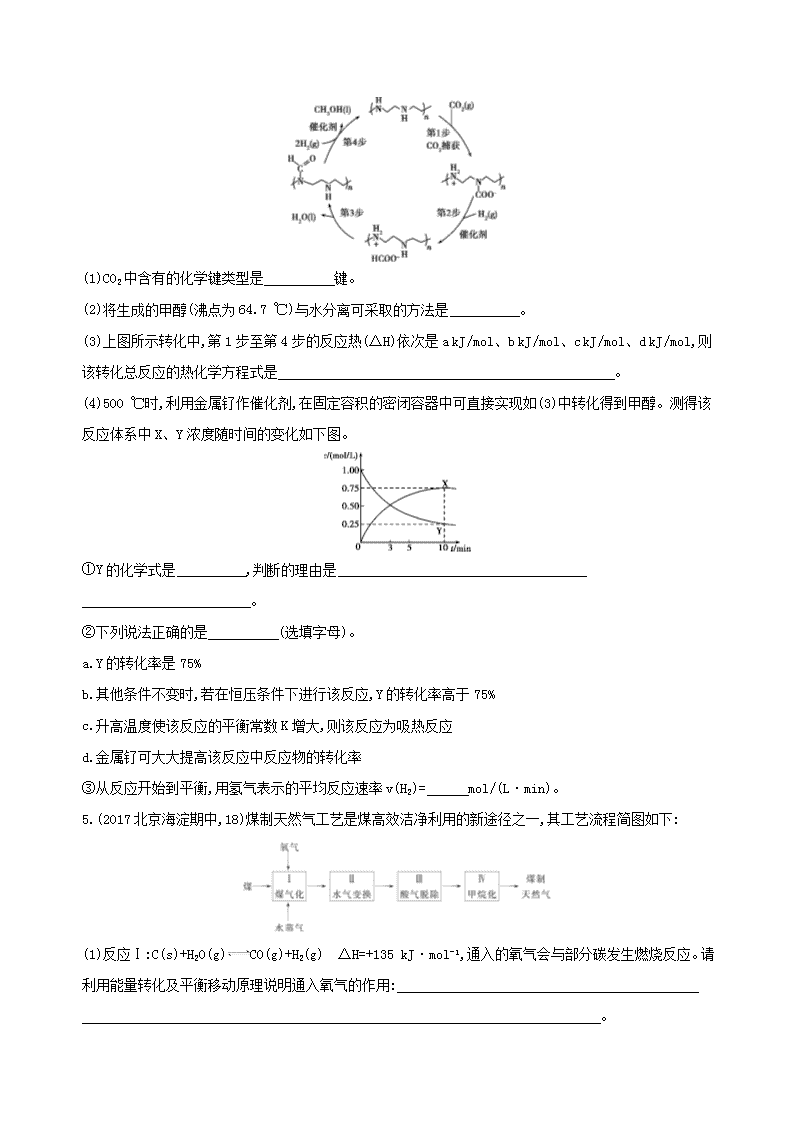
4.诺贝尔化学奖得主乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
(1)CO2中含有的化学键类型是 键。
(2)将生成的甲醇(沸点为64.7 ℃)与水分离可采取的方法是 。
(3)上图所示转化中,第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是 。
(4)500 ℃时,利用金属钌作催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间的变化如下图。
①Y的化学式是 ,判断的理由是 。
②下列说法正确的是 (选填字母)。
a.Y的转化率是75%
b.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75%
c.升高温度使该反应的平衡常数K增大,则该反应为吸热反应
d.金属钌可大大提高该反应中反应物的转化率
③从反应开始到平衡,用氢气表示的平均反应速率v(H2)= mol/(L·min)。
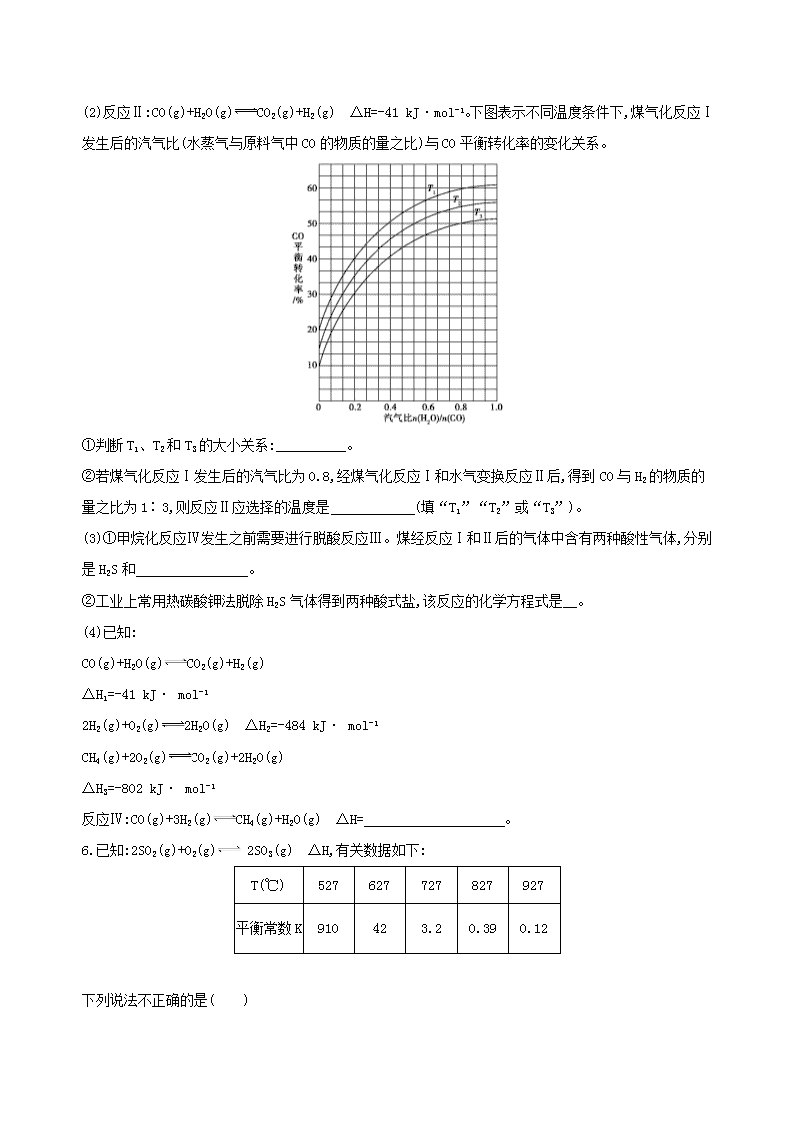
5.(2017北京海淀期中,18)煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简图如下:
(1)反应Ⅰ:C(s)+H2O(g)CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用: 。
(2)反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ·mol-1。下图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与原料气中CO的物质的量之比)与CO平衡转化率的变化关系。
①判断T1、T2和T3的大小关系: 。
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是 (填“T1”“T2”或“T3”)。
(3)①甲烷化反应Ⅳ发生之前需要进行脱酸反应Ⅲ。煤经反应Ⅰ和Ⅱ后的气体中含有两种酸性气体,分别是H2S和 。
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 。
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)
ΔH1=-41 kJ· mol-1
2H2(g)+O2(g)2H2O(g) ΔH2=-484 kJ· mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(g)
ΔH3=-802 kJ· mol-1
反应Ⅳ:CO(g)+3H2(g)CH4(g)+H2O(g) ΔH= 。
6.已知:2SO2(g)+O2(g) 2SO3(g) ΔH,有关数据如下:
T(℃)
527
627
727
827
927
平衡常数K
910
42
3.2
0.39
0.12
下列说法不正确的是( )
A.根据平衡常数随温度的变化关系,判断出ΔH<0
B.保持其他条件不变,SO2的平衡转化率α(727 ℃)<α(927 ℃)
C.增大压强、降低温度能提高SO2的转化率
D.SO3的稳定性随温度的升高而降低
7.某温度下,在一容积可变的密闭容器里,反应2A(g) B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入1 mol稀有气体氦(He),平衡将不发生移动
B.充入A、B、C各1 mol,平衡将向正反应方向移动
C.将A、B、C的物质的量都减半,C的百分含量不变
D.加入正催化剂,正、逆反应速率均加快,平衡向逆反应方向移动
8.(2017北京东城期末,16)CH4超干重整CO2技术可得到富含CO的气体,用于生产多种化工产品。该技术中的化学反应为:CH4(g)+3CO2(g) 2H2O(g)+4CO(g) ΔH=+330 kJ/mol。
(1)下图表示初始投料比n(CH4)∶n(CO2)为1∶3或1∶4时,CH4的转化率在不同温度(T1、T2)下与压强的关系。(注:投料比用a1、a2表示)
①a2= 。
②判断T1与T2的大小关系,并说明理由: 。
(2)CH4超干重整CO2的催化转化原理示意图如下:
①过程Ⅰ中生成1 mol H2时吸收123.5 kJ热量,其热化学方程式是 。
②过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是 。
③假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是 。(填序号)
a.过程Ⅰ和过程Ⅱ中均发生了氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料比=1,可导致过程Ⅱ中催化剂失效
9.五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s
0
50
150
250
350
n(PCl5)/mol
0
0.24
0.36
0.40
0.40
(1)0~150 s内的平均反应速率v(PCl3)= mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为 (可用分数表示)。
(3)反应至250 s 时,该反应放出的热量为 kJ。
(4)下列关于上述反应的说法中,正确的是 (填字母序号)。
a. 无论是否达平衡状态,混合气体的密度始终不变
b.300 s 时,升高温度,正、逆反应速率同时增大
c.350 s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始时向该密闭容器中充入1.0 mol PCl3和0.5 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
(5)温度T1时,混合气体中PCl5的体积分数随时间变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线。
答案精解精析
1.D 滴加CuSO4溶液可以加快Zn与稀H2SO4反应的速率是因为Zn和CuSO4溶液发生置换反应生成Cu,进而形成了Cu—Zn原电池,与平衡移动原理无关。
2.B 观察图像知,升高温度,n(C)减小,即平衡向逆反应方向移动,故a<0;增大压强,n(C)增大,即平衡向正反应方向移动,故x+y>z。
3.B A项,由实验Ⅱ可知,反应a为可逆反应,离子方程式为2Fe3++2I- 2Fe2++I2。B项,加入饱和KSCN溶液,溶液变红,则生成了较多的Fe(SCN)3;加入CCl4,振荡、静置,下层显极浅的紫色,则加入CCl4前的溶液中含有较少的I2,由此说明反应a进行的程度小于反应b。C项,Ⅱ中反应a的平衡逆向移动,则氧化性I2>Fe3+ 。D项,Ⅲ中反应a的平衡正向移动,Fe2+的浓度升高,Ⅱ中反应a的平衡逆向移动,Fe2+的浓度降低,所以水溶液中Fe2+的浓度:Ⅱ<Ⅲ。
4.答案 (1)极性共价
(2)蒸馏
(3)CO2(g)+3H2(g) CH3OH(l)+H2O(l)
ΔH=(a+b+c+d)kJ/mol
(4)①CO2 根据图像可知,Y为反应物,X为生成物,且相同时间内反应物减少量与生成物增加量相同,所以二者化学计量数相同
②abc
③0.225
解析 (1)CO2中含有的化学键类型为极性共价键。
(2)分离沸点相差较大的互溶液体,应采用蒸馏的方法。
(3)根据盖斯定律可得,CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=(a+b+c+d)kJ/mol。
(4)②a项,α=×100%=75%;b项,若在恒压条件下进行,相当于对原平衡加压,平衡正向移动,Y的转化率提高;c项,K与温度成正比,所以正反应为吸热反应;d项,催化剂不影响转化率。
③v(H2)=mol/(L·min)=0.225 mol/(L·min)。
5.答案 (1)氧气与碳发生燃烧反应放热,放出的热被可逆反应C(s)+H2O(g)CO(g)+H2(g)吸收利用,促使平衡正向移动
(2)①α(927 ℃);C项,对于反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,增大压强和降低温度都能使平衡正向移动,SO2的转化率增大;D项,升高温度,平衡逆向移动,说明SO3的稳定性随温度的升高而降低。
7.C A项,充入1 mol稀有气体氦(He),容器体积增大,平衡向正反应方向移动;B项,相当于在充入1 mol A、0.5 mol B和1 mol C的基础上再充入0.5 mol B,所以平衡将向逆反应方向移动;C项,减半后,A、B和C的物质的量分别为2 mol、1 mol、2 mol,在压强不变的条件下达到的平衡与原平衡等效,故C的百分含量不变;D项,加入正催化剂,正、逆反应速率均加快,但平衡不移动。
8.答案 (1)①1∶4 ②T2>T1;正反应为吸热反应,温度升高时甲烷的转化率增大
(2)①CH4(g)+CO2(g) 2CO(g)+2H2(g)
ΔH=+247 kJ/mol
②4H2+Fe3O4 3Fe+4H2O ③ac
解析 (1)①相同条件下,投料比越小,甲烷的转化率越大,故a2=1∶4;
②因正反应为吸热反应,温度升高时甲烷的转化率增大,故T2>T1。
(2)①过程Ⅰ的热化学方程式为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ/mol;
③b项,过程Ⅱ中使用的催化剂为Fe3O4和CaO。
9.答案 (1)1.2×10-3或0.001 2
(2)0.83或5/6
(3)37.2
(4)abd
(5)
解析 (1)v(PCl3)=v(PCl5)==1.2×10-3 mol·L-1·s-1。
(2)平衡时,c(PCl3)==0.80 mol·L-1,c(Cl2)==0.30 mol·L-1,c(PCl5)==0.20 mol·L-1,所以K===。
(3)反应至250 s时,n(PCl5)=0.40 mol,则反应放出的热量为0.40 mol×93.0 kJ·mol-1=37.2 kJ。
(4)a项,混合气体总质量和容器体积恒定,所以混合气体密度始终不变。b项,升高温度,正、逆反应速率均增大。c项,恒温恒容下充入与反应无关的气体,各反应物浓度不变,平衡不移动。d项,相同条件下,若充入1.0 mol PCl3和0.5 mol Cl2,压强较原平衡减小,所以平衡会逆向移动,平衡时n(PCl5 )<0.20 mol。
(5)升高温度,反应速率加快,达到平衡所用的时间缩短,同时平衡向逆反应方向移动,PCl5的体积分数减小,具体图像见答案。