- 2021-07-02 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
内蒙古第一中学2019-2020学年高一10月月考化学试题
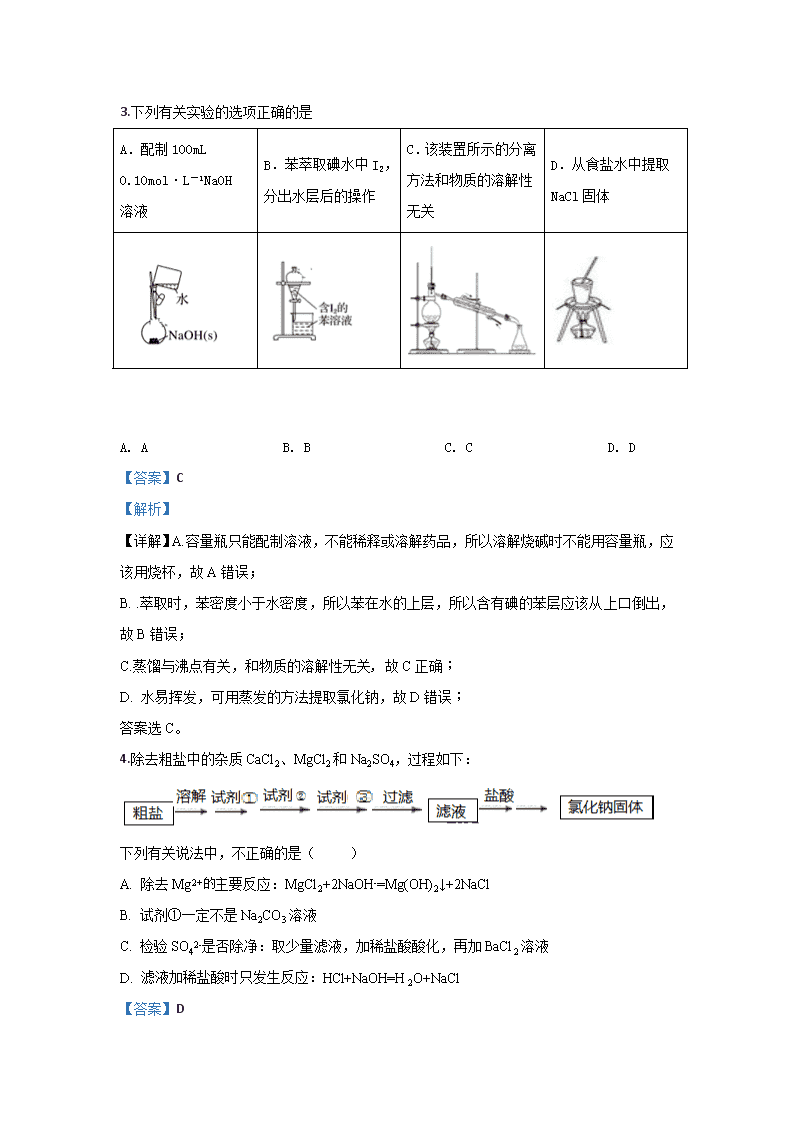
一机一中高一年级月考化学试题 可能用到的相对原子质量:H:l He:4 B:11 C:12 N:14 O:16 Na:23 Fe:56 S:32 Cl:35.5 第I卷(选择题共60分) 一、选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意) 1.下列物质的提纯方法可能属于化学变化的是( ) A. 蒸馏 B. 过滤 C. 分液 D. 洗气 【答案】D 【解析】 【详解】蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法,分液适用于互不相溶的液体之间的一种分离方法,因此它们都是物理变化,所以只有洗气法有可能发生化学反应,答案选D。 2.下列叙述正确的是( ) A. 实验用过的药品可以不经过处理直接丢弃 B. 易分解实验药品应存放在无色玻璃瓶中 C. 凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂. D. 实验室制备有毒有害气体需要在通风橱中进行,必须对尾气进行吸收或处理,防止中毒或污染大气。 【答案】D 【解析】 【详解】A. 实验室剩余的药品不要随意丢弃,不能将药品带出实验室,与题意不符,A错误; B. 见光易分解实验药品应存放在棕色玻璃瓶中,与题意不符,B错误; C. 对试管加热时,不需要加垫石棉网,与题意不符,C错误; D. 实验室制备有毒有害气体为防止中毒,则需要在通风橱中进行,且必须对尾气进行吸收或处理,防止中毒或污染大气,符合题意,D正确; 答案为D。 3.下列有关实验的选项正确的是 A.配制100mL 0.10mol·L-1NaOH溶液 B.苯萃取碘水中I2,分出水层后的操作 C.该装置所示的分离方法和物质的溶解性无关 D.从食盐水中提取NaCl固体 A. A B. B C. C D. D 【答案】C 【解析】 【详解】A.容量瓶只能配制溶液,不能稀释或溶解药品,所以溶解烧碱时不能用容量瓶,应该用烧杯,故A错误; B. .萃取时,苯密度小于水密度,所以苯在水的上层,所以含有碘的苯层应该从上口倒出,故B错误; C.蒸馏与沸点有关,和物质的溶解性无关, 故C正确; D. 水易挥发,可用蒸发的方法提取氯化钠,故D错误; 答案选C。 4.除去粗盐中的杂质CaCl2、MgCl2和Na2SO4,过程如下: 下列有关说法中,不正确的是( ) A. 除去Mg2+主要反应:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl B. 试剂①一定不是Na2CO3溶液 C. 检验SO42-是否除净:取少量滤液,加稀盐酸酸化,再加BaCl2溶液 D. 滤液加稀盐酸时只发生反应:HCl+NaOH=H2O+NaCl 【答案】D 【解析】 【分析】 钙离子、镁离子、硫酸根离子分别用过量的碳酸钠、氢氧化钠、氯化钡除去,过滤后,滤液中有剩余的氢氧化钠和碳酸钠,可以用稀盐酸除去,据以上分析解答。 【详解】A项,镁离子用氢氧化钠除去,反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,故A正确; B项,由于需要碳酸钠除去过量的氯化钡,所以试剂①一定不是碳酸钠溶液,故B正确; C项,检验硫酸根离子是否除净的操作为取少量滤液,加稀盐酸酸化,再加氯化钡溶液,观察是否有白色沉淀,故C正确。 D项,由上述分析可知,滤液溶质含有碳酸钠和氢氧化钠,故向滤液中滴加稀盐酸时,盐酸还会与碳酸钠发生反应,故D错误; 故答案为D。 【点睛】粗盐提纯时,所加的试剂主要有Na2CO3溶液,NaOH溶液,BaCl2溶液,盐酸溶液,NaOH溶液主要除去Mg2+,BaCl2溶液主要除去SO42-,Na2CO3溶液主要除去Ca2+和剩余的Ba2+,等沉淀过滤后,加入盐酸除去OH-、CO32-;因此只要记住:碳酸钠溶液一定加在BaCl2溶液之后,盐酸加在过滤后,操作的顺序就很容易确定了。 5.现有三组混合液:①CCl4和水;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合物(二者是性质非常相似的一对互溶液体);③氯化钾和单质碘的水溶液。分离以上各混合液的正确方法 A. 分液、萃取、蒸馏 B. 蒸馏、萃取、分液 C. 分液、蒸馏、萃取 D. 萃取、蒸馏、分液 【答案】C 【解析】 【分析】 ①CCl4和水分层; ②苯和甲苯沸点不同; ③碘易溶于有机溶剂。 【详解】①CCl4和水互不相溶,所以CCl4和水是分层的,采用分液的方法分离; ②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)是互溶的两种液体,可以采用蒸馏的方法来分离; ③向氯化钾和单质碘的水溶液中加入萃取剂,例如四氯化碳,碘单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后分液即可实现二者的分离,采用萃取法; 答案选C。 【点睛】本题考查物质的分离、提纯方法及选择,把握物质的性质差异及分离方法为解答的关键,侧重分液、萃取、蒸馏的考查。 6.对于某些离子的检验及结论一定正确的是( ) A. 某溶液加入稀盐酸产生无色气体,一定有CO32- B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- C. 加足量稀硝酸酸化后,溶液中无明显变化,再加入AgNO3溶液,生成白色沉淀,能确定有Cl-存在 D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ 【答案】C 【解析】 【详解】A项、盐酸能与碳酸根或碳酸氢根离子反应生成无色气体二氧化碳,某溶液加入稀盐酸产生无色气体,不一定有CO32-,还可能是HCO3-,故A错误; B项、氯化钡能与硫酸根离子或银离子反应生成不溶于水也不溶于酸的硫酸钡或氯化银沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,说明溶液中可能存在硫酸根或是银离子中的至少一种,故B错误; C项、加足量稀硝酸酸化后,溶液中无明显变化,再加入AgNO3溶液,生成白色沉淀说明溶液中有Cl-存在,故C正确; D项、碳酸钠溶液与Ba2+或Ca2+反应生成白色碳酸钡或碳酸钙沉淀,碳酸钡或碳酸钙沉淀均能溶于盐酸,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明溶液中可能存在Ba2+或Ca2+中的至少一种,故D错误; 故选C。 7.下列叙述中正确的是( ) A. 摩尔是物质的量的单位 B. 2mol水的摩尔质量36g/mol C. 阿伏加德罗常数是12g碳中所含有碳原子数 D. 阿伏加德罗常数符号为NA,通常用6.02×1023表示 【答案】A 【解析】 【详解】A. 摩尔是物质的量的单位,符合题意,A正确; B. 摩尔质量与物质有关,与物质的量无关,水的摩尔质量18g/mol,与题意不符,B错误; C. 阿伏加德罗常数是12g碳-12中所含有碳原子数,与题意不符,C错误; D. 阿伏加德罗常数符号为NA,6.02×1023mol-1为阿伏伽德罗常数的近似值,与题意不符,D错误; 答案为A。 8.在标准状况下:①11.2L CH4 ②1.806×1023个HCl分子 ③6.8g H2S ④0.4mol NH3,下列对这四种气体关系从大到小表述正确的是( ) A. 体积:①>④>②>③ B. 密度:③>②>④>① C. 质量:②>①>③>④ D. 氢原子数:①>②>③>④ 【答案】A 【解析】 【分析】 在标准状况下:①11.2L CH4的物质的量为0.5mol,质量为8g;②1.806×1023个HCl分子的物质的量为0.3mol,质量为10.95g;③6.8g H2S的物质的量为0.2mol;④0.4mol NH3,质量为6.8g。 【详解】A. 相同条件下,体积之比等于物质的量之比,则体积:①>④>②>③,符合题意,A正确; B. 相同条件下,密度之比等于摩尔质量之比,则密度:②>③>④>①,与题意不符,B错误; C. 质量:②>①>③=④,与题意不符,C错误; D. 根据分子结构及物质的量,氢原子数:①>④>③>②,与题意不符,D错误; 答案为A。 【点睛】利用阿伏伽德罗定律及其推论进行计算。 9.下列说法正确的是( ) A. 在标准状况下,1mol乙醇(液体)的体积是22.4L B. 1mol H2所占的体积一定是22.4L C. 在标准状况下,NA个任何分子所占的体积约为22.4L D. 在标准状况下,质量为28g的CO和N2混合气体,其体积约为22.4L 【答案】D 【解析】 【详解】A. 在标准状况下,1mol乙醇(液体)的体积小于22.4L,液体不能用气体摩尔体积计算,与题意不符,A错误; B. 未给定气体的条件,则1mol H2所占的体积可能是22.4L,与题意不符,B错误; C. 在标准状况下,NA个任何气体的分子所占的体积约为22.4L,与题意不符,C错误; D. CO和N2的摩尔质量为28g/mol,在标准状况下,质量为28g的CO和N2混合气体,其体积约为22.4L,符合题意,D正确; 答案为D。 10.下列与“物质的量”相关的计算正确的是( ) A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体原子个数之比为3∶2∶1 B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等 C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为 【答案】C 【解析】 【详解】A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,根据三种气体的结构,则三种气体原子个数之比为3:1.5:1=6∶3∶2,与题意不符,A错误; B. 未给定气体的条件,则无法确定22.4 L CO2气体的物质的量,则28 g CO和22.4 L CO2中含有的碳原子数可能相等,与题意不符,B错误; C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32g/mol,符合题意,C正确; D. a g Cl2中有b个氯原子,×35.5=a,则阿伏加德罗常数NA的数值可表示为,与题意不符,D错误; 答案为C。 11.用NA表示阿伏加德罗常数的值。下列判断错误的是( ) A. NA个H+的质量为1 g B. 46g NO2和N2O4混合气体所含氧原子数目为2NA C. 在常温常压下,11.2L N2含有的分子数小于0.5NA D. 56g铁与足量的盐酸反应,转移的电子为3NA 【答案】D 【解析】 【详解】A. H+的摩尔质量为1g/mol,NA个H+的物质的量为1mol,则质量为1 g,与题意不符,A错误; B. NO2和N2O4的最简式相同,46g NO2和N2O4混合气体所含氧原子数目=×2×NA=2NA,与题意不符,B错误; C. 在常温常压下,气体摩尔体积大于22.4L/mol,则11.2L N2的物质的量小于0.5mol,则含有的分子数小于0.5NA,与题意不符,C错误; D. 铁与足量的盐酸反应,Fe的化合价由0价变为+2价,则56g铁参与反应,转移的电子为2NA,符合题意,D正确; 答案为D。 【点睛】铁与盐酸反应,Fe的化合价由0价变为+2价。 12.两份体积相同某植物营养液,其配方分别如下,下列对这两份营养液成分分析中正确是( ) KCl K2SO4 ZnSO4 ① 0.3 mol·L-1 0.2 mol·L-1 0.2 mol·L-1 ② 0.1 mol·L-1 0.3 mol·L-1 — A. K+的物质的量相同 B. Cl-的物质的量相同 C. 完全相同 D. SO42-的物质的量相同 【答案】A 【解析】 【分析】 根据元素守恒,①KCl 0.3mol/L,K2SO40.2mol/L,ZnSO40.2mol/L,则溶液中c(K+)=0.7mol/L,c(Cl-)=0.3mol/L,c(SO42-)=0.4mol/L;②KCl 0.1mol/L,K2SO4 0.3mol/L,则溶液中c (K+)=0.7mol/L,c(Cl-)=0.1mol/L,c(SO42-)=0.3mol/L。 【详解】A. 分析可知,两溶液中,c(K+)相同,体积相同时,K+的物质的量相同,符合题意,A正确; B. 两溶液中,c(Cl-)不相同,体积相同时, Cl-物质的量不相同,与题意不符,B错误; C. 两溶液中Cl-、SO42-均不相同,与题意不符,C错误; D. 分析可知两溶液中SO42-的物质的量不相同,与题意不符,D错误; 答案为A。 13.如果M、SO42-、Mg2+和Na+四种离子以物质的量之比为2∶4∶1∶2共同存在于同一种溶液中,那么M可能是 A. Ba2+ B. CO32- C. Cu2+ D. Cl- 【答案】C 【解析】 【分析】 根据离子的物质的量之比,利用电荷守恒确定离子,再结合离子之间不反应,能大量共存来解答。 【详解】M、SO42-、Mg2+和Na+四种离子以物质的量之比为2∶4∶1∶2共同存在于同一种溶液中, 由电荷守恒可以知道,1×2+2×1<4×2,则M为阳离子,设电荷数为x,则 1×2+2×1+2×x =4×2,计算得出x=2, 又选项中SO42-能和Ba2+发生反应生成硫酸钡沉淀,不能共存, 所以C选项是正确的。 14.若m g密度为ρ g·cm−3的Al2(SO4)3溶液中含 n g,则该Al2(SO4)3溶液的物质的量浓度是 A. mol·L−1 B. mol·L−1 C. mol·L−1 D. mol·L−1 【答案】D 【解析】 【详解】n()=mol,Al2(SO4)3的物质的量n[Al2(SO4)3]= mol,溶液体积V= cm3=L,故Al2(SO4)3的物质的量浓度 ,故D正确。 综上所述,本题正确答案为D。 【点睛】本题重点考查以物质的量为中心的简单计算,需要牢记基础公式,、 、(标况下,气体的摩尔体积为22.4L/mol)、等。 15.36.5gHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为w,物质的量浓度为cmol/L,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( ) A. 所得溶液的物质的量浓度:c=1mol/L B. 所得溶液中含有NA个HCl分子 C. 36.5gHCl气体占有的体积为22.4L D. 所得溶液的质量分数w= 【答案】D 【解析】 【分析】 利用物质的量浓度的定义、质量分数等知识进行分析。 【详解】A、根据物质的量浓度的定义,n(HCl)==1mol,溶液的质量为(36.5g+1×103mL×1g·mL-1)=1036.5g,则溶液的体积为= ,该盐酸的物质的量浓度为mol·L-1,故A错误; B、HCl为强电解质,在水中完全电离,即在水溶液中不含HCl分子,故B错误; C、题中没有说明是否是标准状态,因此不能直接用22.4L·mol-1,故C错误; D、利用c=,w%=,故D正确; 答案为D。 【点睛】易错点是选项A,利用c=,V指的是溶液的体积,不是溶剂的体积,同时应注意混合后溶液的体积不等于混合前体积相加,应利用密度计算溶液的体积。 16.如图所示,相同状况下,分别用氯化氢和四种混合气体吹出体积相等的五个气球。A、B、C、D四个气球中所含原子数与氯化氢气球中所含原子数一定相等的是 A. B. C. D. 【答案】C 【解析】 【分析】 在相同的温度和压强下,相同体积的任何气体含有相同数目的分子数,这是阿伏加罗定律,据此判断。 【详解】A、Ar是单原子分子,O3是三原子的分子,它们组成的混合气体的原子数只有在分子个数比为1:1时才和HCl相同,A错误; B、H2是双原子分子,但NH3是四原子分子,它们所含的原子数一定比HCl多,B错误; C、HCl是双原子分子,C中的N2、O2也都是双原子分子,他们所含的原子数也相同,C正确; D、CO是双原子分子,但CO2是三原子分子,它们所含的原子数一定比HCl多,D错误; 答案选C。 17. 对于反应aA+bB==dD+eE,若已知40g A可恰好与21g B完全反应生成28g D,则B与E的摩尔质量比为 A. 7a:10d B. 10a:7d C. 10b:7e D. 7e:11b 【答案】D 【解析】 试题分析:根据质量守恒定律可得40g A可恰好与21g B完全反应生成28g D和33g的E,则bM(B):eM(E)=21:33=7:11,所以M(B):M(E)=7e:11b,答案选D。 考点:考查质量守恒定律在化学计算及确定物质的相对分子质量关系的应用的知识 18.三种气体X、Y、Z相对分子质量关系为Mr(X)查看更多
相关文章
- 当前文档收益归属上传用户