- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第二章分子结构与性质第二节第2课时杂化轨道理论配合物理论同步练习新人教版选修3
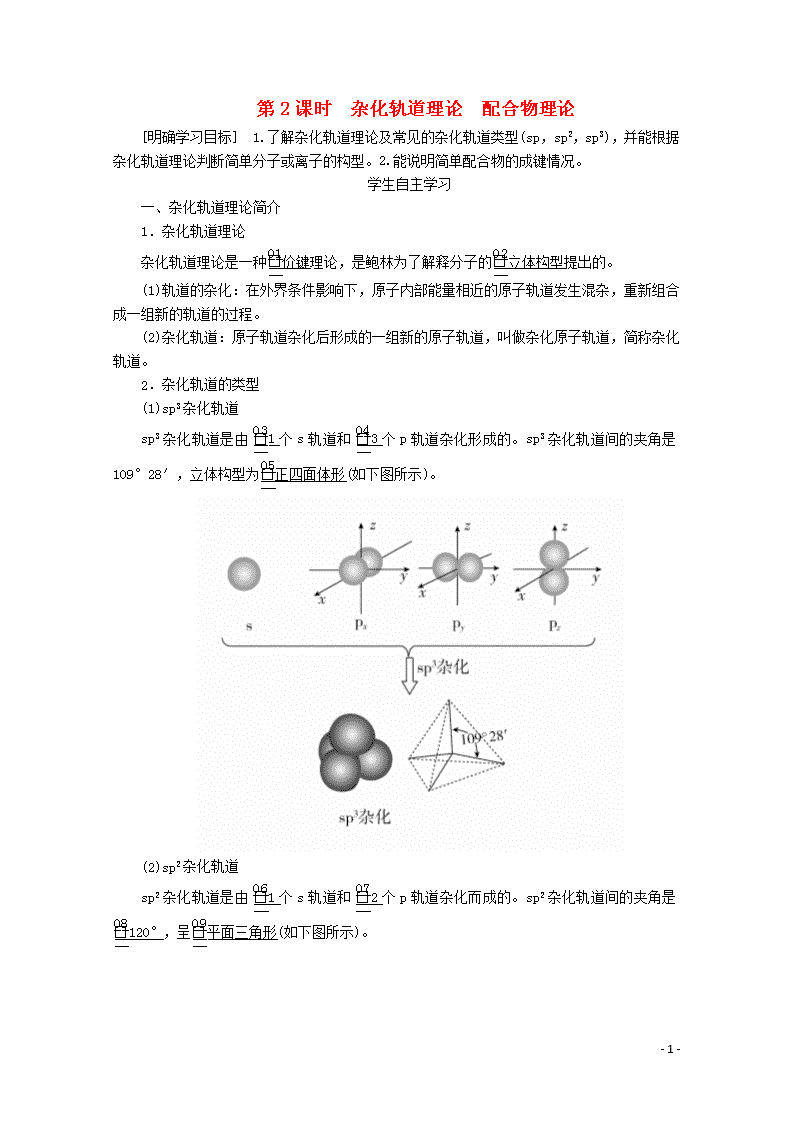
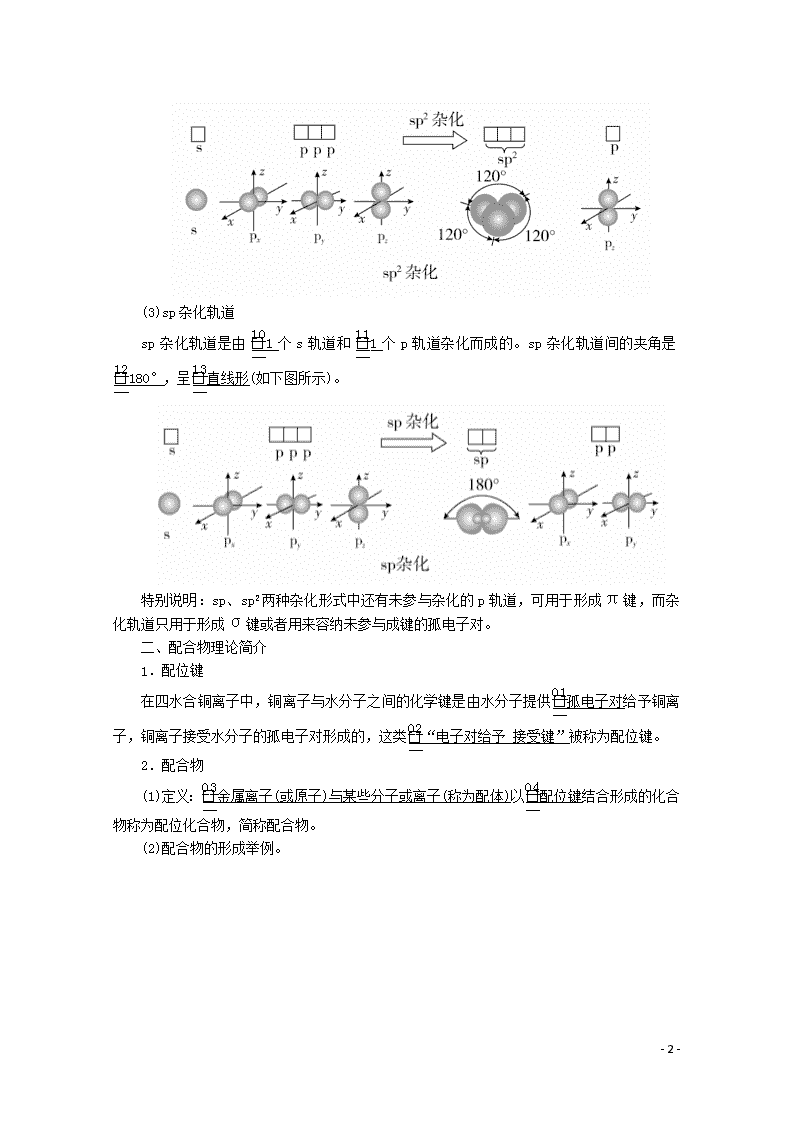
第2课时 杂化轨道理论 配合物理论 [明确学习目标] 1.了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),并能根据杂化轨道理论判断简单分子或离子的构型。2.能说明简单配合物的成键情况。 学生自主学习 一、杂化轨道理论简介 1.杂化轨道理论 杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体构型提出的。 (1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。 (2)杂化轨道:原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。 2.杂化轨道的类型 (1)sp3杂化轨道 sp3杂化轨道是由1个s轨道和3个p轨道杂化形成的。sp3杂化轨道间的夹角是109°28′,立体构型为正四面体形(如下图所示)。 (2)sp2杂化轨道 sp2杂化轨道是由1个s轨道和2个p轨道杂化而成的。sp2杂化轨道间的夹角是120°,呈平面三角形(如下图所示)。 - 10 - (3)sp杂化轨道 sp杂化轨道是由1个s轨道和1个p轨道杂化而成的。sp杂化轨道间的夹角是180°,呈直线形(如下图所示)。 特别说明:sp、sp2两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对。 二、配合物理论简介 1.配位键 在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的,这类“电子对给予接受键”被称为配位键。 2.配合物 (1)定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。 (2)配合物的形成举例。 - 10 - 1.为什么H2O分子的键角既不是90°也不是109°28′,而是105°? 提示:因为H2O分子的中心原子O的价电子排布式为2s22p4,O原子采取sp3杂化,形成4个sp3杂化轨道。其中两个轨道各有一个未成对电子,与氢原子成键;另两个轨道则各有一对孤电子对,它们未参与成键。孤电子对与成键电子对的排斥作用使O—H键之间的夹角被压缩到105°。所以,水分子呈V形,键角为105°。 2.在四水合铜离子中,铜离子与水分子之间的配位键是如何形成的?该配位键如何表示? 提示:在四水合铜离子中,铜离子与水分子之间的配位键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的,该离子可表示为 - 10 - 课堂互动探究 一、判断中心原子杂化轨道类型的方法 (1)根据杂化轨道的立体构型判断 ①若杂化轨道在空间的分布为四面体,则中心原子发生sp3杂化; ②若杂化轨道在空间的分布呈平面三角形,则中心原子发生sp2杂化; ③若杂化轨道在空间的分布呈直线形,则中心原子发生sp杂化。 (2)根据杂化轨道之间的夹角判断 ①若杂化轨道之间的夹角为109°28′,则中心原子发生sp3杂化; ②若杂化轨道之间的夹角为120°,则中心原子发生sp2杂化; ③若杂化轨道之间的夹角为180°,则中心原子发生sp杂化。 (3)根据中心原子的价层电子对数判断 ①若价层电子对数为2,则中心原子发生sp杂化; ②若价层电子对数为3,则中心原子发生sp2杂化; ③若价层电子对数为4,则中心原子发生sp3杂化。 [即时练] 1.下列关于杂化轨道的叙述中,不正确的是( ) A.分子的中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 B.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 C.杂化前后的轨道数不变,但轨道的形状发生了改变 D.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° 答案 B 解析 分子的中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构,可能是三角锥形或V形,如NH3是三角锥形、H2O是V形,故A正确;杂化轨道用来形成σ键或容纳孤电子对,未杂化的轨道可用来形成π键,故B错误;杂化前后原子轨道数目不变,但杂化后轨道形状发生改变,各个轨道尽可能分散、对称分布,故C正确;sp3、sp2、sp杂化轨道夹角分别为109°28′、120°、180°,故D正确。 2.通过计算判断下列中心原子的杂化轨道类型(带“·”的原子为中心原子)。 - 10 - 答案 ①4 sp3 ②3 sp2 ③4 sp3 ④4 sp3 ⑤4 sp3 解析 根据杂化轨道数=中心原子孤对电子数+中心原子结合的原子数,以及杂化轨道数为2时杂化方式为sp,杂化轨道数为3时杂化方式为sp2,杂化轨道数为4时杂化方式为sp3,可得出正确答案。 二、配合物理论简介 1.配位键 (1)配位键:成键的一方提供孤电子对(配体),另一方提供空轨道而形成的“电子对给予接受键”,叫做配位键。 (2)配体:应含有孤电子对,可以是分子,也可以是离子,如NH3、H2O、F-、OH-等。 (3)成键条件:形成配位键的一方能够提供孤电子对,另一方具有能够接受孤电子对的空轨道。 (4)配位键的表示方法: - 10 - (5)配位键与普通共价键的异同 ①配位键实质上是一种特殊的共价键。 ②配位键与普通共价键只是在形成过程上有所不同。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但它们的实质是相同的,都是由成键原子双方共用,如配离子 ③同共价键一样,配位键可以存在于分子之中[如Ni(CO)4],也可以存在于离子之中(如NH)。 2.配合物的组成 配合物由中心原子或离子(提供空轨道)和配体(提供孤电子对)组成,分为内界和外界,以[Cu(NH3)4]SO4为例表示为 - 10 - 3.配合物的形成对性质的影响 (1)对溶解性的影响 一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨的溶液中,或依次溶解于含过量的OH-、CI-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-。 (2)颜色的改变 Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。 (3)稳定性增强 配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。 [即时练] 3.下列不是配合物的是( ) A.[Cu(NH3)4]SO4·H2O B.[Ag(NH3)2]OH C.KAl(SO4)2·12H2O D.Fe(SCN)3 答案 C 解析 A、B、D三项均为配合物,C项为复盐,不是配合物。 4.有两种配合物A、B,化学式都是CoCl3·5NH3·H2O,中心离子的配位数都为6。试根据下面的实验结果,确定它们的配离子、中心离子和配位体。 (1)A和B的水溶液呈微酸性,向其中加入强碱并加热至沸腾,有NH3放出,同时有Co2O3的沉淀。 (2)向A和B的溶液中,加入AgNO3后均有AgCl沉淀。 - 10 - (3)沉淀过滤后,再加AgNO3均无变化,但加热至沸腾,B溶液又有AgCl沉淀生成,其沉淀量为原来B溶液的一半。 答案 A:[Co(NH3)5·H2O]Cl3, 配离子为[Co(NH3)5·H2O]3+,中心离子为Co3+, 配位体NH3、H2O B:[Co(NH3)5Cl]Cl2·H2O, 配离子为[Co(NH3)5Cl]2+,中心离子为Co3+, 配位体NH3、Cl-。 解析 根据实验(1)可知:两种物质配离子被破坏而放出NH3。根据(2)可知:Cl-为外界,加AgNO3后有沉淀析出。由(3)可知:A再滴加AgNO3,加热前后无变化,证明Cl-全是外界,而B再滴加AgNO3加热后,沉淀量为原来的一半,证明有2个Cl-在外界,1个Cl-在内界,所以A为[Co(NH3)5·H2O]Cl3,B为 [Co(NH3)5Cl]Cl2·H2O。 规律方法 配合物中外界离子能电离出来,内界离子不能电离出来,通过实验及其数据可以确定内界和外界离子的个数,从而可以确定配离子、中心离子和配位体。 学习效果检测 1.下列说法正确的是( ) A.H2SO4分子中三种原子均以杂化轨道成键 - 10 - B.NH的电子式为,该离子呈平面正方形 C.CH4分子中的4个C—H键都是由氢原子的1s轨道与碳原子的2p轨道重叠形成的 D.CH4分子中碳原子的sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H键 答案 D 解析 H2SO4分子中H、O原子没有发生轨道杂化,A错误;NH呈正四面体形,B错误;CH4分子中碳原子的2s轨道与2p轨道进行杂化形成4个sp3杂化轨道,然后碳原子的sp3杂化轨道与氢原子的1s轨道重叠形成C—H σ键,C错误,D正确。 2.以下微粒中不含配位键的是( ) ①NH ②CH4 ③OH- ④NH3 ⑤N2H ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH A.①②④⑦⑧ B.①④⑥⑦⑧ C.③④⑤⑥⑦ D.②③④ 答案 D 解析 ①氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH中含有配位键;②甲烷的电子式为,无空轨道,无孤电子对,CH4中不含配位键;③OH-的电子式为[H]-,无空轨道,OH-中不含配位键;④氨气分子中氮原子含有孤电子对,但没有形成配位键;⑤氢离子提供空轨道,N2H4中的氮原子提供孤电子对,能够形成配位键,故N2H中含有配位键;⑥SCN-的电子式是[C⋮⋮N]-,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3中含有配位键;⑦H3O+中氧原子提供孤电子对,H+提供空轨道,二者形成配位键,H3O+中含有配位键;⑧Ag+有空轨道,NH3中的氮原子有孤电子对,可以形成配位键,Ag(NH3)2OH中含有配位键。 3.小明同学上网查阅了如下资料: 中心原子杂化类型的判断方法: (1)公式:n=(中心原子的价电子数+配位原子的成键电子数±电荷数)÷2。 说明:配位原子为氧原子或硫原子时,成键电子数看为0;当电荷数为正值时,公式中取“-”号,当电荷数为负值时,公式中取“+”号。 (2)根据n值判断杂化类型:,当n=2时为sp杂化;n=3时为sp2杂化;n=4时为sp3杂化。 请运用该方法计算下列微粒的n值,并判断中心原子的杂化类型。 (1)NH3:n=________,________杂化。 - 10 - (2)NO:n=________,________杂化。 (3)NH:n=________,________杂化。 (4)SO2:n=________,________杂化。 答案 (1)4 sp3 (2)3 sp2 (3)4 sp3 (4)3 sp2 解析 (1)NH3中n==4,N为sp3杂化。 (2)NO中n==3,N为sp2杂化。 (3)NH中n==4,N为sp3杂化。 (4)SO2中n==3,S为sp2杂化。 4.配位化学创始人维尔纳发现,取CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)四种化合物各1 mol分别溶于水,加入足量硝酸银溶液,生成氯化银沉淀的物质的量分别为3 mol、2 mol、1 mol和1 mol。 (1)请根据实验事实用配合物的形式写出它们的化学式。 CoCl3·6NH3________________, CoCl3·5NH3________________, CoCl3·4NH3(绿色和紫色)________________。 (2)后两种物质的组成相同而颜色不同的原因是____________________。 (3)上述配合物中,中心离子的配位数都是________。 答案 (1)[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2 [Co(NH3)4Cl2]Cl (2)空间构型不同 (3)6 解析 (1)1 mol CoCl3·6NH3与AgNO3反应只生成3 mol AgCl,则1 mol CoCl3·6NH3中有3 mol Cl-为外界离子,钴的配位数为6,配体为NH3,所以其化学式为[Co(NH3)6]Cl3;1 mol CoCl3·5NH3与AgNO3反应只生成2 mol AgCl,则1 mol CoCl3·5NH3中有2 mol Cl-为外界离子,钴的配位数为6,配体为NH3和Cl-,所以其化学式为[Co(NH3)5Cl]Cl2;1 mol CoCl3·4NH3(绿色)和1 mol CoCl3·4NH3(紫色)分别与AgNO3反应均只生成1 mol AgCl,则1 mol CoCl3·4NH3中有1 mol Cl-为外界离子,钴的配位数为6,配体为NH3和Cl-,所以化学式为[Co(NH3)4Cl2]Cl。 (2)CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的化学式都是[Co(NH3)4Cl2]Cl,但因其空间构型不同导致颜色不同。 (3)题述几种配合物的化学式分别是[Co(NH3)6]Cl3、 [Co(NH3)5Cl]Cl2、[Co(NH3)4Cl2]Cl、 [Co(NH3)4Cl2]Cl,其配位数都是6。 - 10 -查看更多