- 2021-07-02 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学(文)卷·2018届山西省太原市五中高二5月月考(2017
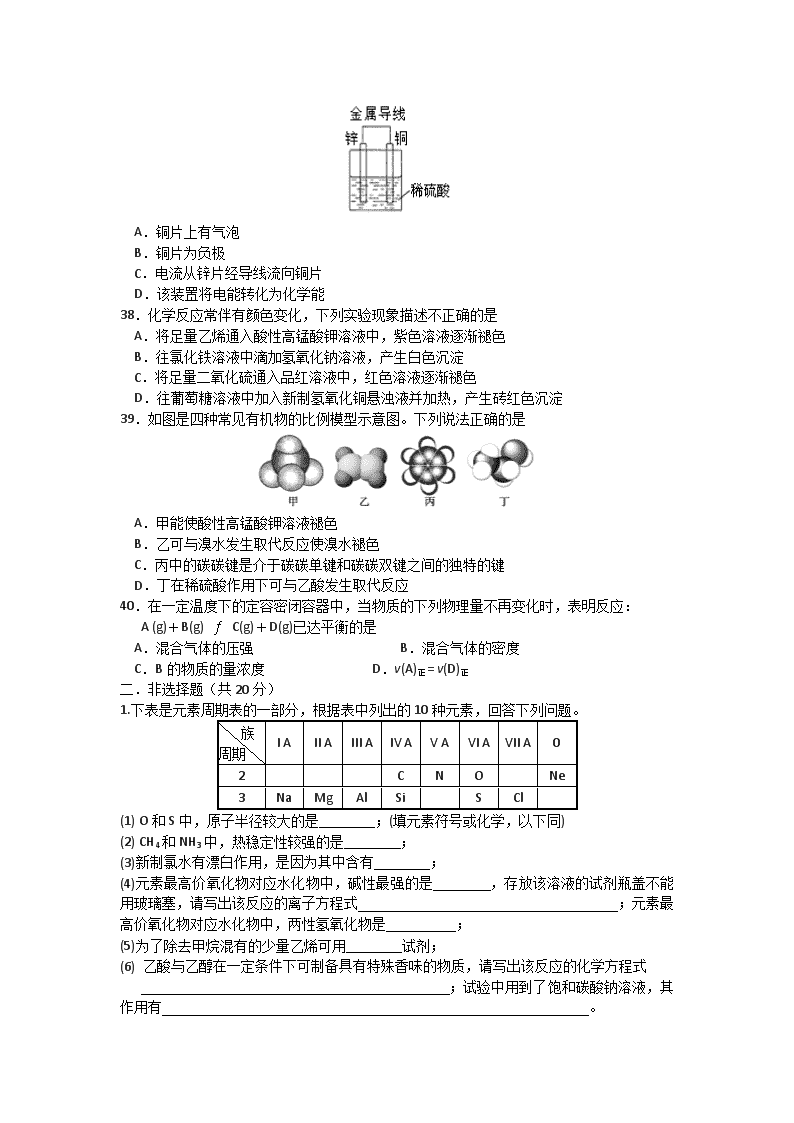
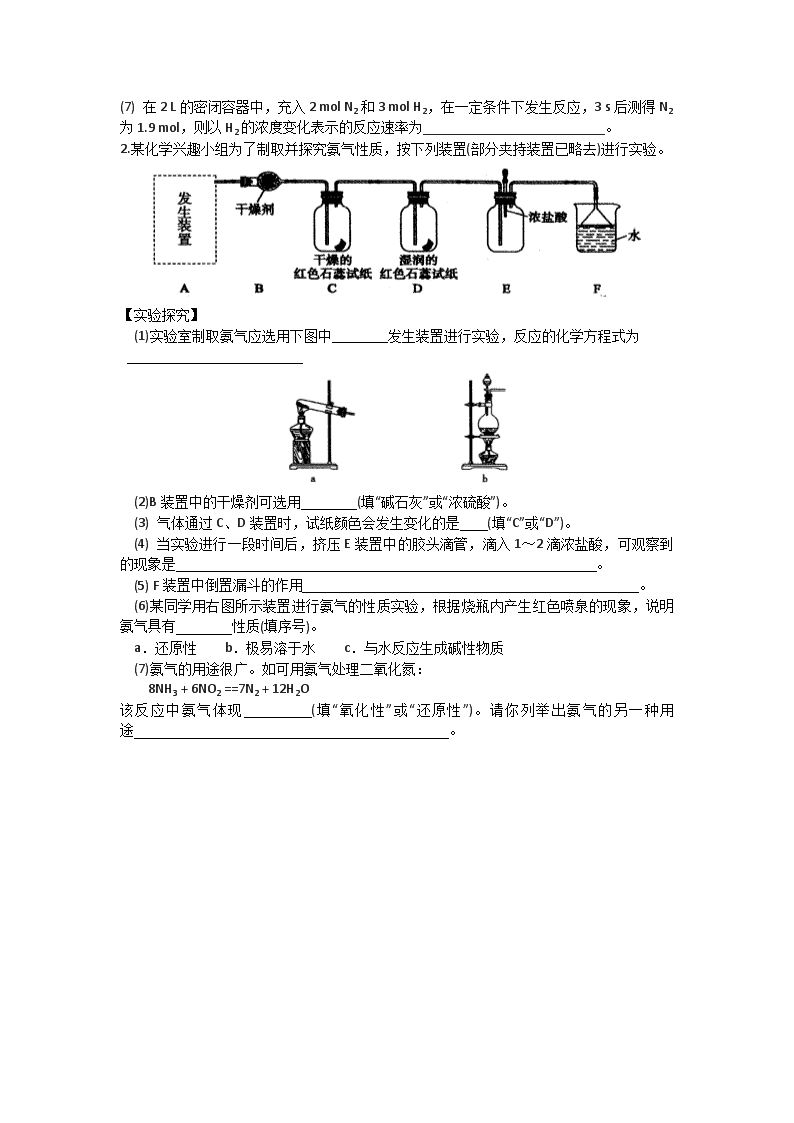
太原五中2016-2017学年度第二学期阶段性检测 高二理科综合(化学) 命题:吕宏斌 校对:吕宏斌(2017.5) 相对原子质量: H 1 C 12 O 16 一.选择题(每小题只有一个选项符合题意,每小题3分,共30分。答案涂在答题卡31~40题相应位置。) 31.下列各项实验操作中,正确的是 A.实验剩余的药品不应放回原试剂瓶,但可以随意扔到垃圾筒中 B.蒸发氯化钠溶液时不能用玻璃棒搅拌 C.为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 D.若容量瓶漏水,可在玻璃塞上涂抹凡士林 32.NA表示阿伏加德罗常数的值,下列说法中正确的是 A.含0.1 mol BaCl2的溶液中Cl-数为0.1NA B.22 g CO2所含有的分子数为0.5NA C.11.2 L O2所含有的分子数为0.5NA D.常温下NA个Cl2分子所占有的体积为22.4 L 33.下列物质中,只含离子键的是 A.O2 B.KOH C.MgO D.CO2 34.能大量共存于同一溶液中的离子组是 A.Ba2+、K+、SO42— B.Ca2+、NO3—、Cl— C.Na+、Mg2+、OH— D.H+、Cl—、HCO3— 35.下列反应离子方程式书写不正确的是 A.硝酸银与氯化钾溶液的反应:Ag+ + Cl— == AgCl↓ B.硝酸与氢氧化钠溶液的反应:H+ + OH— == H2O C.碳酸钙与盐酸的反应:CO32— + 2H+ == CO2↑+ H2O D.锌粒与稀硫酸的反应:Zn + 2H+ ==Zn2+ + H2↑ 36.下列不属于氧化还原反应的是 A.S + O 2 SO 2 B.Fe(OH)3 + 3HCl == FeCl3 + 3H2O C.2Mg + CO22MgO + C D.4HNO3(浓)4NO2↑+ O2↑+ 2H2O 37.关于下图所示原电池装置中,叙述正确的是 A.铜片上有气泡 B.铜片为负极 C.电流从锌片经导线流向铜片 D.该装置将电能转化为化学能 38.化学反应常伴有颜色变化,下列实验现象描述不正确的是 A.将足量乙烯通入酸性高锰酸钾溶液中,紫色溶液逐渐褪色 B.往氯化铁溶液中滴加氢氧化钠溶液,产生白色沉淀 C.将足量二氧化硫通入品红溶液中,红色溶液逐渐褪色 D.往葡萄糖溶液中加入新制氢氧化铜悬浊液并加热,产生砖红色沉淀 39.如图是四种常见有机物的比例模型示意图。下列说法正确的是 A.甲能使酸性高锰酸钾溶液褪色 B.乙可与溴水发生取代反应使溴水褪色 C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 D.丁在稀硫酸作用下可与乙酸发生取代反应 40.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应: A (g)+B(g) C(g)+D(g)已达平衡的是 A.混合气体的压强 B.混合气体的密度 C.B的物质的量浓度 D.v(A)正= v(D)正 二.非选择题(共20分) 1.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。 族 周期 I A II A III A IV A V A VI A VII A 0 2 C N O Ne 3 Na Mg Al Si S Cl (1) O和S中,原子半径较大的是 ;(填元素符号或化学,以下同) (2) CH4和NH3中,热稳定性较强的是 ; (3)新制氯水有漂白作用,是因为其中含有 ; (4)元素最高价氧化物对应水化物中,碱性最强的是 ,存放该溶液的试剂瓶盖不能用玻璃塞,请写出该反应的离子方程式 ;元素最高价氧化物对应水化物中,两性氢氧化物是 ; (5)为了除去甲烷混有的少量乙烯可用 试剂; (6) 乙酸与乙醇在一定条件下可制备具有特殊香味的物质,请写出该反应的化学方程式 ;试验中用到了饱和碳酸钠溶液,其作用有 。 (7) 在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为__________________________。 2.某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。 【实验探究】 (1)实验室制取氨气应选用下图中 发生装置进行实验,反应的化学方程式为 (2)B装置中的干燥剂可选用 (填“碱石灰”或“浓硫酸”)。 (3) 气体通过C、D装置时,试纸颜色会发生变化的是 (填“C”或“D”)。 (4) 当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 。 (5) F装置中倒置漏斗的作用 。 (6)某同学用右图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有 性质(填序号)。 a.还原性 b.极易溶于水 c.与水反应生成碱性物质 (7)氨气的用途很广。如可用氨气处理二氧化氮: 8NH3 + 6NO2 ==7N2 + 12H2O 该反应中氨气体现 (填“氧化性”或“还原性”)。请你列举出氨气的另一种用途 。 参考答案 31—40 DBCBC BABCC 1. (1)S (2) NH3 (3) HClO (4)NaOH, SiO2+2OH-== SiO32-+H2O; Al(OH)3 (5)溴的四氯化碳 (6) CH3CH2OH+ CH3COOH CH3COO CH2 CH3+H2O; 吸收乙酸,溶解乙醇,降低乙酸乙酯的溶解度 (7)0.05mol/(L·s) 2.(1)a 2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+2H2O (2)碱石灰 (3) D (4) 产生白烟 (5) 防止倒吸 (6) b c (7) 还原性 ①致冷剂②氮肥(或化肥)的原料③硝酸的原料④化工原料查看更多