- 2021-07-02 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020九年级化学上册 第三单元 课题2 原子的结构 3
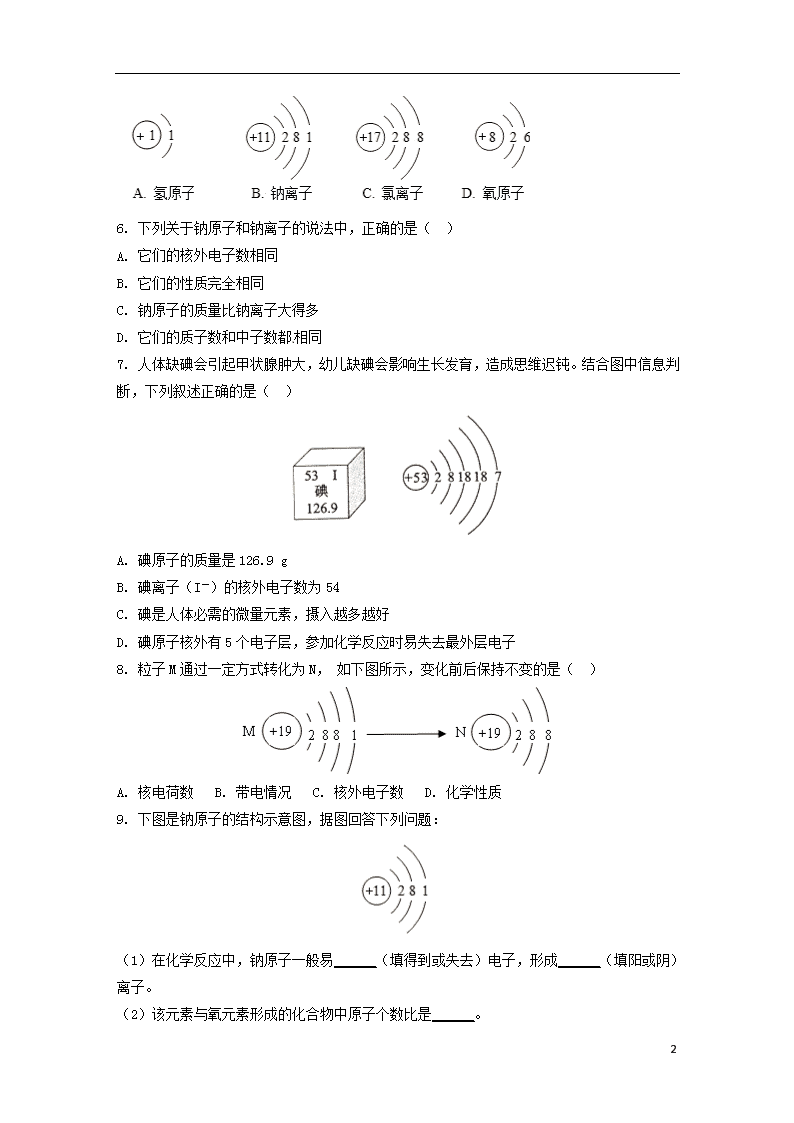
原子的构成 课后作业 1.下列粒子结构示意图中表示阴离子的是( ) 2. 下列物质中,由离子构成的是( ) A.硫 B. 氯化钠 C. 氧气 D. 水 3. 下列化学用语书写正确的是( ) A. 钴元素CO B. 4个氢原子2H2 C. 铵根离子NH4+ D. 氮分子N 4. 对于下列化学用语,有关说法正确的是( ) ① N2 ②Mg2+ ③S ④ ⑤ A. ①可表示两个氮原子 B. ③中硫可形成的阴离子是S2- C. ②和⑤均表示阳离子 D. ④和⑤表示的微粒化学性质相同 5. 下列粒子结构示意图不正确的是( ) 5 6. 下列关于钠原子和钠离子的说法中,正确的是( ) A. 它们的核外电子数相同 B. 它们的性质完全相同 C. 钠原子的质量比钠离子大得多 D. 它们的质子数和中子数都相同 7. 人体缺碘会引起甲状腺肿大,幼儿缺碘会影响生长发育,造成思维迟钝。结合图中信息判断,下列叙述正确的是( ) A. 碘原子的质量是126.9 g B. 碘离子(I-)的核外电子数为54 C. 碘是人体必需的微量元素,摄入越多越好 D. 碘原子核外有5个电子层,参加化学反应时易失去最外层电子 8. 粒子M通过一定方式转化为N, 如下图所示,变化前后保持不变的是( ) A. 核电荷数 B. 带电情况 C. 核外电子数 D. 化学性质 9. 下图是钠原子的结构示意图,据图回答下列问题: (1)在化学反应中,钠原子一般易______(填得到或失去)电子,形成______(填阳或阴)离子。 (2)该元素与氧元素形成的化合物中原子个数比是______。 5 (3)钠原子与下面哪种原子的化学性质相似______(填选项)。 10. 化学用语可准确、简洁地表达化学信息。请用化学符号和数字填空。 (1)硝酸根离子____________; (2)2个碳酸根离子____________; (3)铵根离子____________; (4)氢氧根离子____________。 11. 根据下列图示回答问题。 (1)A、B、C、D共表示______种元素,其中属于金属元素的是________(填元素名称)。 (2)Cl在化学反应中易_________(填“得到”或“失去”)电子,形成________(填化学符号) (3)钠元素与氯元素形成的化合物的原子个数比是____________。 12. 下面是部分原子或离子的结构示意图。请你仔细观察、分析,然后回答问题: (1)上述粒子中,属于阳离子的是___________(填序号,下同),属于阴离子的是_______; (2)电子层结构完全相同的离子是__________(填写序号); (3)能与①形成AB4型分子的是____________(填写序号)。 5 原子的构成课后作业参考答案 1. C 解析:A中核内质子数大于核外电子数,属于阳离子;B中核内质子数等于核外电子数,属于原子;C中核内质子数小于核外电子数,属于阴离子;D中核内质子数大于核外电子数,属于阳离子,故选C。 2. B 解析:硫属于非金属固体单质,是由原子直接构成;氯化钠是由钠离子和氯离子构成;氧气是由氧分子构成;水是由水分子构成。 3. C 解析:钴元素的元素符号为Co,而CO表示的是一氧化碳;4个氢原子用4H表示,2H2表示两个氢分子;氮分子用N2表示,N表示氮元素或一个氮原子。 4. B 解析:“N2”表示氮气,还可表示一个氮分子、一个氮分子中含有2个氮原子,“2N”表示2个氮原子,A错误;S是16号元素,核外一共有16个电子,最外层有6个,可得到两个电子形成阴离子S2-,B正确;②表示阳离子——镁离子,由⑤的结构示意图可知,核内质子数<核外电子数,属于阴离子,C错误;④和⑤表示的微粒属于同一种元素,但由于两者的最外层电子数不同,因此两者的化学性质不同,D错误。 5. B 解析:区分原子和离子的关键是看质子数和电子数是否相等,质子数等于电子数为原子,否则为离子,所以钠离子的结构示意图为:,B中表示的是钠原子的结构示意图。 6. D 解析:金属原子易失去最外层电子形成具有相对稳定结构的阳离子,非金属原子得到电子形成具有相对稳定结构的阴离子,因此离子和原子的核外电子数不等,A错误;元素的化学性质与原子的最外层电子数关系密切。钠原子的最外层电子数没有达到相对稳定结构,在化学变化中表现为易失去电子,钠离子最外层达到相对稳定结构,B错误;原子的质量主要集中在原子核上,一个电子的质量非常小,因此钠原子和钠离子的质量差不多,C错误;原子形成离子的过程中质子数和中子数没有变化,D正确。 7. B 解析:根据碘在周期表中的信息可知,碘的原子序数为53,碘的相对原子质量为126.9,相对原子质量的单位不是质量单位,所以A不正确;碘原子最外层电子数为7,在化学反应中易得到电子形成碘离子,所以碘离子的核外电子数为54,即B正确;碘是人体必需的微量元素,但微量元素在体内有一个合理的浓度范围,高于或低于这一范围对人体健康都不利,所以C不正确;根据碘原子的结构示意图可知,碘原子核外有五个电子层,但在化学反应中易得到电子,所以D不正确。 8. A 解析: 5 通过观察粒子M的结构示意图可以看出,M表示的是原子,最外层电子数为1,少于4个,在化学反应中易失去最外层电子变成离子,也就是粒子N,在此过程中,原子核没有发生改变,所以核电荷数没有改变,故选项A正确;粒子M失去1个电子变成带1个单位正电荷的离子N,故选项B错误;粒子M变成粒子N,失去1个电子,故选项C错误;M的最外层电子数为1,而N的最外层电子数为8,故两者的化学性质不同,选项D错误。 9. 失去;阳;2∶1;A 解析:钠原子最外层电子数为1,容易失去电子形成阳离子,离子形成稳定化合物时,得失电子总数是相等的,故钠原子和氯原子的个数比应为2∶1,原子的最外层电子数相同,化学性质相似,A中最外层电子数与钠原子相同。 10. (1)NO3- (2)2CO32- (3)NH4+ (4)OH- 解析:表示离子要在元素符号或原子团的右上角写上正负号与数字,数字在前,正负号在后,数字为“1”时要省略不写;表示几个离子要在离子前面加数字,故2个碳酸根离子可表示为2CO32-。 11. (1)两;钠 (2)得到;Cl- (3)1∶1 解析:不同元素的根本区别在于原子核内的质子数不同,氯元素的最外层电子数是7,容易得到1个电子形成阴离子,带一个单位的负电荷;钠原子会失去一个电子形成阳离子,带一个单位的正电荷,根据得失电子总数相等,可知形成化合物时原子个数比为1∶1。 12. (1)⑤;③ (2)③④⑤ (3)⑥ 解析:原子得失电子形成离子,阳离子的核内质子数大于核外电子数,阴离子的核内质子数小于核外电子数;电子层结构完全相同指的是电子层数相同,每一层容纳的电子数也完全一样,注意与粒子的种类无关,可以是原子,也可能是阴离子或阳离子;①的核外只有一个电子,只能转移或失去一个电子。要形成AB4型分子,则另一个原子的最外层电子数必须是4个,按照得失电子总数相等的原则,原子个数比为1∶4。 5查看更多