湖北四地六校2021届高三化学上学期开学联考试题(Word版附答案)
2020年夏“武汉襄阳荆门]宜昌四地六校考试联盟”高三起点联考化学试题
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Li-7 Fe-56 Cu-64 Te- 128
第I卷(选择题共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.下列有关说法中错误的是( )
A.医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,聚丙烯可以使溴水褪色
B.可以用热的纯碱溶液去油污
C.可以用家里的食醋除去水壶中的水垢
D.修建“火神山”医院所用的HDPE(高密度聚乙烯)膜是-种无毒、无味的高分子材料
2.在分析某有机物分子组成与结构时,不会涉及到的选项有( )
A.红外光谱 B.核磁共振氢谐 C.色谱 D.质谱
3.下列选项正确的是( )
A.第一电离能: O>N>C B.熔点: NaCl>MgO
C.在水中的溶解性: SO2>CO2 D.酸性: HF>HCl
4.设NA为阿伏加德罗常数,下列说法正确的是( )
A. 1 mol的Na2O2与水充分反应,该过程中共有2mol电子转移
B.若两种有机物的实验式相同,那么等质量的两种物质一定具有相同的分子数
C.2SO2+O22SO3 △H=-aKJ ●mol-1每当有1molO2反应完全,该过程会释放aKJ的能量
D.22.4LCl2与一定量CH4充分反应,最多只能生成NA个HCl
5.如图是部分短周期元素原子半径与原子序数的关系图。下 列说法正确的是( )
A.最高价氧化物对应水化物的碱性: Z
R
C. X、N两种元素形成的化合物属于离子化合物
D.简单离子的半径: Z>M>X
6.下列实验方案正确且能达到相应实验预期目的的是( )
7.下列关于图示有机物的说法正确的是( )
A.分子式为C10H10O4Br
B.该有机物中所有的碳原子可能共平面
C.该有机物能发生消去反应、取代反应、氧化反应
D.lmol该有机物最多与4molNaOH发生反应
8.下列有关描述不正确的是( )
A.用杂化轨道理论解释CH4的正四面体空间构型
B.用周期律与周期表解释反应2C+SiO22CO↑+Si
C.用平衡移动原理解释钟乳石的形成过程
D.用洪特规则解释Fe2+ 与Fe3+稳定性
9.黄铁矿(FeS2)催 化氧化的化学方程式为: 2FeS2+ 7O2+ 2H2O2FeSO4+ 2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A. FeSO4 和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol· L-1FeSO4溶液中Fe2+离子的浓度为0.1 mol●L-1
C. FeS2 既是氧化剂又是还原剂,FeSO4 既是氧化产物又是还原产物
D.当转移4 mol电子时,消耗氧气的质量为32g
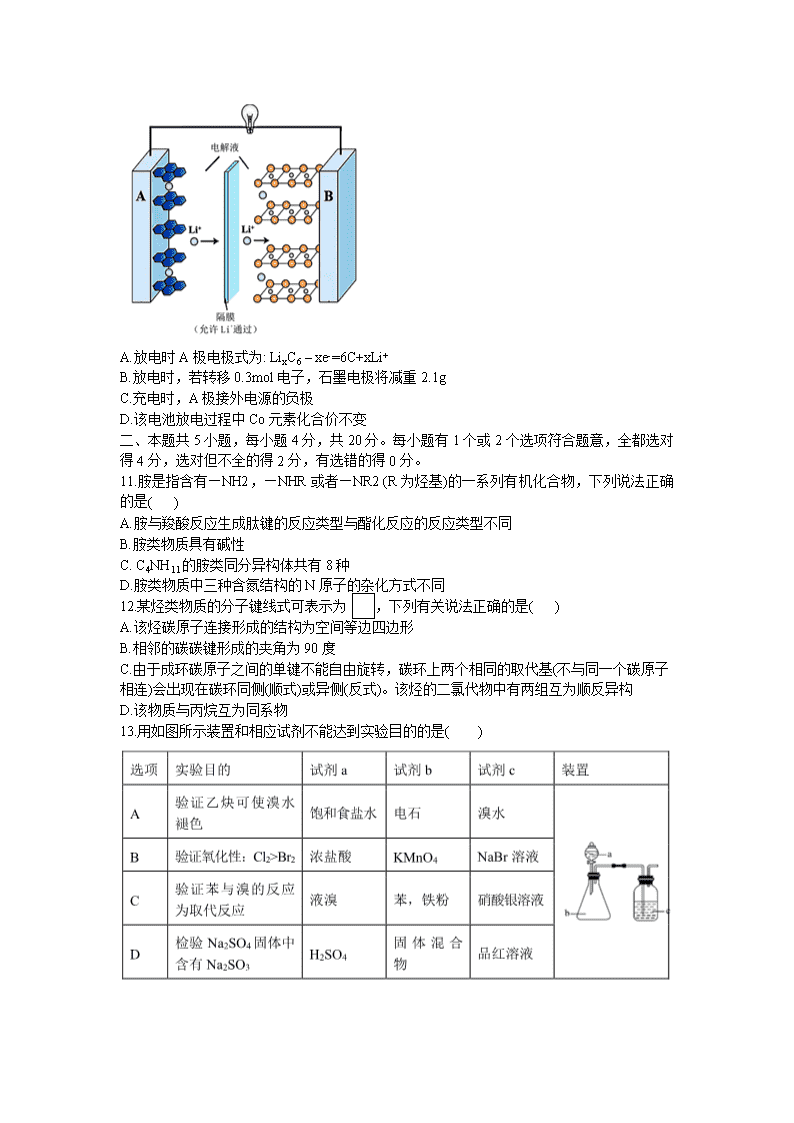
10.2019 年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为
LixC6+Li1- xCoO26C+LiCoO2 (x<1)其工作原理如图所示。下列说法不正确的是( )
A.放电时A极电极式为: LixC6 – xe-=6C+xLi+
B.放电时,若转移0.3mol电子,石墨电极将减重2.1g
C.充电时,A极接外电源的负极
D.该电池放电过程中Co元素化合价不变
二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分。
11.胺是指含有—NH2,—NHR或者—NR2 (R为烃基)的一系列有机化合物,下列说法正确的是( )
A.胺与羧酸反应生成肽键的反应类型与酯化反应的反应类型不同
B.胺类物质具有碱性
C. C4NH11的胺类同分异构体共有8种
D.胺类物质中三种含氮结构的N原子的杂化方式不同
12.某烃类物质的分子键线式可表示为 ,下列有关说法正确的是( )
A.该烃碳原子连接形成的结构为空间等边四边形
B.相邻的碳碳键形成的夹角为90度
C.由于成环碳原子之间的单键不能自由旋转,碳环上两个相同的取代基(不与同一个碳原子
相连)会出现在碳环同侧(顺式)或异侧(反式)。该烃的二氯代物中有两组互为顺反异构
D.该物质与丙烷互为同系物
13.用如图所示装置和相应试剂不能达到实验目的的是( )
14.环已酮()在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如下图所示。下列说法正确的是 ( )
A.a极与电源负极相连
B. a极电极反应式是2Cr3++7H2O -6e-=Cr2O72-+14H+
C. b极发生氧化反应
D.理论上有1mol环己酮生成时,有1mol氢气放出
15.配离子的稳定性可用K相衡量,例如[Ag(NH3)2]+的
在一定温度下,向0.1mol/L硝酸
银溶液中滴入稀氨水,发生反应Ag++2NH3 [Ag(NH3)2]+。溶液中PNH3与(X)的关系如图。
其中PNH3= - lg[c(NH3)]、
(X代表Ag+或[Ag(NH3)2]+)。下列说法正确的是( )
A.图中δ代表的是8([Ag(NH3)2]+)
B.向溶液中滴入稀硝酸, (Ag+)增大
C. K不稳越大表示Ag++2NH3 [Ag(NH3)2]+进行的程度越大
D.该温度时,K不稳([Ag(NH3)2]+)=107.3
第II卷(非选择题共60分)
三、非选择题:本题共5小题,共60分。
16. (12分)碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域。工业上用铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程得到粗碲。
已知TeOSO4为正盐。
(1)已知此工艺中“加压硫酸浸出”过程中会发生以下化学反应: Cu2Te+2O2=2CuO+TeO2;
TeO2+H2SO4=TeOSO4+H2O。“含碲浸出液”的溶质成分除了TeOSO4外,主要是_____
(填化学式)。
(2)操作I的分离方法是___________
(3)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初级阶段阴极的主要电极反应式是____________________________-。
(4)通过图像分析,你认为工业上该过程持续的时段最好是( )。
A、20h B、30h C、35h . D、40h
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后, Te(IV)浓度从 6.72 gL-1下降到0.10gL-1,该过程生成粗碲的离子方程式:_____________________
(6) 25°C时,亚碲酸(H2TeO3) 的Ka1=1×10-3, Ka2=2×10-8。
①0.1 mol·L-1H2TeO3电离度约为_________。 (=已电离弱电解质分子数/弱电解质分子
总数× 100%)
②0.lmol●L-1的NaHTeO3溶液中,下列粒子的物质的量浓度关系正确的是__。
A. c(Na+ )>c(HTeO3 )>c(OH-)>c(H2TeO3)>c(H+ )
B. c(Na+)+c( H+)= c(HTeO3- ) +c(TeO32-) +c(OH- )
C. c(Na+)=c(TeO32-)+c( HTeO3-)+c(H2TeO3)
D. c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-)
17. (12分)氮化镓是一种半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替(如b),顶点和面心的碳原子被Ga原子代替(如a)。
(1)写出N的价电子排布式_____________
(2)基态Ga原子核外电子能量最高的电子所占的能级是
___________________________
(3)与同一个Ga原子相连的N原子构成的空间构型为______
晶胞中离同一个N原子最近的其他N原子个数为_______
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,4原子的分数坐标是( )
a.(0.75,0.25, 0.25) b.(0.25,0.75, 0.75)
c.(0.25,0.75, 0.25) d.(0.75,0.75, 0.75)
(5)GaN晶体中N和N的原子核间距为apm,GaN摩尔质量为Mg·mol-1,阿伏加德罗常数的
值为NA,则GaN晶体的密度为_________g. cm-3 (1pm= 10-12 m)。
(6)现代仪器分析显示H2N2 共有两种同分异构体,且各原子都满足稀有气体稳定结构,试写出在苯中溶解度较好的分子的结构式_______________
(7)下列说法正确的有( )。
A.向CuSO4中通入NH3最终溶液变成深蓝色,说明NH3中N比H2O中O的配位能力强
B.同周期中卤素原子的第一电离能最大
C.根据苯环上Π键形成过程可知,1,3- 丁二烯的命名需要变更
D.手性分子是指含有手性碳的分子
18.(12分)以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(慢反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(快反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
下列表述正确的是___________
A.N2O浓度越高其分解速率越快 B.第一步对总反应速率起决定作用
C.第一步活化能比第三步大 D. IO为反应的催化剂
II.1,2-二氯丙烷(CH2ClCHCICH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2= CHCH2Cl),反应原理为:
①CH2=CHCH3(g)+Cl2(g) CH2ClCHCICH3(g) △H1= -134KJ●mol-1
②CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) △H2= -102KJ●mol-1
请回答下列问题:
(2)已知CH2=CHCH2C(g)+HCl(g) CH2ClCHClCH(g)的活化能 Ea(正)为132KJ●mol-1,则
该反应的活化能Ea(逆)为__________KJ●mol-1。
(3)--定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g),在催化剂作用下发生反应①、②,容器内气体的压强随时间的变化如下表所示。
若用单位时间内气体分压的变化来表示反应速率,即v=∆p/st,则前120min内平均反应速率
v(CH2ClCHClCH3)=________kPa min-1(保留小数点后2位)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。下列说法错误的是__________(填代号)。
a.使用催化剂A的最佳温度约为250°C
b.相同条件下,改变压强会影响CH2CCHCCH3的产率
c.p点是对应温度下CH2ClCHClCH3的平衡产率
d.提高CH2ClCHClCH3反应选择性的关键因素是控制温度
(5)在四个恒容密闭容器中充入相应量的气体(如图):
发生反应2N2O(g) 2N2(g)+O2(g) △H,容器I、II、 II中N2O的平衡转化率如图所示:
容器I、IV的体积为1L,容器IV中的物质也在470°C下进行反应,起始反应速率:
①V正(N2O)_____V逆(N2)。 (填“>”“<”或“=”)
②图中A、B、C三点处容器内密度最小点是__________(填“A”“B”或“C”)。
19. (12 分)某研究小组以乙烯和甲苯为主要原料,设计出医药中间体G的合成路线如下:
(1)物质B含有的官能团名称为_________________
(2) F的分子式为_______-。M是F的某种能发生水解反应的同分异构体,经测定M的核
磁共振氢谱为2组峰且峰面积之比为2:3,且1molM可以消耗4molNaOH,则M的结构简式
为______________。
(3)甲苯是一种重要的化工原料,可以通过石油的催化重整生产。在生产甲苯时,有一种分子式为C10H10的副产物生成。该物质的核磁共振氢谱显示只有一组锋,红外光谱显示其只含有C-C键和C-H键。写出该物质的键线式______,其二氯代物有_____种。
(4)设计出以甲苯为原料制备A的合成路线_______。 (无机试剂任选,己知:
标产物。
20. (12 分)叠氮化钠NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①关闭止水夹K2,打开止水夹K1,开始制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220°C,然后打开止水夹K2,制取并通入N2O。
请回答下列问题:
(1)制取氨气可选择的装置是_____________
(2)步骤①中先通氨气的目的是___________, 步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________,步骤③中最适宜的加热方式为__________
(3)生成NaN3的化学方程式为__________________
(4)反应完全结束后,进行以下操作,得到NaN3固体:
已知NaNH2能与水反应生成NaOH和氨气。操作II的目的是_______,操作IV最好选用的试剂是_____________________________-。
(5)实验室用滴定法测定叠氮化钠样品中NaN;的质量分数:①将2.500g试样配成500.00mL溶
液。②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010molL-1(NH4)2Ce(NO3)6溶液。③
充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲哕啉指示剂,用
0.0500molL-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程
的反应方程式为: 2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑、
Ce4++Fe2+=Ce3++Fe3+,试样中NaN;的质量分数为_________________。