- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第四章 非金属及其化合物 学业分层测评20 二氧化硫和三氧化硫 新人教版必修1
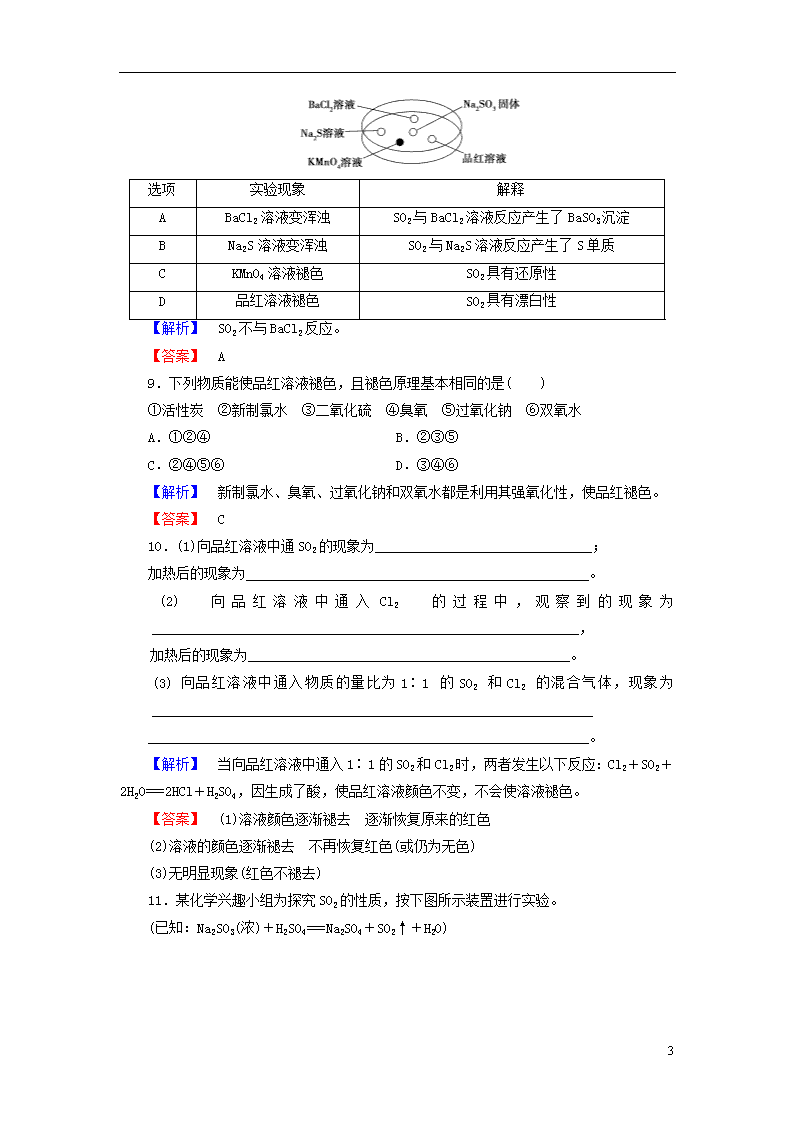
学业分层测评(二十) 二氧化硫和三氧化硫 (建议用时:45分钟) [学业达标] 1.下列说法不正确的是( ) A.硫是一种淡黄色的能溶于CS2的晶体 B.硫的化合物常存在于火山喷出的气体中和矿泉水里 C.化石燃料直接燃烧会产生对大气有严重污染的SO2气体 D.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3 【解析】 硫与氧气反应的产物为SO2,与氧气的量及浓度大小无关。 【答案】 D 2.洗涤附着在试管内壁上的硫黄,可选用的方法是( ) A.用CS2洗涤 B.用澄清石灰水洗涤 C.用饱和食盐水洗涤 D.用水洗涤 【答案】 A 3.下列物质能将品红氧化使品红溶液褪色的是( ) ①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧 A.①②③④⑤ B.②③④⑤ C.②③④ D.②③⑤ 【解析】 活性炭具有吸附性,不是氧化性,①错误;过氧化钠具有强氧化性,能把品红溶液氧化而褪色,②正确;氯水具有强氧化性,能把品红溶液氧化而褪色,③正确;二氧化硫使品红溶液褪色的原理不是氧化,④错误;臭氧具有强氧化性,能把品红溶液氧化而褪色,⑤正确。 【答案】 D 4.下列反应中,能说明SO2是酸性氧化物的是( ) A.SO2+Na2O===Na2SO3 B.SO2+2H2S===3S↓+2H2O C.2Fe3++SO2+2H2O===2Fe2++4H++SO D.SO2+H2O2===H2SO4 【解析】 酸性氧化物的通性是与碱反应生成盐和水,与碱性氧化物反应生成含氧酸盐等。Na2O是碱性氧化物,与SO2反应生成Na2SO3,说明SO2是酸性氧化物,A项符合题意;B、C、D三项是氧化还原反应,其中B项中SO2被还原,说明SO2具有氧化性,C、D两项中SO2被氧化,说明SO2具有还原性,与题意不符。 【答案】 A 7 5.下列对SO2和SO3的叙述正确的是( ) A.通常条件下,都是无色气体,都易溶于水 B.都是酸性氧化物,其水溶液都是强酸 C.都可使品红溶液褪色,加热时红色又能再现 D.都能跟碱溶液反应 【解析】 在通常条件下,SO3是无色固体。SO2溶于水得到的是中强酸(H2SO3)。SO2能使品红溶液褪色,加热时红色复现,SO3则不能。但SO2和SO3都是酸性氧化物,都能跟碱溶液反应,故选D项。 【答案】 D 6.能证明SO2具有漂白性的是( ) A.酸性KMnO4溶液中通入SO2气体后紫红色消失 B.滴有酚酞的NaOH溶液中通入SO2气体后红色消失 C.品红溶液中通入SO2气体后红色消失 D.溴水中通入SO2气体后橙色消失 【解析】 酸性KMnO4溶液中通入SO2气体后紫红色消失、溴水中通入SO2后橙色消失都是利用了SO2的还原性;滴有酚酞的NaOH溶液红色消失是因为通入的SO2气体与碱反应,使溶液碱性消失;品红溶液中通入SO2气体后红色消失证明SO2具有漂白性。 【答案】 C 7.下列实验报告记录的实验现象正确的是( ) 实验 记 录 A 无色 无色 白色沉淀 无色溶液 B 红色 无色 白色沉淀 白色沉淀 C 红色 无色 无色溶液 白色沉淀 D 无色 无色 无色溶液 无色溶液 【解析】 SO2能够使紫色石蕊试液变成红色,使品红溶液褪色;SO2通入Ba(NO3)2溶液中,在酸性环境中会被氧化成SO,从而得到BaSO4白色沉淀;SO2通入到NaOH和BaCl2的混合溶液中发生反应:SO2+2NaOH===Na2SO3+H2O;Na2SO3+BaCl2===BaSO3↓+2NaCl,生成白色沉淀,故B项正确。 【答案】 B 8.如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。下表中对实验现象的描述或所做的解释不正确的是( ) 7 选项 实验现象 解释 A BaCl2溶液变浑浊 SO2与BaCl2溶液反应产生了BaSO3沉淀 B Na2S溶液变浑浊 SO2与Na2S溶液反应产生了S单质 C KMnO4溶液褪色 SO2具有还原性 D 品红溶液褪色 SO2具有漂白性 【解析】 SO2不与BaCl2反应。 【答案】 A 9.下列物质能使品红溶液褪色,且褪色原理基本相同的是( ) ①活性炭 ②新制氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水 A.①②④ B.②③⑤ C.②④⑤⑥ D.③④⑥ 【解析】 新制氯水、臭氧、过氧化钠和双氧水都是利用其强氧化性,使品红褪色。 【答案】 C 10.(1)向品红溶液中通SO2的现象为_______________________________; 加热后的现象为_________________________________________________。 (2)向品红溶液中通入Cl2的过程中,观察到的现象为_____________________________________________________________, 加热后的现象为______________________________________________。 (3)向品红溶液中通入物质的量比为1∶1的SO2和Cl2的混合气体,现象为_______________________________________________________________ _______________________________________________________________。 【解析】 当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O===2HCl+H2SO4,因生成了酸,使品红溶液颜色不变,不会使溶液褪色。 【答案】 (1)溶液颜色逐渐褪去 逐渐恢复原来的红色 (2)溶液的颜色逐渐褪去 不再恢复红色(或仍为无色) (3)无明显现象(红色不褪去) 11.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。 (已知:Na2SO3(浓)+H2SO4===Na2SO4+SO2↑+H2O) 7 请回答下列问题: (1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。 (2)反应后,装置B中发生的现象是__________________________________ _____________________________________________________________; 反应的离子方程式为____________________________________________; 装置C中的现象是______________________________________________, 表现了SO2的________;装置D中现象是_____________________________ ______________________________________________________________, 发生反应的化学方程式为_________________________________________。 (3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_______________________________________________________________。 (4)F装置的作用是______________________________________________, 漏斗的作用是___________________________________________________。 【解析】 浓硫酸与Na2SO3发生反应Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,SO2能使氯水及酸性KMnO4溶液褪色,在反应中SO2表现还原性;SO2与装置D中的H2S发生反应SO2+2H2S===3S↓+2H2O,从而使溶液变浑浊,该反应中SO2表现氧化性;SO2能使品红溶液褪色,但加热后溶液又恢复红色,说明SO2与品红溶液的作用具有可逆性;装置F用于吸收多余的SO2,因为SO2易与NaOH溶液反应,因此采用倒扣漏斗吸收SO2可防止液体倒吸。 【答案】 (1)分液漏斗 圆底烧瓶 (2)溶液褪色 SO2+Cl2+2H2O===4H++2Cl-+SO 溶液紫色褪去(溶液褪色) 还原性 有黄色沉淀生成 2H2S+SO2===3S↓+2H2O (3)将试管E在酒精灯上加热,溶液恢复红色 (4)吸收多余的SO2 防止倒吸 12.如图是一套检验气体性质的实验装置。根据要求回答下列问题。 7 A B C D X 氯气 二氧化硫 二氧化碳 氯化氢 Y Na2SO3溶液 饱和NaHCO3溶液 Na2SO3溶液 饱和NaHSO3溶液 (1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y可能的组合是________。(填字母,下同) (2)若打开活塞K品红溶液褪色,同时澄清石灰水变浑浊,则判断气体X和洗气瓶内液体Y可能的组合是________。 【解析】 (1)当关闭K时,气体X必须经过洗气瓶,A中Cl2被Na2SO3溶液吸收发生反应Cl2+Na2SO3+H2O===Na2SO4+2HCl,不能使品红溶液褪色;B中SO2溶于水生成H2SO3,再和NaHCO3反应生成CO2,但不能使品红溶液褪色;C中CO2经过Na2SO3溶液不反应,同时CO2也不能使品红溶液褪色;D中HCl与NaHSO3发生如下反应:HCl+NaHSO3===NaCl+H2O+SO2,产生的SO2通入品红溶液中,品红溶液褪色。 (2)当打开K时,气体X不通过洗气瓶直接进入品红溶液中,Cl2、SO2均可使品红溶液褪色,但Cl2不能使澄清的石灰水变浑浊,SO2能使澄清的石灰水变浑浊。 【答案】 (1)D (2)B [能力提升] 13.往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( ) A.该实验表明FeCl3有还原性 B.白色沉淀为BaSO3 C.该实验表明SO2有漂白性 D.反应后溶液酸性增强 【解析】 A项,该实验表明FeCl3有氧化性;B项,白色沉淀为BaSO4;C项,该实验表明SO2有还原性;D项,反应后有H+生成,溶液酸性增强。 【答案】 D 14.为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。 7 (1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol/L)为原料制取Cl2。在此实验中,F仪器的作用是________;气体发生装置B应选择以下三种装置中的________(填序号)。 (2)D装置中主要反应的离子方程式为_______________________________ ____________________________________________________________。 (3)为验证通入D装置中的气体是Cl2过量还是SO2过量,兴趣小组的同学准备了以下试剂: ①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液 若Cl2过量,取适量D中溶液滴加至盛有________(填一个序号)试剂的试管内,再加入________(填一个序号)试剂。发生的现象是________。若SO2过量,取适量D中溶液滴加至盛有________(填一个序号)试剂的试管内,发生的现象是_________________________________________________________________。 【解析】 (1)由实验装置可知,气体发生装置B产生的气体用饱和食盐水进行除杂净化,可知B装置为制取Cl2装置,则A装置为制取SO2的装置,因SO2易溶于水,故F仪器的作用为防倒吸。制取Cl2所用试剂为MnO2和浓盐酸,属于固、液混合加热制取气体,故应选①装置为气体发生装置B。(2)当Cl2和SO2同时通入水中时,Cl2将SO2氧化在水溶液中生成H2SO4,Cl2在水中被还原为HCl。(3)若Cl2过量,则在D中溶液中除含H2SO4、HCl外,还含有剩余Cl2及HClO,具有强氧化性,可将Fe2+氧化为Fe3+,故可选择②、③进行检验;若SO2过量,则在D中溶液中会含有SO2、H2SO3,SO2具有漂白性和还原性,故可选用④或⑤进行检验。 【答案】 (1)防倒吸 ① (2)Cl2+SO2+2H2O===4H++SO+2Cl- 7 (3)② ③ 溶液呈红色 ④(或⑤) 红色褪去为无色,加热后又变为红色(或紫红色褪为无色) 7查看更多