- 2021-07-02 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学新人教版 B3-1-2原子结构与元素性质(1)
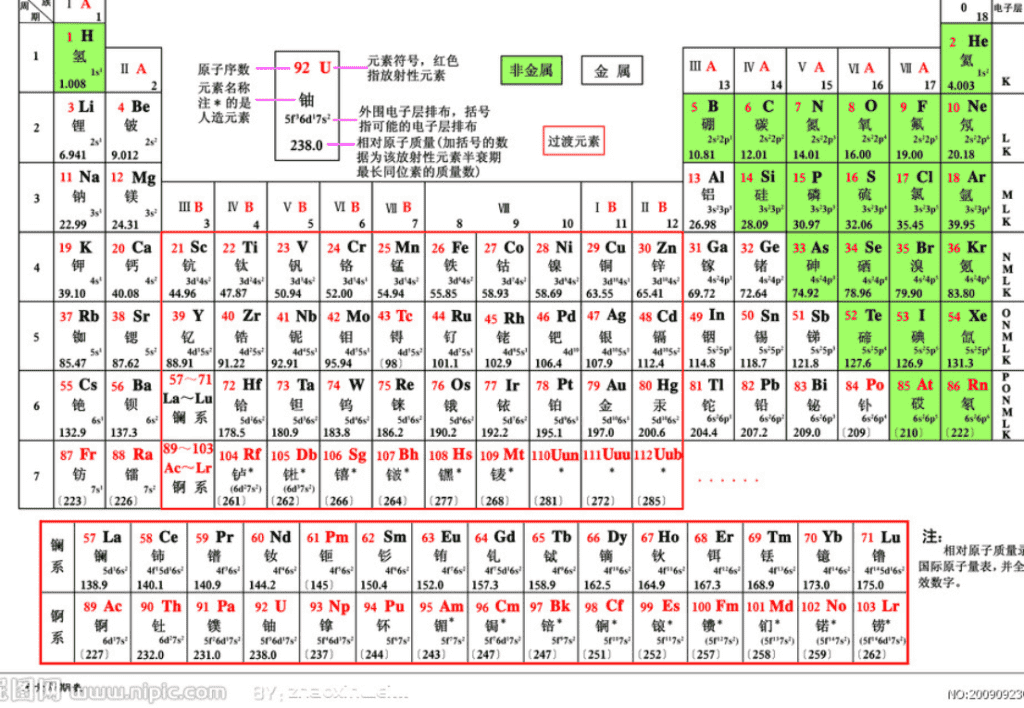
原子结构与元素的性质 第一课时 第二节 周期 短周期 长周期 第 1 周期 (H--He) : 2 种元素 第 2 周期 (Li--Ne) : 8 种元素 第 3 周期 (Na-- Ar ) : 8 种元素 第 4 周期 (K--Kr) : 18 种元素 第 5 周期 ( Rb--Xe ) : 18 种元素 第 6 周期 (Cs-- Rn ) : 32 种元素 不完全周期 第 7 周期: 26 种元素 镧 57 La – 镥 71 Lu 共 15 种元素称镧系元素 锕 89 Ac – 铹 103 Lr 共 15 种元素称锕系元素 周期序数 = 电子层数 (横行) 知识回顾: 元素周期表的结构(由 周期 与 族 构成) ( 应 32 种 ) 族 主 族: 副 族: ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第 VIII 族: 稀有气体元素 主族序数 = 最外层电子数 (纵行) 零族: 共七个主族 ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族 三个纵行 ( 第 8 、 9 、 10 ),位于 Ⅶ B 与 ⅠB 中间 知识回顾: 元素周期表的结构 (由 周期 与 族 构成) 元素周期表从 左到右族顺序依次 为: ⅠA , ⅡA , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB , 第 VIII 族 ; ⅠB , ⅡB , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA , 零族 ___________________________ ___________________________ 1 、 写出每个周期开头第一个元素的最外层电子的排布式? ns 1 (n 表示电子层数 ) 第一周期: s 2 其它周期: ns 2 np 6 (n 为电子层数 ) 2 、 写出每个周期最后一个元素的最外层电子的排布式? 科 学 探 究:书 14 3 、 同族主族元素的价电子层有何规律? 相同 4 、同族 过渡元素的价电子层有何规律? 价电子层上的电子总数相等 5 、 零族元素的价电子层有何规律? 除氦外,其它相同 一、元素周期表的 重新 分区 1 、 s 区: 特点: 价电子数 = 主族序数 = 最外层电子数 ①并不是所有价电子层为 ns 1 或 2 的元素都在 S 区, He 除外(它在 p 区) 注意: ②除 H 外,都是金属元素 含 ⅠA 与 ⅡA 共两族两列 ;价电子层为 ns 1 或 2 (n ≥ 1) 一、元素周期表的 重新 分区 2 、 p 区: 特点: ①价电子总数 = 主族序数(零族除外) 注意: He 在 p 区,但它无 p 电子 含 Ⅲ A 至 Ⅶ A 及零族 共六族六列 ;价电子层为 ns 2 np 1-6 (n ≥ 2) , ②以非金属元素为主 一、元素周期表的 重新 分区 3 、 d 区: 特点: ②价电子总数 = 副族序数 ; 若总数为 8 、 9 、 10 ,则为 Ⅷ 族。 有元素在 d 区但并不符合 (n-1)d 1-9 ns 1-2 规则,如: 46 Pd 4d 10 。 注意: ①均为金属元素; 含 Ⅲ B 至 Ⅶ B 和 Ⅷ 族 共六族八列 ( 镧系和锕系属 f 区 ) ;价电子层为 (n-1)d 1-9 ns 1-2 一、元素周期表的 重新 分区 4 、 ds 区:含 ⅠB 与 ⅡB 共两族两列 ;可理解为电子先填满 (n-1)d (n ≥ 4) ,再填 ns, 即价电子层为 (n-1)d 10 ns 1 或 2 , ① 价电子总数 = 所在的列序数 特点 : ②均 为金属元素;且 d 轨道电子一般不参与化学键的形成。 一、元素周期表的 重新 分区 5 、 f 区:包括镧系与锕系; 价电子层 (n-2)f 0-14 (n-1)d 0-2 ns 2 说明: 由于最外层电子数基本相同, (n-1)d 电子数也基本相同,因此镧系元素化学性质相似;锕系元素化学性质也相似。 ⅠA 0 1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 p 区 3 s 区 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB 4 d 区 ds 区 5 6 7 镧系 f 区 锕系 元素周期表的五个分区 问 : 为什么 s 区、 d 区、 ds 区的元素 都是金属 ( 除 H 外 ) ? s 区、 d 区、 ds 区的元素最外层电子数为 1-2 个电子,在反应中易失去,所以都是金属。 原子结构与元素在周期表中的位置是有什么的关系的? ( 1 )周期数 = 最大能层数 (钯除外, 因为 46 Pd [Kr]4d 10 , 最大能层数是 4 ,但是在第五周期) 这些你知道吗? ( 2 )外围电子总数决定排在哪一族 如: 29 Cu 3d 10 4s 1 10+1=11 (第 11 列) 所以,是 IB 。 5 、已知某元素在周期表中位于第五周期、 ⅥA 族位置上。试写出该元素基态原子的 价电子排布式、 电子排布式并分析该元素在哪区? 由于是 ⅥA 族, 4d 必是全充满的, 所以 价电子排布为 5s 2 5p 4 , 电子排布式 [Kr]4d 10 5s 2 5p 4 课堂练习 属 P 区 1. 已知某元素的价电子层结构为 3d 5 4s 2 , 试确定其在周期表中的位置。 第四周期, ⅦB 族。 典例: 2. 试确定 32 号元素在周期表 中的位置。 第四周期, ⅣA 族 典例: 3. 判断处于第三周期, ⅣA 族元素的 价电子层结构、原子序数。 3s 2 3p 2 , 第 14 号元素 典例: 下列说法错误的是( ) A. S 区元素的原子价电子层排布都是 s 结尾 B. d 区元素的原子价电子层排布都是 ds 结尾 C. ds 元素的原子价电子层排布都是 ds 结尾 D. p 区元素的原子价电子层排布都是 sp 结尾 E. 主族元素的原子价电子层排布都含 s ,但都 不含 d F. 过渡元素的原子价电子层排布都是 ds 结尾 G. ds 区元素的原子 d 轨道一定全满 BDF查看更多