2020届二轮复习电解质溶液作业(全国通用)(3)
电解质溶液
1.下列说法中,不正确的是( )
A.25 ℃时,AgCl固体在等物质的量浓度的NaCl和CaCl2溶液中的溶度积相同
B.浓度为0.1 mol·L-1的Na2CO3溶液中:c(Na+)>2c(CO)
C.一定温度下,pH=6.5的纯水显中性
D.向冰醋酸中逐滴滴加水,溶液的导电性、醋酸的电离程度和pH均先增大后减小
答案:D 解析:加水稀释冰醋酸,能促进醋酸电离,所以醋酸的电离程度一直增大,溶液中氢离子浓度先增大,当增大到一定程度后,再继续加水稀释,氢离子浓度逐渐减小,所以溶液的pH先减小后增大,溶液的导电性是先增大后减小,D项错误。
2.已知pOH=-lgc(OH-)。t ℃时,往50 mL 0.1 mol·L-1 MOH溶液中滴加0.1 mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法中正确的是( )
A.a=12
B.盐酸与MOH溶液恰好中和时溶液pH=6.5
C.滴入盐酸体积达26.0 mL时,溶液中微粒浓度c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
D.t ℃时,MOH的Kb>1.0×10-3
答案:D 解析:根据图示,由滴加25.0 mL 0.1 mol·L-1盐酸时pH=pOH=6.5,可知Kw=10-13,0.1 mol·L-1MOH溶液的pOH=2,则pH=11,A项错误;0.1 mol·L-1MOH溶液的pOH=2,可知MOH是弱碱,盐酸与MOH溶液恰好中和时溶液呈酸性,pH<6.5,B项错误;滴入盐酸体积达26.0 mL时,溶液中的溶质是MCl、MOH,且c(MCl)>c(MOH),溶液呈酸性,MCl水解程度>MOH电离程度,所以c(MOH)>c(H+)>c(OH-),C项错误;t ℃时,MOH的Kb==>10-3,D项正确。
3.H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根离子、酸根离子)的组成分数如图所示。
下列说法中正确的是( )
A.HX-的电离程度小于其水解程度
B.在pH=7的溶液中HX-和X2-能大量共存
C.在pH=9时,H2X与NaOH恰好完全中和
D.1 L 0.1 mol·L-1 Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
答案:A 解析:NaOH溶液加入到H2X溶液中,发生反应:NaOH+H2X===NaHX+H2O、NaHX+NaOH===Na2X+H2O。根据图像pH=9时溶质为NaHX,此时溶液显碱性,说明HX-的电离程度小于其水解程度,A项正确;根据图像pH=7时,溶质为H2X和NaHX,B项错误;根据图像,当pH=14时,应恰好完全反应,C项错误;根据物料守恒,n(HX-)+n(X2-)+n(H2X)=0.1 mol,D项错误。
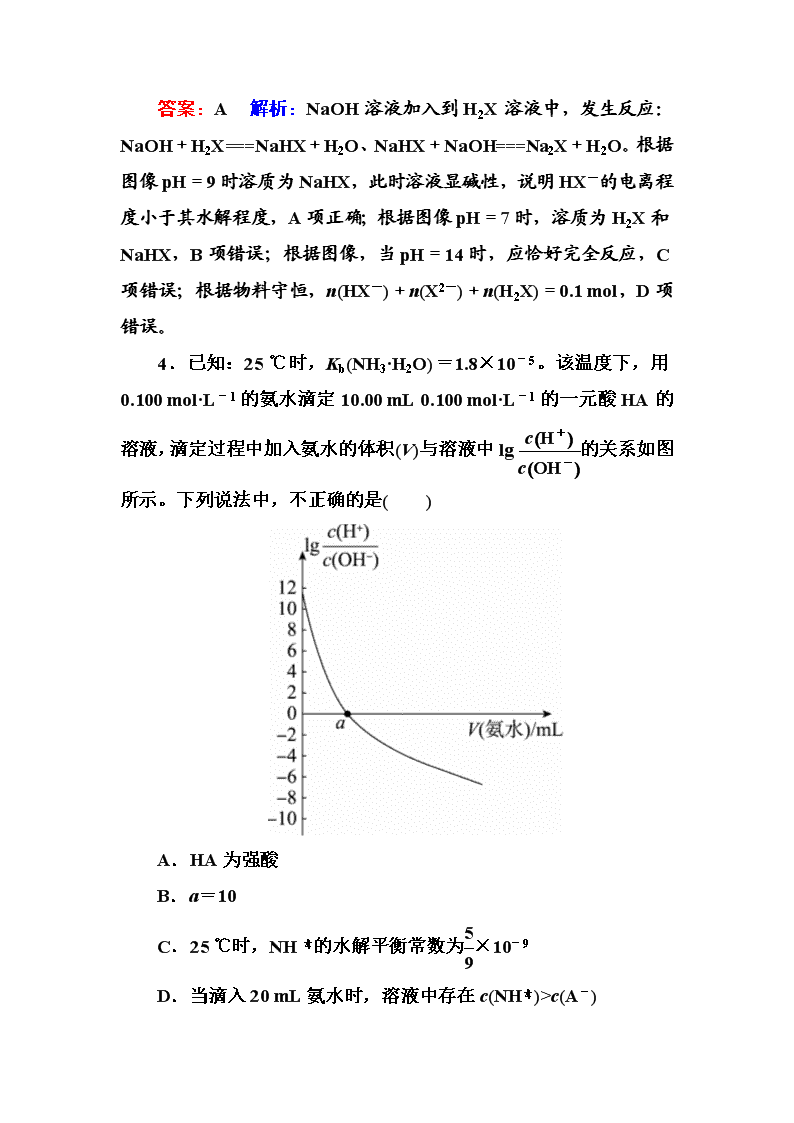
4.已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100 mol·L-1的氨水滴定10.00 mL 0.100 mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg的关系如图所示。下列说法中,不正确的是( )
A.HA为强酸
B.a=10
C.25 ℃时,NH的水解平衡常数为×10-9
D.当滴入20 mL氨水时,溶液中存在c(NH)>c(A-)
答案:B 解析:25 ℃时,0.100 mol·L-1的一元酸HA的溶液中lg=12,结合水的离子积常数可知溶液中H+浓度为0.1 mol·L-1,A项正确;lg=0时溶液显中性,二者恰好反应时溶质为NH4A,此时溶液呈酸性,氨水应略过量,即a>10,B项错误;25 ℃时,NH的水解平衡常数为Kw/Kb=×10-9,C项正确;当滴入20 mL氨水时,氨水过量,溶液显碱性,根据电荷守恒可知,溶液中c(NH)>c(A-),D项正确。
5.常温下,Ka(CH3COOH)=1.8×10-5,分别向20 mL 0.1 mol·L-1 NaHCO3溶液和CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,滴定曲线如图所示,下列叙述正确的是( )
A.a点溶液中存在:c(Na+)+c(H+)=c(HCO)+c(CO)+c(OH-)
B.b、d点溶液中离子浓度的大小关系均为c(Na+)
c(H+)+0.1 mol· L-1,即c(HCOO-)+c(HCOOH)+c(OH-)>c(H+)+0.1 mol·L-1,B项错误;298 K时,加蒸馏水稀释P点溶液,溶液中c(H+)·c(OH-)=Kw,保持不变,但加水稀释,可同时促进HCOOH的电离和HCOONa的水解,n(H+)和n(OH-)都增大,故n(H+)·n(OH-)增大,C项正确;0.1 mol·L-1 HCOONa溶液和0.1 mol·L-1 HCOOH溶液等体积混合后,虽然混合溶液中c(HCOO-)+c(HCOOH)=0.100 mol·L-1,但由于HCOOH的电离程度大于HCOONa的水解程度,混合溶液中c(HCOO-)>c(HCOOH),故溶液的pH不等于3.75,D项错误。
7.常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是( )
A.常温下,Ka(CH3COOH)=10-5
B.a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1 mol·L-1NaF溶液的pH小于0.1 mol·L-1 CH3COONa溶液的pH
D.向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中,=10(pKa-pH)
答案:D 解析:根据b点信息,可知pH=5时,lg=0,即=1,所以Ka(CH3COOH)==c(H+)=10-5,A项正确;a点时,pH=4,c(H+)>c(OH-),lg=0,则c(F-)=c(HF),根据电荷守恒有c(F-)+c(OH-)=c(H+)+c(Na+),则c(F-)>c(Na+),所以c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),B项正确;根据a点和b点信息可知,Ka(HF)=c(H+)=10-4>Ka(CH3COOH)=c(H+)=10-5,越弱越水解,所以同浓度的NaF溶液和CH3COONa溶液,后者水解程度较大,pH较大,C项正确;根据Ka(CH3COOH)=可知,===10(pH-pKa),D项错误。
8.298 K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是( )
A.溶液呈中性时:c(Na+)=2c(X2-)
B.Ka2(H2X)为10-7
C.NaHX溶液中:c(H+)c(OH-),C项错误;溶液pH由1升至2.6时,从图中看出主要是将H3X+转化为H2X,D项错误。
9.高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是( )
A.已知H3FeO的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH=4时,溶液中=1.2
B.为获得尽可能纯净的高铁酸盐,应控制pH≥9
C.向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO+OH-===FeO+H2O
D.pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO)>c(HFeO)
答案:A 解析:H3FeO的电离平衡常数K2=4.8×10-4,当pH=4时,溶液中==4.8,A项错误;pH≥9时,高铁酸盐的物质的量分数接近100%,则为获得尽可能纯净的高铁酸盐,应控制pH≥9,B项正确;向pH=5的高铁酸盐溶液中(根据图示可以看出其中含有HFeO)加入KOH溶液,发生反应的离子方程式为HFeO+OH-===FeO+H2O,C项正确;由图像纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO)>c(HFeO),D项正确。
10.生产上用过量烧碱溶液处理某矿物(含Al2O3
、MgO),过滤后得到的滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的物质的量随加入NaHCO3溶液体积变化的曲线如下:
下列有关说法中,不正确的是( )
A.原NaHCO3溶液中c(H2CO3)+c(HCO)+c(CO)=0.8 mol·L-1
B.a点水的电离程度小于c点水的电离程度
C.a点溶液中存在:c(Na+)+c(H+)=c(AlO)+c(OH-)
D.生成沉淀的离子方程式为HCO+AlO+H2O===Al(OH)3↓+CO
答案:A 解析:据图可知,加入40 mL NaHCO3溶液时生成沉淀最多,沉淀为0.032 mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH-+HCO===CO+H2O、HCO+AlO+H2O===Al(OH)3↓+CO,并结合图像可知,加入前8 mL NaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)==1.0 mol·L-1,所以c(H2CO3)+c(HCO)+c(CO)=1.0 mol·L-1,A项错误;a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3
溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,B项正确;a点对应的溶液为加入过量烧碱溶液过滤后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱溶液过滤后所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO)+c(OH-),C项正确;由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为HCO+AlO+H2O===Al(OH)3↓+CO,D项正确。
11.已知298 K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;pNi=-lg c(Ni2+),pB=-lg c(S2-)或-lg c(CO)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀(温度升高,NiS、NiCO3的Ksp均增大),298 K时,溶液中阳离子、阴离子浓度的负对数关系如图所示。下列说法不正确的是( )
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线Ⅰ,在b点加热(忽略蒸发),b点向c点移动
D.M为3.5且对应的阴离子是CO
答案:C 解析:298 K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7,NiS、NiCO3属于同种类型,常温下NiCO3
的溶解度大于NiS,A正确;Ksp(NiS)Ksp(BaCO3)
B.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C.若使0.05 mol BaSO4全部转化为BaCO3,至少要加入1.25 mol Na2CO3
D.0.05 mol BaSO4恰好全部转化为BaCO3
时,溶液中离子浓度大小为c(CO)>c(SO)>c(OH-)>c(Ba2+)
答案:D 解析:在M点,存在BaSO4和BaCO3的溶解平衡,Ksp(BaSO4)=c(Ba2+)·c(SO)=1×10-5×(1×10-5)=10-10,Ksp(BaCO3)=c(Ba2+)·c(CO)=1×10-5×( 2.5×10-4)=2.5×10-9,Ksp(BaSO4)c(SO)>c(OH-)>c(Ba2+),D项正确。