- 2021-07-02 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高二化学第十一章 金属及其化合物复习学案(一)
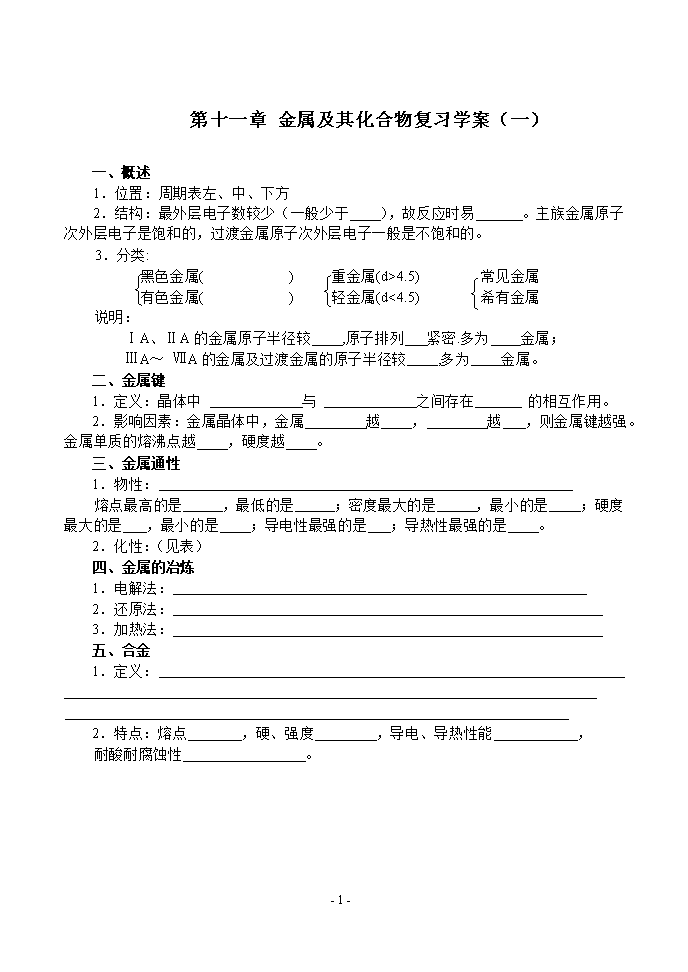
第十一章 金属及其化合物复习学案(一) 一、概述 1.位置:周期表左、中、下方 2.结构:最外层电子数较少(一般少于 ),故反应时易 。主族金属原子次外层电子是饱和的,过渡金属原子次外层电子一般是不饱和的。 3.分类: 黑色金属( ) 重金属(d>4.5) 常见金属 有色金属( ) 轻金属(d<4.5) 希有金属 说明: ⅠA、ⅡA的金属原子半径较 ,原子排列 紧密.多为 金属; ⅢA~ ⅦA的金属及过渡金属的原子半径较 ,多为 金属。 二、金属键 1.定义:晶体中 与 之间存在 的相互作用。 2.影响因素:金属晶体中,金属 越 , 越 ,则金属键越强。金属单质的熔沸点越 ,硬度越 。 三、金属通性 1.物性: 熔点最高的是 ,最低的是 ;密度最大的是 ,最小的是 ;硬度最大的是 ,最小的是 ;导电性最强的是 ;导热性最强的是 。 2.化性:(见表) 四、金属的冶炼 1.电解法: 2.还原法: 3.加热法: 五、合金 1.定义: 2.特点:熔点 ,硬、强度 ,导电、导热性能 , 耐酸耐腐蚀性 。 - 3 - 金属活动顺序 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 单质还原性 减弱 离子氧化性 增强(其中) 与O2反应 常温反应,不成膜, 保存在煤油中 常温生膜, 高温燃烧 常温不易反应 高温:Zn、Fe燃、Sn、Pb、Cu也能化合 汞加热化合,强热分解 不反应 与H2O 反应 反应情况 常温剧烈反应 只能与沸水的反应 只能与水蒸气反应 不反应 反应产物 碱 + H2 碱 + H2 氧化物 + H2 与酸反应 能置换出酸中的氢 不反应 与氧化性酸反应 它们与氧化性酸反应均不生成H2。其中, Fe、Al在常温下被浓H2SO4和浓HNO3钝化 只溶水 王水 氧化物与水反应 剧烈反应 缓慢 反应 不溶于水,与水不直接化合 氢氧化物性质 可溶于水,强碱,受热气化而不分解 不溶 于水; 中强碱 受热易分解 不溶于水; 两性;受 热易分解 难溶于水、弱碱、受热易分解 常温即分解 / 一般冶炼法 电解法 还原法 加热法 / [知识训练] 1.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知a、c均能与稀H2SO4反应放出气体;b与d的硝酸盐反应置换出单质d;c与强碱反应放出气体;c、e在冷浓硫酸中被钝化。由此可判断a、b、c、d、e依次为 A、Fe Cu Al Ag Mg B、Al Cu Mg Ag Fe C、Mg Cu Al Ag Fe D、Mg Ag Al Cu Fe 2.某溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子(阴离子略),现进行如下实验(所加入的试剂都过量): 沉淀B 溶液A 沉淀D 待测液 沉淀C 溶液B 溶液D沉淀E - 3 - 溶液C 沉淀A(不溶于硝酸) ⑴肯定含有的离子 。 ⑵待测液中是否有Ba2+、Ca2+ ,因为 。 ⑶待测液中是否含有Fe3+ ,怎样才能确定? 。 - 3 -查看更多