- 2021-07-02 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高中化学 专题4 课题一 硫代硫酸钠与酸反应速率的影响因素同步课时限时训练
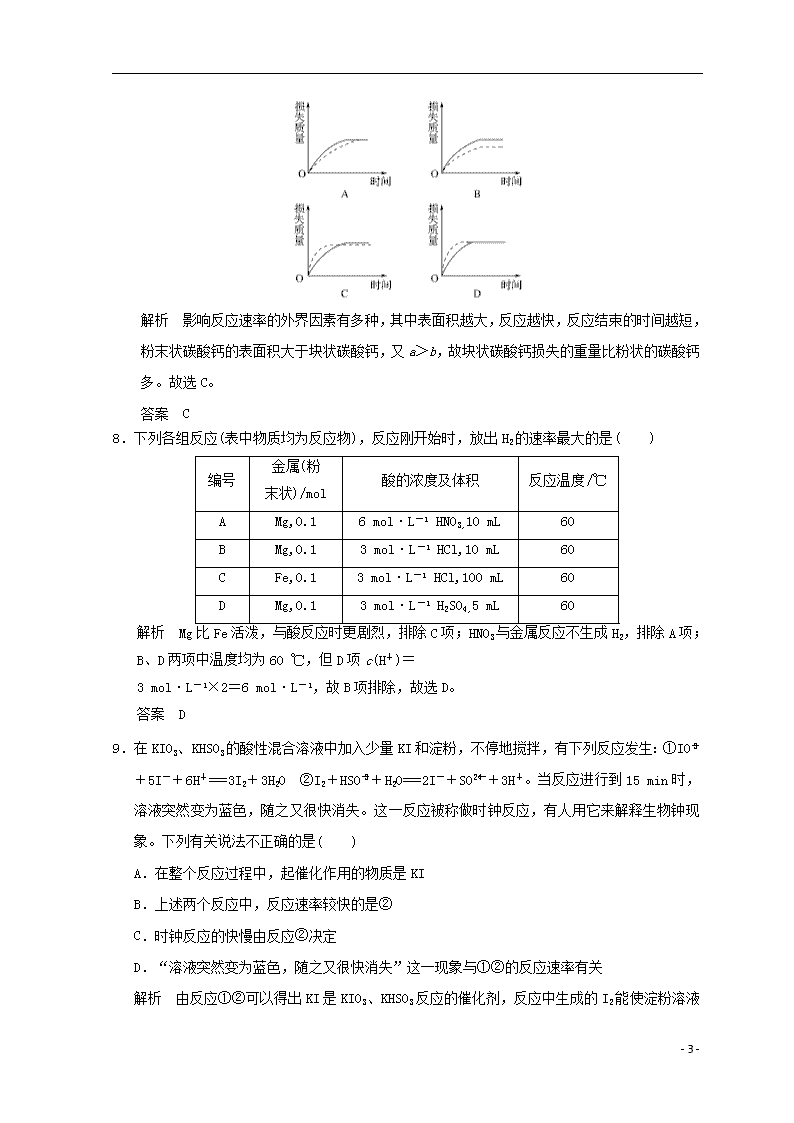
课题一 硫代硫酸钠与酸反应速率的影响因素 (时间:45分钟) 1.通过控制或改变反应条件可以加快或减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活质量的提高。下列各图所示的措施中,能加快化学反应速率的是( ) 解析 A、B、D采取的措施是使化学反应速率减慢。 答案 C 2.决定化学反应速率的主要因素是( ) A.参加反应的物质本身的性质 B.催化剂 C.温度、压强以及反应物的接触面积 D.反应物的浓度 解析 参加反应的物质的性质是决定化学反应速率的主要(决定性)因素。外界条件浓度、温度、压强、催化剂等是外因。 答案 A 3.将质量相同的锌粉分别投入下列4个烧杯的溶液中,反应速率最快的是( ) 解析 当反应中一种反应物相同时,反应速率的快慢取决于另一种反应物的浓度而不是用量,四个装置中所用的酸虽不同,但都是由c(H+)的大小决定反应的快慢。 答案 D 4.对于反应:M+N―→P,如果温度每升高10 ℃,化学反应速率提高到原来的3倍,在10 ℃时完成反应的10%需要81 min,将温度提高到30 ℃时,完成反应的10%需要的时间为( ) A.9 min B.27 min C.13.5 min D.3 min - 7 - 解析 温度由10 ℃升高到30 ℃时,反应速率提高到原来的32倍,设当提高到30 ℃时,完成反应的10%需要的时间为t min,则32t=81 min,故t=9 min。 答案 A 5.对于溶液中的反应:MnO+5Fe2++8H+===5Fe3++Mn2++4H2O 下列措施能使化学反应速率提高的是( ) A.加水 B.增加同浓度FeSO4的用量 C.向溶液中滴加稀硫酸 D.加入少量KMnO4晶体 解析 增大浓度加快反应速率,而增加反应物用量不等于增大反应物浓度。D项加入KMnO4晶体后,KMnO4晶体被溶解,溶液的浓度一定比原KMnO4溶液浓度大。 答案 D 6.下列不同条件下的化学反应A+B===C+D,反应速率由大到小顺序正确的一组是( ) ①常温下20 mL含A和B各0.001 mol的混合液发生反应 ②常温下100 mL含A和B各0.01 mol的混合液发生反应 ③常温下10 mL含A和B各0.05 mol·L-1的溶液再加入蒸馏水30 mL发生反应 ④常温下100 mL含A 0.01 mol和B 0.005 mol的混合液发生反应 A.①②③④ B.④③②① C.②④①③ D.②①④③ 解析 根据题意可知,其他条件相同,只有A、B的浓度不同。将题目给出的A、B不同的量转化为物质的量浓度进行比较。①中A、B物质的量浓度均为0.05 mol·L-1;②中A、B物质的量浓度均为0.1 mol·L-1;③中A、B物质的量浓度均为0.012 5 mol·L-1;④中A物质的量浓度为0.1 mol·L-1,B物质的量浓度为0.05 mol·L-1。即浓度的大小顺序为②>④>①>③,其速率顺序与之相同,C选项符合题意。 答案 C 7.将a g块状碳酸钙跟足量的盐酸反应,反应中损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将b g(a>b)粉末碳酸钙与同浓度的盐酸反应,则相应的曲线(图中虚线所示)正确的是( ) - 7 - 解析 影响反应速率的外界因素有多种,其中表面积越大,反应越快,反应结束的时间越短,粉末状碳酸钙的表面积大于块状碳酸钙,又a>b,故块状碳酸钙损失的重量比粉状的碳酸钙多。故选C。 答案 C 8.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( ) 编号 金属(粉 末状)/mol 酸的浓度及体积 反应温度/℃ A Mg,0.1 6 mol·L-1 HNO3,10 mL 60 B Mg,0.1 3 mol·L-1 HCl,10 mL 60 C Fe,0.1 3 mol·L-1 HCl,100 mL 60 D Mg,0.1 3 mol·L-1 H2SO4,5 mL 60 解析 Mg比Fe活泼,与酸反应时更剧烈,排除C项;HNO3与金属反应不生成H2,排除A项;B、D两项中温度均为60 ℃,但D项c(H+)= 3 mol·L-1×2=6 mol·L-1,故B项排除,故选D。 答案 D 9.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:①IO+5I-+6H+===3I2+3H2O ②I2+HSO+H2O===2I-+SO+3H+。当反应进行到15 min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是( ) A.在整个反应过程中,起催化作用的物质是KI B.上述两个反应中,反应速率较快的是② C.时钟反应的快慢由反应②决定 D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关 解析 由反应①②可以得出KI是KIO3、KHSO3反应的催化剂,反应中生成的I2 - 7 - 能使淀粉溶液变蓝色,由题给信息——反应进行到15分钟时,溶液变蓝,说明反应①很慢,它决定了时钟反应的快慢。 答案 C 10.下表所列数据是某高温下金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录,a和b均为与温度有关的常数。 反应时间t/h 1 4 9 16 25 MgO层厚y/nm 0.05a 0.20a 0.45a 0.80a 1.25a NiO层厚y′/nm b 2b 3b 4b 5b (1)金属在高温下的氧化腐蚀速率可以用金属氧化膜的生成速率来表示,其理由是____________________________________________________ _______________________________________________________________。 (2)金属氧化膜的膜厚y跟时间t所呈现的关系是:MgO氧化膜的膜厚y属于________型,NiO氧化膜的膜厚y′则属于________型。(填“直线”或“抛物线”或“双曲线”或“对数”等类型) (3)Mg与Ni相比较,金属________具有更好的耐氧化腐蚀性,其理由是_________________________________________________________________ _______________________________________________________________。 答案 (1)化学反应的快慢既可以用反应物的消耗速率表示,又可以用生成物的生成速率表示,所以金属的腐蚀速率可以用其氧化物的生成速率来表示 (2)直线 抛物线 (3)Ni 据(2)可知y′随时间t的增加比y随时间t的增加缓慢,故Ni的耐腐蚀性比Mg好 11.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有______________________________ ________________________________________________________________; (2)硫酸铜溶液可以加快氢气生成速率的原因是________________________ ________________________________________________________________; (3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________; (4)要加快上述实验中气体产生的速率,还可采取的措施有_______________ ________________________________________________________(答两种); - 7 - (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。 实验混合溶液 A B C D E F 4 mol·L-1 H2SO4/mL 30 V1 V2 V3 V4 V5 饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20 H2O/mL V7 V8 V9 V10 10 0 ①请完成此实验设计,其中:V1=________,V6=________,V9=________; ②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色; ③该同学最后得出结论:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因是_______________________________ ________________________________________________________________。 解析 (1)分析实验中涉及的物质:Zn、CuSO4、H2SO4,其中能发生的化学反应有两个:Zn+CuSO4===ZnSO4+Cu,Zn+H2SO4===ZnSO4+H2↑。 (2)由于Zn与CuSO4反应生成的Cu附着在Zn片表面,构成铜锌微电池,从而加快了H2产生的速率。 (3)4种溶液中能与Zn发生置换反应的只有Ag2SO4,Zn+Ag2SO4===ZnSO4+2Ag。 (4)根据影响化学反应速率的外界因素可知,加快反应速率的方法还有:增大反应物浓度,升高温度,使用催化剂,增大锌粒的比表面积等。注意H2SO4浓度不能过大,浓硫酸与Zn反应不生成H2。 (5)若研究CuSO4的量对H2生成速率的影响,则实验中除CuSO4的量不同之外,其他物质的量均相同,则V1=V2=V3=V4=V5=30 mL,最终溶液总体积相同,由F可知,溶液的总体积均为50 mL,则V6=10 mL,V9=17.5 mL。随着CuSO4的量增大,则附着在Zn片表面的Cu会越来越多,当Cu完全覆盖Zn片时,Zn不能与H2SO4接触,则H2生成速率会减慢,且Zn片表面的Cu为暗红色。 答案 (1)Zn+CuSO4===ZnSO4+Cu,Zn+H2SO4===ZnSO4+H2↑ (2)CuSO4与Zn反应产生的Cu与Zn形成CuZn微电池,加快了氢气产生的速率 (3)Ag2SO4 (4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等 (5)①30 10 17.5 ②灰黑 暗红 ③当加入的CuSO4超过一定量时,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积 - 7 - 12.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。 实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、 2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。 甲同学的实验报告如下表: 实验步骤 现象 结论 ①分别取等体积的2 mol·L-1的硫酸于试管中 ②________ 反应速率Mg>Fe,Cu不反应 金属的性质越活泼,反应速率越快 (1)甲同学表中实验步骤②为______________________________________ ___________________________________________________________。 (2)甲同学的实验目的是_________________________________________, 要得出正确的实验结论,还需控制的实验条件是________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。 (3)乙同学在实验中应该测定的数据是________________________________ ________________________________________________________________。 (4)乙同学完成该实验应选用的实验药品是_______________________。 该实验中不选用某浓度的硫酸,理由是____________________________ ______________________________________________________________。 实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。 (5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________的影响。 (6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。 - 7 - A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水 解析 (1)要想通过实验比较法得出正确的结论,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。所以②中加入的Mg、Fe、Cu应该大小、形状都相同。 (2)由实验报告的内容可知甲同学的实验目的是研究反应物本身的性质与反应速率的关系,所以还需要控制的实验条件是温度相同。 (3)可以通过单位时间内产生气体的多少或产生相同体积的气体所需的时间来比较化学反应速率的快慢。 (4)常温下Fe、Al遇浓H2SO4、浓HNO3钝化且Mg和浓H2SO4反应无氢气生成,所以不能选用18.4 mol·L-1的浓H2SO4。 (5)影响化学反应速率的因素有浓度、温度、压强、催化剂等,结合本题的内容分析推测,还可能是催化剂的影响。 (6)因为该反应中无Cl-出现,所以MnSO4为最佳答案。 答案 (1)分别投入大小、形状相同的Cu、Fe、Mg (2)研究金属(或反应物)本身的性质与反应速率的关系 温度相同 (3)测定一定时间内产生气体的体积(或产生一定体积的气体所需的时间) (4)Mg(或Fe)、0.5 mol·L-1硫酸和2 mol·L-1硫酸 常温下Mg和18.4 mol·L-1浓硫酸反应生成SO2;Fe在18.4 mol·L-1浓硫酸中发生钝化 (5)MnSO4(或Mn2+)的催化作用 (6)B - 7 -查看更多