- 2021-07-02 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高中化学 第一单元 走进化学工业 课题1 化工生产过程中的基本问题教学案
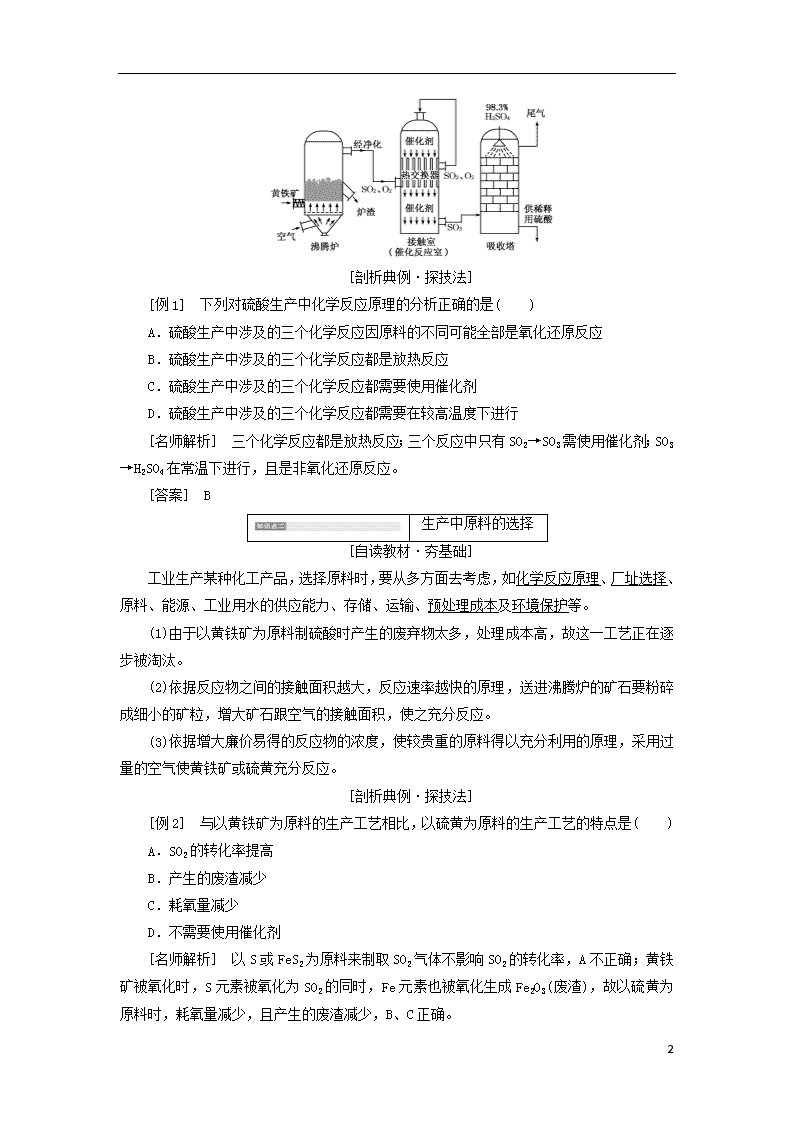
课题1化工生产过程中的基本问题 依据化学反应原理确定生产过程 [自读教材·夯基础] 1.关于工业制硫酸的反应原理及过程需考虑的因素 (1)分析产品的化学组成,确定生产该产品的主要原料。从H2SO4的组成看,生产原料应该是自然界中含硫的物质,如硫黄、黄铁矿(主要成分FeS2)等。 (2)分析产品与生产原料之间关键元素的性质,确定反应原理和主要生产步骤。H2SO4中S的化合价是+6价,生产过程中,要先使硫元素转化为SO2,再把SO2转化为SO3,再与H2O反应制得硫酸。 2.工业制硫酸的基本生产原理 以S(或FeS2)为原料制硫酸的反应原理用化学方程式表示为: (1)S+O2SO2(4FeS2+11O22Fe2O3+8SO2) (放热反应); (2)2SO2+O22SO3(放热反应); (3)SO3+H2O===H2SO4(放热反应)。 3.工业制硫酸的过程 工业制硫酸主要分为造气、催化氧化和吸收三个阶段。 硫酸生产的工艺流程: [跟随名师·解疑难] (1)S或FeS2不能直接被氧化为H2SO4,所以需要经过中间步骤,先得到SO3,再通过SO3与H2O反应得到H2SO4。 (2)煅烧黄铁矿制得的炉气中含有三种有害杂质:矿尘,砷、硒等化合物,水蒸气;对应三个净化过程:除尘、水洗和干燥,避免催化剂中毒。 (3)工业上用98.3%的硫酸吸收SO3,可以避免用水吸收SO3产生的酸雾腐蚀设备,并且可以提高吸收率。 (4)硫酸生产的三个主要设备:沸腾炉、接触室(催化反应室)、吸收塔。 18 [剖析典例·探技法] [例1] 下列对硫酸生产中化学反应原理的分析正确的是( ) A.硫酸生产中涉及的三个化学反应因原料的不同可能全部是氧化还原反应 B.硫酸生产中涉及的三个化学反应都是放热反应 C.硫酸生产中涉及的三个化学反应都需要使用催化剂 D.硫酸生产中涉及的三个化学反应都需要在较高温度下进行 [名师解析] 三个化学反应都是放热反应;三个反应中只有SO2→SO3需使用催化剂;SO3→H2SO4在常温下进行,且是非氧化还原反应。 [答案] B 生产中原料的选择 [自读教材·夯基础] 工业生产某种化工产品,选择原料时,要从多方面去考虑,如化学反应原理、厂址选择、原料、能源、工业用水的供应能力、存储、运输、预处理成本及环境保护等。 (1)由于以黄铁矿为原料制硫酸时产生的废弃物太多,处理成本高,故这一工艺正在逐步被淘汰。 (2)依据反应物之间的接触面积越大,反应速率越快的原理,送进沸腾炉的矿石要粉碎成细小的矿粒,增大矿石跟空气的接触面积,使之充分反应。 (3)依据增大廉价易得的反应物的浓度,使较贵重的原料得以充分利用的原理,采用过量的空气使黄铁矿或硫黄充分反应。 [剖析典例·探技法] [例2] 与以黄铁矿为原料的生产工艺相比,以硫黄为原料的生产工艺的特点是( ) A.SO2的转化率提高 B.产生的废渣减少 C.耗氧量减少 D.不需要使用催化剂 [名师解析] 以S或FeS2为原料来制取SO2气体不影响SO2的转化率,A不正确;黄铁矿被氧化时,S元素被氧化为SO2的同时,Fe元素也被氧化生成Fe2O3(废渣),故以硫黄为原料时,耗氧量减少,且产生的废渣减少,B、C正确。 18 [答案] BC [名师点睛] 环境保护已成为化工生产乃至原料选择中优先考虑的因素。 生产中反应条件的控制 [自读教材·夯基础] 1.化学平衡 (1)概念:如果外界条件不发生变化,可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度将不再发生变化,反应体系处于化学平衡状态。如硫酸工业中将SO2氧化成SO3是一个可逆反应,一定条件下反应可达到平衡状态。 (2)改变反应条件浓度、温度、压强等可破坏原有的化学平衡。 2.平衡移动原理(勒夏特列原理) (1)概念:如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就向能减弱这种改变的方向移动。 (2)催化剂对化学平衡没有(填“有”或“没有”)影响,但能改变到达平衡所需时间。 3.生产中反应条件的选择 在化工生产中要通过反应条件的控制使反应速率和平衡转化率都比较理想,还要同时考虑控制某些反应条件的成本和实际可能性。 4.SO2催化氧化条件的选择 化学反应 二氧化硫的催化氧化 化工条件 温度 压强 催化剂 400~500_℃ 常压 V2O5 采用该条件的原因 反应速率和SO2转化率都比较理想 SO2的转化率随压强增大的并不多 催化剂能加快化学反应速率,缩短到达平衡所需的时间 [跟随名师·解疑难] 1.平衡移动的重要结论 (1)增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向逆反应方向移动。 (2)升高温度,化学平衡向吸热的反应方向移动;降低温度,化学平衡向放热的反应方向移动。 (3)增大压强,化学平衡向气体分子数减小的方向移动;减小压强,化学平衡向气体分子数增大的方向移动。 2.反应2SO2+O22SO3的适宜条件 18 2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1 这是一个气体分子总数减小的、放热的可逆反应。 (1)温度 SO2催化氧化是一个放热的可逆反应,根据化学平衡移动理论判断,温度较低对提高SO2的转化率有利。但是,温度较低时催化剂活性不高,反应速率低。在实际生产中,选定400~500 ℃作为操作温度,这时反应速率和SO2的转化率都比较理想。 (2)压强 SO2催化氧化是一个气体分子总数减小的可逆反应,根据化学平衡移动理论判断,增大压强对提高SO2的平衡转化率有利。但是,在常压、400~500 ℃时,SO2的平衡转化率已经很高,因高压条件对设备提出了苛刻的要求,增大压强必须增大投资和能量消耗,故在实际生产中,通常采用常压操作。 (3)适当过量的空气 目的是提高SO2的转化率。 综上所述,催化氧化的适宜条件是常压、较高的温度(400~500 ℃)和催化剂。 [剖析典例·探技法] [例3] 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%,O211%,N282%): 压强/MPa 转化率/% 温度/℃ 0.1 0.5 1 10 400 99.2 99.6 99.7 99.9 500 93.5 96.9 97.8 99.3 600 73.7 85.8 89.5 96.4 (1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?________________________________________________________________________ ________________________________________________________________________。 (2)在400~500 ℃时,SO2的催化氧化采用常压而不是高压,主要原因是:________________________________________________________________________ ________________________________________________________________________。 (3)选择适宜的催化剂,是否可以提高SO2的转化率?____(填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”)。 18 (4)为提高SO3吸收率,实际生产中用________吸收SO3。 [名师解析] (1)根据表格中的数据可以看出,在相同压强下(如在0.1 MPa下),升高温度(如由400 ℃升高到500 ℃)时,SO2的转化率降低(由99.2%降低为93.5%),即升高温度时,此化学平衡向逆反应方向移动,而升高温度,化学平衡应该向吸热反应方向移动,所以此反应的正反应为放热反应。 (2)根据表格中的数据可以得知:在0.1 MPa时,SO2的转化率已经很高,若增大压强到10 MPa,SO2的转化率只增大了0.7%,变化不大。而压强增大100倍,需要对设备的材料、动力、能源等都作相应的提高,即要增大成本投入。 (3)使用催化剂只能改变反应到达平衡的时间,不能使化学平衡发生移动,即对SO2的转化率不产生影响;而在一定条件下,化学反应放出的热量与参加反应的反应物的量成正比,因SO2的转化率不变,所以反应放出的热量也不会增大。 (4)在实际生产中是采用98%的浓硫酸作为吸收剂来吸收SO3的。因为若用水或稀硫酸进行吸收会形成酸雾,将影响SO3的吸收速率和生产效率。 [答案] (1)压强一定时,温度升高,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应 (2)增大压强对提高SO2转化率无显著影响,反而会增加成本 (3)否 否 (4)98%的硫酸 [名师点睛] 化工生产条件的选择是理论在生产实际中的重要应用,在选择生产条件时既涉及外界条件对化学反应速率和化学平衡的影响,又要考虑生产实际问题。在学习时应对二氧化硫催化氧化的生产条件(温度、压强、充入空气的量)的选择充分理解、熟练掌握,并学会举一反三。 生产中三废的处理 [自读教材·夯基础] 1.尾气吸收 硫酸生产的尾气中含有少量SO2,可用石灰水吸收,使其生成CaSO3,再用H2SO4处理,从而得到含量较高的SO2,可返回用作原料。 化学方程式为:SO2+Ca(OH)2===CaSO3+H2O, CaSO3+H2SO4===CaSO4+H2O+SO2↑。 2.污水处理 硫酸生产过程中的污水,含有酸性杂质,可用石灰乳进行中和处理。化学方程式为H2SO4+Ca(OH)2===CaSO4+2H2O。 3.废渣的利用 (1)炉渣和矿灰可作为炼铁的原料。 18 (2)可以用来提炼贵重的有色金属。 (3)废渣还可作为制造水泥的原料或用于制砖。 [跟随名师·解疑难] (1)环境保护条件提升到首要考虑因素,所以预处理和生产过程中“三废”情况及处理成本,往往成为是否采用该工艺的决定性因素。 (2)在最终产生的“三废”中,往往还含有未反应的反应物,为了充分利用原料,在收集产品或处理“三废”时可将剩余反应物重新并入原料中,使生产过程带有局部循环的特点,这是化工生产工艺设计中常用的方法。 [剖析典例·探技法] [例4] 下列废物处理方法中正确的是( ) A.化学实验中产生的二氧化硫废气可用浓硫酸吸收 B.化学实验中产生的二氧化氮废气可用水吸收 C.用黄铁矿做原料生产硫酸的过程中,产生的废渣可用于提取燃料 D.用黄铁矿做原料生产硫酸的过程中,产生的废气可用于提取漂白剂 [名师解析] 二氧化硫在浓硫酸中的溶解度非常小,A项错误;二氧化氮一般用烧碱溶液吸收,发生的反应为:2NO2+2NaOH===NaNO2+NaNO3+H2O,B项错误;黄铁矿本来就是无机矿物质,又经过高温煅烧,废渣的主要成分是氧化铁、二氧化硅、氧化铝等,从中提取燃料是不现实的,C项错误;硫酸生产过程产生的废气中含有较高浓度的二氧化硫气体,二氧化硫可用做漂白剂,D项正确。 [答案] D [名师点睛] 厂址选择 (1)化工厂厂址的选择要考虑一些自然因素,如有无合适的建筑用地,有无近便、丰富而优质的水源,有无生产所必需的自然资源(如能源和原料)等。 (2)化工厂厂址的选择要考虑经济因素,如怎样接近原料、燃料的产地,如何接近消费市场以尽可能节省运输费用、降低生产成本等。 (3)化工厂厂址的选择既要考虑社会服务、生产协作、劳动与技术等诸多因素,更要考虑生态效益和社会效益。如果环境严重受污染,生态平衡被破坏,经济效益最终也将失去。 (4)硫酸厂厂址选择考虑因素:①有无市场需求;②是否接近原料产地;③土地供应是否充足;④水源是否充足;⑤能源是否充足且廉价;⑥交通运输是否方便;⑦环保是否达标。 能量的充分利用 [自读教材·夯基础] 硫酸生产过程中的三个反应都是放热反应,如果能充分利用这些热量,不但可以由硫酸厂自行提供能量,而且还可以向外界输出大量能量,可大大降低生产成本。 (1)在沸腾炉旁设置蒸气锅炉进行发电。 18 (2)在接触室中设置热交换器,利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2等。 [剖析典例·探技法] [例5] 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的催化反应室(见下图),下列有关说法中错误的是( ) A.采用热交换装置,能充分利用“废热”,降低生产成本 B.预热含有二氧化硫的混合气体,有利于催化氧化 C.A处流出的气体为SO2和O2 D.预热SO3,有利于被浓硫酸吸收 [名师解析] 此题考查了工业生产H2SO4的重要设备之一——催化反应室中气体的流向。原料SO2、O2从装置左侧中间进入热交换器,吸收热量后由A处流出再进入催化反应室发生反应,并放出大量的热,而热交换器的作用是把一部分热量交换给刚进入热交换器的原料气,然后由下端流入下一个装置,SO3温度过高不易被吸收,所以下端出来的气体温度较低,这也是热交换器的作用之一。 [答案] D [名师点睛] 硫酸工业中的三个原理 (1)化学平衡原理:增大反应物浓度、增大反应物间接触面积,能提高反应速率,同时使化学平衡向正反应方向移动,有利于增加生成物的量。 (2)热交换原理:在接触室中产生的热量经过热交换器,传递给进入接触室需要预热的原料气,为SO2的接触氧化和SO3的吸收创造了有利条件。 (3)逆流原理:用浓硫酸吸收SO3气体时,液体由上向下喷,气体由下向上升,两者在逆流过程中充分接触。 硫酸工业生产中的四个“三” 18 硫酸工业中多步反应的计算 硫酸工业中涉及多步反应,计算起来比较烦琐,对于多步反应的计算,一般可采取以下方法。 (1)关系式法 先写出多步反应的化学方程式,然后找出反应物和生成物之间物质的量(或质量)之比,列出关系式,即可一步计算。 如:用黄铁矿制硫酸,涉及的反应有 4FeS2+11O22Fe2O3+8SO2, 2SO2+O22SO3, SO3+H2O===H2SO4。 原料FeS2与产品H2SO4之间的关系可以根据反应找出4FeS2~8SO2~8SO3~8H2SO4,即FeS2~2H2SO4,若已知FeS2的质量,就可以根据上面得出的FeS2~2H2SO4关系,一步计算出H2SO4的质量。 (2)元素守恒法 找出主要原料和最终产物之间物质的量的对应关系。寻找此关系的简便方法,就是分析原料与产物之间所含关键元素原子个数关系,如FeS2~2H2SO4,S~H2SO4。若已知(欲求)FeS2含量,用前面的关系式,若已知(欲求)S的含量,用后一关系式,且二氧化硫转化率、三氧化硫吸收率均可折算成起始物FeS2(或S)进行计算。 1.下列有关黄铁矿制硫酸的说法中,正确的是( ) A.沸腾炉中出来的炉气,可直接进入转化器中进行催化氧化 B.焙烧黄铁矿的反应中,二氧化硫是唯一的氧化产物 C.生产过程中要采用高温高压,以有利于二氧化硫更好地转化为三氧化硫 D.三氧化硫在吸收塔中被吸收时,通常用质量分数为98.3%的硫酸做吸收剂,而不直接用水吸收 解析:A项中,炉气需要经过净化、干燥等处理,以避免催化剂中毒;B项中,煅烧FeS2 18 时,铁元素和硫元素均被氧化,产物不止一种;C项中,反应正向为放热反应,高温不利于SO3的生成。 答案:D 2.在接触法制硫酸工业中,接触室中装有热交换器。采用热交换器的好处是( ) ①充分利用热量,降低能耗 ②促使平衡向正反应方向移动,提高产率 ③减少热量对环境的污染 ④提高最终产品的纯度 A.仅① B.仅①② C.仅①②③ D.①②③④ 解析:使用热交换器能充分利用热量,减少热量对环境的污染。SO2转化为SO3是放热反应,反应室温度降低有利于平衡向正反应方向移动。 答案:C 3.在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是( ) A.黄铁矿燃烧前需要粉碎,因为块状黄铁矿不能燃烧 B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率 C.SO2氧化为SO3无需进行加热,因为此反应为放热反应 D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收 解析:将黄铁矿石粉碎的目的是增大矿石跟空气的接触面积,使之充分反应,A不正确;SO2转化为SO3时,在常压下的转化率已很高,增大压强对SO2的转化率提高不大,且加压会增加生产成本和能量消耗,故B不正确;工业生产中SO2转化为SO3需在催化剂和加热条件下进行,C不正确。 答案:D 4.接触法生产硫酸的过程中,对废气、废水、废渣、废热的处理正确的是( ) ①尾气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥、炼铁 ④设置废热锅炉产生蒸汽、供热或发电 A.①② B.①③④ C.①②③ D.①②③④ 解析:硫酸厂尾气中含有SO2,可用氨水吸收处理;硫酸厂废水中含有硫酸可用石灰乳中和;硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁;由于硫酸生产过程中三个化学反应都是放热反应,可以充分利用这些反应放出的热能来降低生产成本。 答案:D 5.如图所示装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何用98.3%的浓硫酸吸收三氧化硫。 18 请回答下列问题: (1)写出沸腾炉内煅烧黄铁矿的化学反应方程式:_____________________________ ________________________________________________________________________; (2)甲和乙相当于工业上制取硫酸装置中的________; (3)写出在催化剂表面所发生的化学反应方程式:______________________________ ________________________,在实验过程中不能持续加热的理由是______________; (4)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?________________________________________________________________________。 (5)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是( ) A.浓硫酸对三氧化硫的吸收效率远大于水,三氧化硫被浓硫酸充分吸收 B.三氧化硫的通气速率太快,三氧化硫未被水和浓硫酸充分吸收 C.丙中的导气管插得太深,导致两个吸收瓶内的气压差较大 解析:装置甲有多个作用,一是通过观察气泡产生的速率调节通入二氧化硫、氧气的比例;二是使两种原料气体充分混合;三是直到干燥的作用。 答案:(1)4FeS2+11O22Fe2O3+8SO2 (2)接触室 (3)2SO2+O22SO3 防止温度过高,而降低SO2的转化率及催化剂活性(4)可以通过调节气阀,控制气体流量,观察甲装置的冒泡速率进行估算 (5)AC [高考感悟] 1.(上海高考)下列关于硫酸工业生产过程的叙述错误的是( ) A.在接触室中使用铁粉作催化剂 B.在接触室中运用热交换技术可充分利用能源 C.把硫铁矿磨成细粉末,可以提高原料的利用率 D.该反应采用450~500 ℃主要是因为该温度下催化剂活性好 解析:硫酸工业生产中,SO2的催化氧化用V2O5做催化剂,A 18 错误;使用热交换器可节约能源,B正确;把硫铁矿磨碎可增大其与氧气的接触面积,使反应更充分,速率更快,可提高原料利用率,C正确;D项中,该温度下催化剂的活性高,D正确。 答案:A 2.(山东高考)2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( ) A.催化剂V2O5不改变该反应的逆反应速率 B.增大反应体系的压强,反应速率一定增大 C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v= 解析:解答本题需对外界条件对化学反应速率的影响及化学反应速率的概念有深刻的理解。催化剂可以同等程度地增大正逆反应的反应速率,A错误;如果是恒容下通入惰性气体增大了体系压强,反应物浓度未变,反应速率不变,B错误;降温反应速率减慢,达到平衡的时间增长,C错误;D符合反应速率的定义,正确。 答案:D 3.(海南高考)以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下: 请回答下列问题: (1)在炉气制造中,生成SO2反应的化学方程式为_______________________________ ________________________________________________________________________。 (2)炉气精制的作用是将含SO2的炉气________、________及干燥,如果炉气不经过精制,对SO2催化氧化的影响是________________。 (3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如下图所示。在实际生产中,SO2催化氧化反应的条件选择常压、450 ℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是________________________________________________________________________ ________________________________________________________________________、 ________________________________________________________________________ ________________________________________________________________________。 18 (4)在SO2催化氧化设备中设置热交换器的目的是________________、________________,从而充分利用能源。 解析:(1)4FeS2+11O22Fe2O3+8SO2 (2)SO2气体中含有矿尘、水汽等,会对催化剂的活性和设备产生不良影响,所以进入接触室之前,需对气体进行除尘、洗涤及干燥。 (3)由图可知,在450 ℃、0.1 MPa时,转化率已达95%以上,采用更高的压强,对设备要求更高,转化率影响较小;在0.1 MPa,温度较低时,反应速率较慢、产量低。 (4)将反应产物的热量及时交换给即将参加反应的SO2和O2,使能量循环利用节约能源。 答案:(1)4FeS2+11O22Fe2O3+8SO2 (2)除尘 洗涤 使催化剂中毒 (3)见解析 (4)能量循环利用 预热SO2和O2 [课时跟踪训练] 一、选择题(本题包括10小题,每小题5分,共50分) 1.有关接触法制硫酸的叙述不正确的是( ) A.硫黄和黄铁矿均可作为生产原料 B.SO2转化为SO3,需在催化剂加热条件下进行 C.热交换器可对生成气体冷却,对原料气体加热 D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸 解析:在吸收塔中,用98.3%的硫酸吸收SO3得到的就是“发烟硫酸”,可用水或稀硫酸稀释,制得各种浓度的硫酸,故D项不正确。 答案:D 2.下列说法正确的是( ) A.合成硫酸的工业尾气可以直接排入大气 B.进入接触室的气体,必须先经净化、干燥 C.从沸腾炉中排出的炉渣可以作为肥料 18 D.在高温、高压下由SO2和O2合成SO3 解析:硫酸工业的尾气中含有SO2气体,不能直接排入大气,A错;沸腾炉中排出的炉渣中含有Fe2O3、砷、硒化合物等,不能用作肥料,C错;D项中的反应在常压下经济效益较好。 答案:B 3.在工业生产硫酸中,在吸收塔内用来吸收三氧化硫的是( ) A.H2O B.稀硫酸 C.浓硫酸 D.氨水 解析:用水吸收SO3会产生酸雾,腐蚀设备,所以用浓硫酸来吸收SO3。 答案:C 4.工业上生产硫酸,回收尾气中SO2气体,最好选用的是( ) A.氨水 B.NaOH C.Ca(OH)2 D.浓硫酸 解析:工业上用廉价的Ca(OH)2吸收尾气中的SO2,使其生成CaSO3,然后再用H2SO4处理,从而得到含量较高的SO2,可返回用作原料,故选C。 答案:C 5.接触法制硫酸的沸腾炉出来的炉气必须经过净化处理,其正确过程是( ) A.洗涤、干燥、除尘 B.干燥、除尘、洗涤 C.除尘、洗涤、干燥 D.除去硒和砷的化合物 解析:沸腾炉出来的气体中含有矿尘以及砷、硒化合物等,这些物质能使催化剂中毒,可通过除尘、洗涤除去;水蒸气对设备和生产有不良影响,必须干燥。 答案:C 6.为了提高硫酸工业的综合经济效益,下列做法正确的是( ) ①对硫酸工业生产中产生的废气、废渣、废液进行综合利用 ②充分利用硫酸工业生产中的“废热” ③不把硫酸厂建在人口稠密的居民区和环保要求高的地区 A.① B.② C.③ D.①②③ 解析:①建立处理“三废”措施,严格执行国家“三废”排放标准;②变“三废”为宝,实行综合利用。尽可能地利用“废气、废渣、废液、废热”,既可以提高原料的利用率,降低成本,又能减少对环境的污染。硫酸厂对环境的污染是比较严重的,不能建立在人口稠密的地区和环保要求高的地区。 答案:D 7.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如右图),图中在a、b、c 18 处流入或流出的气体正确的是( ) A.a处SO2、N2 B.b处SO2、O2、N2 C.a处SO3、O2 D.c处SO3、N2 解析:a处通入的是温度较低的原料气(SO2、O2和N2),经过热交换器的预热,b处得到的是温度较高的混合气体(SO2、O2、N2),然后该气体经过接触室的上端进入接触室反应生成SO3,由于该反应是可逆反应,所以c处流出的气体中,既有SO3和N2,同时还含有SO2、O2。 答案:B 8.硫酸制造业中采取以下几种措施:①改进煅烧黄铁矿的技术;②氧化二氧化硫时使用催化剂;③在氧化二氧化硫的设备中安装热交换器;④将二氧化硫进行多次循环氧化;⑤回收利用尾气中的二氧化硫。其中能减少酸雨产生的措施是( ) A.①②④⑤ B.②③④⑤ C.①②③④⑤ D.④⑤ 解析:减少酸雨产生,即减少向环境中排放SO2,④和⑤能达此目的。 答案:D 9.在制硫酸的工业中有以下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,下列说法错误的是( ) A.生产中通入过量的空气,可以提高二氧化硫的转化率 B.生产中选择400~500 ℃,不仅能增大反应速率,而且催化剂的活性好 C.根据实际情况在生产中选择常压,可以提高综合经济效益 D.在催化反应室被氧化生成的三氧化硫,进入吸收塔被水吸收制成硫酸 解析:用水吸收三氧化硫容易形成酸雾,应用98%硫酸吸收三氧化硫。 答案:D 10.有关硫酸工业综合经济效益的说法中,正确的是( ) A.甲地有丰富的硫铁矿资源,水源、能源充足,交通便利,是风景秀丽的旅游胜地,虽然当地使用硫酸的工业不多,但为提高当地经济效益宜建硫酸厂 B.为减少SO2对空气的污染,可以建筑高烟囱,使含SO2的尾气在高空扩散稀释,保证地面达到安全浓度 C.硫酸生产过程排放的污染物主要是含SO2的尾气、固体残渣、废酸和废水等 D.选择硫酸厂厂址时,当经济利益与环保问题有冲突时,为提高人们的物质生活水平,应先考虑经济利益的问题 解析:硫酸厂是污染性的企业,不应建在风景区;当地使用硫酸的工业不多,也不宜建硫酸厂,因为硫酸的远程运输成本高,危险性大,故A错误;将SO2排放到高空,SO2 18 的总量不会减少,且会形成酸雨危害环境,故B错误;选择硫酸厂厂址在考虑经济利益的同时,必须考虑环保问题,也就是要提高综合社会效益,故D错误。 答案:C 二、非选择题(本题包括4小题,共50分) 11.(12分)在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O22SO3(放热反应)。已知常压下平衡混合气体中SO3的体积分数为91%。试回答: (1)在生产中常用过量的空气是为了_________________________________________ ________________________________________________________________________。 (2)加热到400~500 ℃是由于_______________________________________________ ________________________________________________________________________。 (3)压强采用________,原因是_____________________________________________ ________________________________________________________________________。 (4)常用浓H2SO4来吸收SO3,而不用水,因为_________________________________ ________________________________________________________________________。 解析:此题考查了在硫酸工业中运用化学平衡原理选择适宜生产条件的能力。选择适宜的反应条件,要从浓度、温度、压强、催化剂等条件中考虑该反应的速率、转化率,同时还要考虑工业生产的实际情况。如第(2)(4)两问是考虑速率问题,第(1)(3)两问则是考虑化学平衡问题,且第(3)问还要考虑生产的实际情况。 答案:(1)增大氧气的浓度,提高成本较高的SO2的转化率 (2)在此温度下,催化剂活性最好,反应速率快,可缩短达到平衡的时间,提高单位时间内SO3的产率 (3)常压 因常压下平衡混合气体中SO3的体积分数已达很高,若再加压,对设备动力系统要求高,成本高,加压已无实际意义 (4)用水吸收易形成酸雾,降低吸收速率,同时腐蚀设备 12.(13分)工业制硫酸生产流程如下图所示: (1)我国黄铁矿资源比较丰富,但很多工厂仍以硫黄为原料生产硫酸,理由是________________________________________________________________________。 (2)在催化反应室,下列措施中有利于提高SO2平衡转化率的是______________。 A.升高温度 B.减小压强 C.不断补充空气 D.及时分离出SO3 18 (3)在生产中为提高催化剂催化效率采取了哪些措施?_____________________(至少答出两点措施)。 (4)经检测生产硫酸的原料气成分(体积分数)为SO2 7%、O2 11%、N2 82%。在500℃,0.1 MPa条件下达到平衡时,各种气体的体积比为V(SO2) ∶V(SO3)∶V(O2)∶V(N2)=0.46∶6.54∶7.73∶82,则SO2的转用率为________。 解析:二氧化硫转化为三氧化硫的反应为正反应气体体积减小的放热反应,所以低温高压有利于提高二氧化硫的转化率,增加反应物O2的浓度和减少生成物SO3的浓度,可使化学平衡向正方向移动,提高SO2的转化率。在生产过程中,氮气没有参加反应,所以其体积不变,则可看成反应前气体的体积SO2、O2、N2分别为7 L、11 L、82 L,反应后SO2的体积为0.46 L,所以SO2的转化率为×100%=93.4%。 答案:(1)黄铁矿为原料的生产中产生的废弃物多,处理成本高 (2)CD (3)①净化气体;②控制温度在400~500℃;③增大催化剂与反应气体的接触面积 (4)93.4% 13.(12分)硫酸工业在国民经济中占有极其重要的地位。 (1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________________(任写一种)。 (2)硫酸生产中,根据化学平衡原理来确定的条件或措施有____________(填写序号)。 A.矿石加入沸腾焙烧炉之前先粉碎 B.使用V2O5作催化剂 C.催化反应室中使用适宜的温度 D.净化后的炉气中要有过量的空气 E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3 (3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫: 2SO2(g)+O2(g)2SO3(g)(放热反应) 在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。 (4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、接触室、吸收塔)。 ①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。 ________________________________________________________________________。 18 ②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理(只写出2个化学方程式即可)。 ________________________________________________________________________ ________________________________________________________________________。 解析:(2)根据化学平衡原理来确定的条件有D项(增大反应物浓度,使平衡正向移动);根据化学平衡移动原理,降温有利于平衡正向移动,保持适宜温度是为了使催化剂效率最高。 (3)转化率为95%+(1-95%)×95%=99.75%。 (4)SO2用氨水吸收后再用H2SO4处理,可得相应化肥,SO2可以再次循环利用。 答案:(1)(NH4)2SO4(或K2SO4) (2)D (3)99.75% (4)①SO3从吸收塔底部进入,吸收剂(浓硫酸)从顶部下淋,形成对流 ②SO2+NH3·H2O===NH4HSO3 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2↑ [或SO2+2NH3·H2O===(NH4)2SO3+H2O (NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑] 14.(13分)以黄铁矿为原料生产硫酸的工艺流程图如下: (1)接触室中发生反应的化学方程式是________________________________________________________________________ ________________________________________________________________________。 (2)依据工艺流程图判断下列说法正确的是(选填序号字母)________。 a.为使黄铁矿充分燃烧,需将其粉碎 b.过量空气能提高SO2的转化率 c.使用催化剂能提高SO2的反应速率和转化率 d.沸腾炉排出的矿渣可供炼铁 (3)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是________________________________________________________________________ ________________________________________________________________________。 (4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。 SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是______________________________________________。 18 解析:本题主要考查硫酸工业、热化学方程式的书写、计算等。 (1)SO2和O2在接触室发生反应生成SO3:2SO2+O22SO3。 (2)选项a,将黄铁矿粉碎能增加反应物接触面积而加快反应速率。选项b,增加反应物空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。 (3)160 g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6 kJ热量,则1 mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3 kJ热量,则相关热化学方程式为SO3(g)+H2O(l)===H2SO4(l) ΔH=-130.3kJ/mol。 答案:(1)2SO2+O22SO3 (2)abd (3)SO3(g)+H2O(l)===H2SO4(l) ΔH=-130.3 kJ/mol (4)SO2+Br2+2H2O===4H++2Br-+SO 18查看更多