- 2021-07-02 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省攀枝花市2020届高三上学期第一次统一考试化学试卷
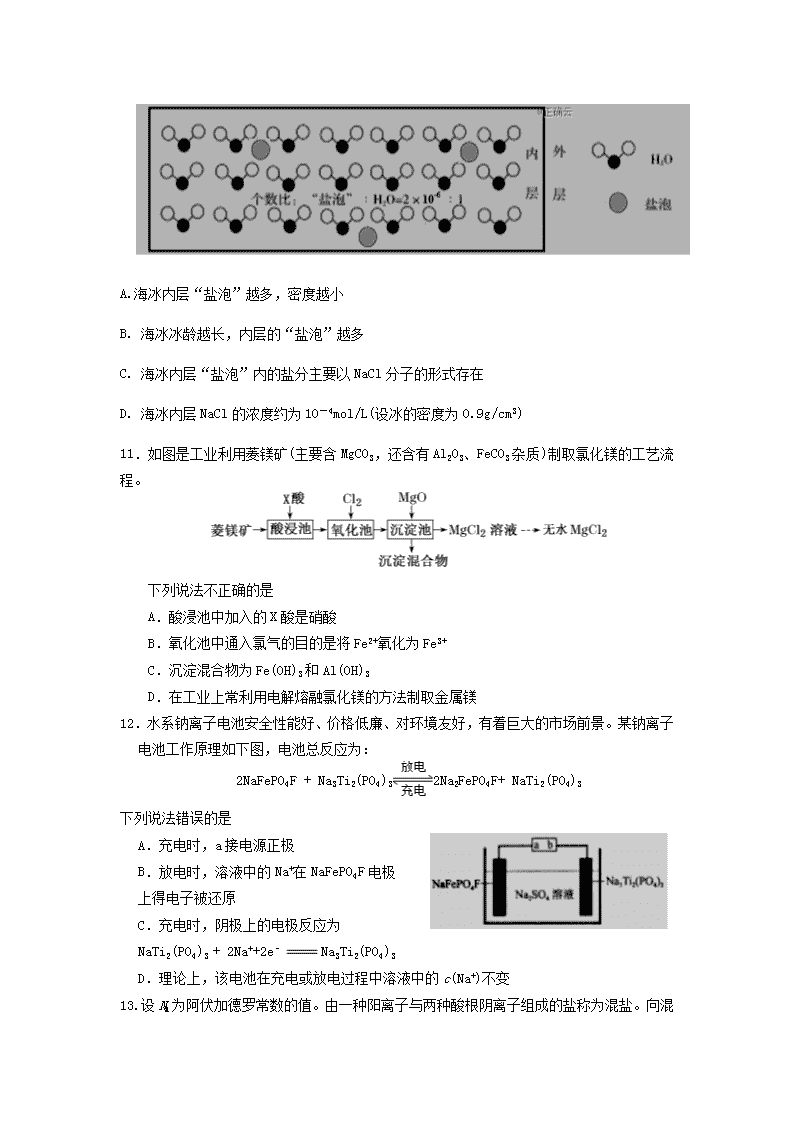
化学试题 2019.11 可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5 Ca-40 Ti-48 Fe-56 Cu-64 Pd(钯)-106 7. 化学与生活、生产密切相关。下列叙述不正确的是 A. 高纯硅可用于制作光导纤维 B.二氧化氯可用于自来水的杀菌消毒 C.氯化铁溶液可用于刻制铜质印刷线路板 D.海水里的钢闸门可连接电源的负极进行防护 8.根据下列事实书写的离子方程式中,错误的是 A.向Na2SiO3溶液中加入稀盐酸得到硅酸胶体: SiO32- + 2H+ H2SiO3(胶体) B.向FeSO4溶液中加入NH4HCO3溶液得到FeCO3 沉淀:Fe2++ 2HCO3-FeCO3↓+ CO2↑+ H2O C.向AlCl3溶液中加入足量稀氨水:Al3++ 4NH3·H2O Al3++ NH4+ + 2H2O D.在稀硫酸存在下,MnO2将CuS中的硫元素氧化为硫单质: MnO2 +CuS + 4H+ Mn2++ Cu2++ S + 2H2O 9.依据反应2NaIO3 + 5SO2 + 4H2OI2 + 3H2SO4 + 2NaHSO4,利用下列装置从含NaIO3的废液中得到碘的CCl4溶液并回收NaHSO4。其中装置正确且能达到相应实验目的是 A.②④ B.①②③ C.②③④ D.①②③④ 10.海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡” (假设盐分以一个NaCl计),其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是 A.海冰内层“盐泡”越多,密度越小 B. 海冰冰龄越长,内层的“盐泡”越多 C. 海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在 D. 海冰内层NaCl的浓度约为10-4mol/L(设冰的密度为0.9g/cm3) 11.如图是工业利用菱镁矿(主要含MgCO3,还含有Al2O3、FeCO3杂质)制取氯化镁的工艺流程。 下列说法不正确的是 A.酸浸池中加入的X酸是硝酸 B.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+ C.沉淀混合物为Fe(OH)3和Al(OH)3 D.在工业上常利用电解熔融氯化镁的方法制取金属镁 12.水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如下图,电池总反应为: 2NaFePO4F + Na3Ti2(PO4)32Na2FePO4F+ NaTi2(PO4)3 下列说法错误的是 A.充电时,a接电源正极 B.放电时,溶液中的Na+在NaFePO4F电极 上得电子被还原 C.充电时,阴极上的电极反应为 NaTi2(PO4)3 + 2Na++2e﹣Na3Ti2(PO4)3 D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变 13.设NA 为阿伏加德罗常数的值。由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,发生反应:CaOCl2 + H2SO4(浓)CaSO4 + Cl2↑+ H2O。下列说法正确的是 A.明矾、小苏打都可称为混盐 B.在上述反应中,浓硫酸体现氧化剂和酸性 C.每产生1mol Cl2,转移电子数为NA D.1mol CaOCl2中共含离子数为4NA 27.(16分)过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如下图所示: 回答下列问题: (1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有 。 (2)仪器X的主要作用除导气外,还具有的作用是 。 (3)在冰水浴中进行的原因是 。 (4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为 。 (5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是_______。 A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液 (6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为: ① Fe3+ + H2O2 Fe2+ + H+ + HOO· ② H2O2 + XY + Z + W(已配平) ③ Fe2+ +·OH Fe3+ + OH- ④ H+ + OH- H2O 根据上述机理推导步骤②中的化学方程式为 。 (7)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙具有_____________的性质。 A.与水缓慢反应供氧 B.能吸收鱼苗呼出的CO2气体 C.能是水体酸性增强 D.具有强氧化性,可杀菌灭藻 (8)将所得CaO2·8H2O晶体加热到150~160℃,完全脱水后得到过氧化钙样品。 该小组测定过氧化钙样品中CaO2的纯度的方法是:准确称取0.4000g过氧化钙样品,400℃以上加热至完全分解成CaO和O2(设杂质不产生气体),得到33.60mL(已换算为标准状况)气体。 则:所得过氧化钙样品中CaO2的纯度为_________。 28.(12分)甲氧基肉桂酸乙基己酯(下图中J)是一种理想的防晒剂,能有效吸收紫外线,安全性良好。其合成线路图如下: 回答下列问题: (1)由A生成B的反应类型为 。有机物E的分子式为 。丙二酸的结构简式为 。 (2)C的结构简式为 。 (3)H的结构简式为 。 (4)G与氢气反应可得X()。X有多种同分异构体,其中同时满足下列条件同分异构体的结构简式为: ①核磁共振氢谱有四种峰; ②与FeCl3溶液能发生显色反应,且1mol该物质恰好能与3mol NaOH完全反应。 (5)以乙醇和丙二酸为原料合成聚巴豆酸乙酯 ,请补充完成以下合成路线(无机试剂可任选)。 29.(14分)工业上利用氧化铝基废催化剂【主要成分为Al2O3,还含有少量Pd(钯))】回收硫酸铝及Pd的流程如下: 回答下列问题: (1)将硫酸铝溶液蒸发浓缩后,冷却得到十八水合硫酸铝固体,该固体的化学式为 。 (2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为 。 (3)王水是浓硝酸和浓盐酸按体积比为 的混合物。王水不稳定,加热时能生成亚硝酰氯(NOCl)和氯气,该反应的化学方程式为 。 (4)浸液Y中含Pd元素的溶质是H2PdCl6(氯钯酸),则“酸浸”时反应的化学方程式为 。 (5)若“热还原”中得到的固体只有Pd,每生成1molPd时生成的气体的物质的量为 。 (6)Pd是优良的储氢金属,其储氢原理为2Pd(s)+ xH2(g)═2PdHx(s),其中x的最大值为0.8.已知:Pd的密度为12g•cm﹣3,则21.2cm3Pd能储存标准状况下H2的最大体积为 L。 30. (16分)水体中硝酸盐造成的污染已成为突出的环境问题。某课题组研究了去除不同各种水体中NO3-的方法。 (1)用铝粉去除饮用水中NO3﹣的一种方案如下: ①用熟石灰而不用NaOH调节pH的主要原因是 。在调节pH时,若pH过大或过小都会造成Al的利用率降低。写出pH过大造成Al利用率降低的离子方程 式 。 ②在加入铝粉去除NO3﹣的反应中,氧化产物和还原产物的物质 的量之比为 。 (2)用铁粉处理pH=2.5的含NO3-废水,测得溶液中相关离子浓 度、pH随时间的变化关系如图1(部分副反应产物略去): 30题图1 ①t1时刻前,该反应的离子方程式为 。 ②研究表明:铁粉还原含NO3-废水时,加入活性碳粉可以提高去除NO3﹣的速率,可能的原因是 。 (3)用Pt作电极电解含NO3-的酸性废水,原理如图2。N为电源 的 (选填“正”或 “负”)极,与直流电源M端相连的Pt 电极上的电极反应式为 。 30题图2 (4)课题组以钛基氧化物涂层材料为惰性阳极、碳纳米管修饰的石墨为阴极,控制一定条件,电解含大量NO、SO42-的废水,可使NO变为NH。研究发现:其他条件不变,废水中加一定量NaCl,去除NH的效果明显提高,溶液中氮元素含量显著降低,可能的原因是 。 化学参考答案 2019.11 7.A 8.C 9.B 10.D 11.A 12.B 13.C 27(共16分) (1)烧杯、量筒(2分)(2)防止三颈烧瓶中溶液发生倒吸。(2分) (3)防止温度过高H2O2分解、有利于晶体析出。(2分) (4)Ca2+ + H2O2 + 2NH3 + 8H2OCaO2·8H2O↓ + 2NH4+ (2分) (5)A (2分) (6)HOO·+ H2O2H2O + O2 +·OH(2分) (7)ABD(2分) (8)54.00%(2分) 28(共12分) (1) 取代反应(1分) C8H10O(1分) HOOCCH2COOH(1分) (2) (2分) (2分) (3) (2分) (4)(3分) 29(共14分) (1)Al2(SO4)3·18H2O(2分) (2)3(NH4)2SO4 + Al2O3 Al2(SO4)3 + 6NH3↑+ 3H2O↑(2分) (3)1:3 (2分) HNO3(浓) + 3HCl(浓) NOCl↑ + Cl2↑ + 2H2O(2分) (4)Pd + 6HCl + 4HNO3 H2PdCl6 + 4NO2↑+ 4H2O(2分) (5)8mol(2分) (6)21.504(2分) 30(共16分) (1)①熟石灰价格便宜(2分) 2Al + 2OH -+ 2H2O2AlO2- + 3H2↑(2分)②10:3(2分) (2)①4Fe + NO3﹣+10H+ 4Fe2++ NH + 3H2O(2分) ② 铁粉与活性碳粉形成原电池加快还原NO3﹣的反应速率。(2分) (3)正(2分) 2NO3﹣+ 12H+ +10e﹣N2↑+ 6H2O(2分) (4)Cl-在阳极上被氧化成Cl2(或游离氯),与阴极生成的NH4+反应生成N2。(2分)查看更多