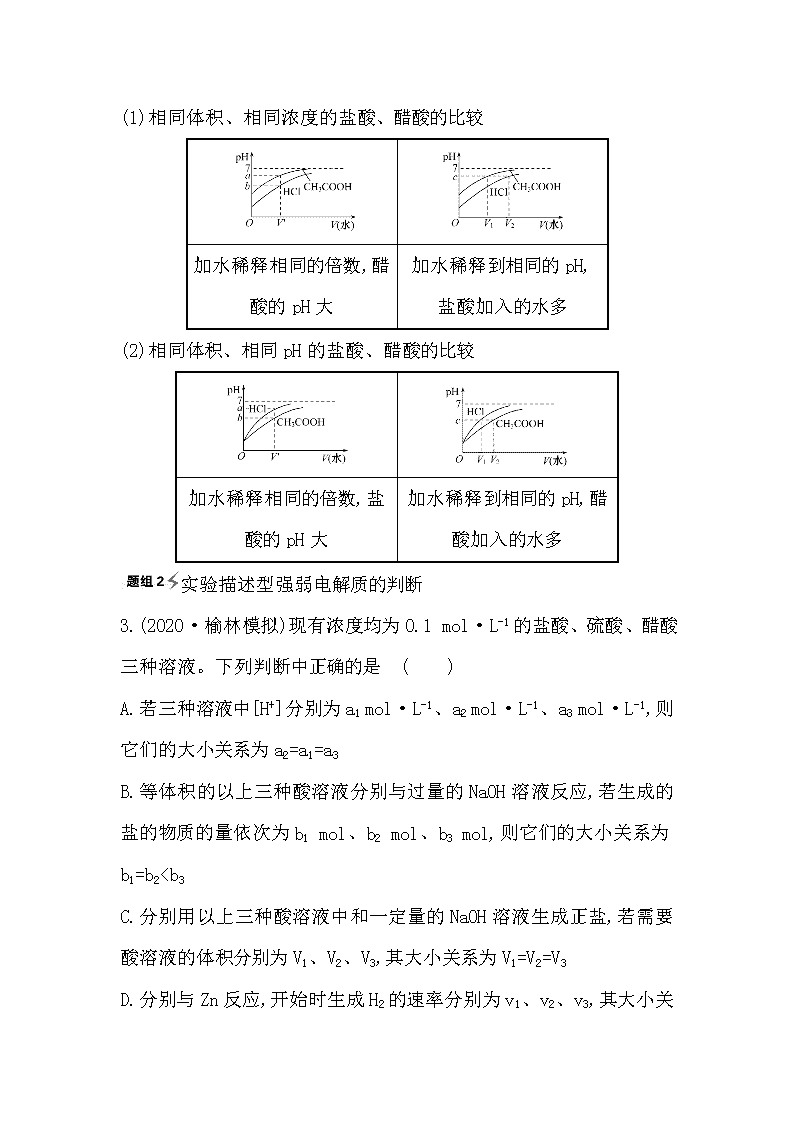
2021版化学名师讲练大一轮复习鲁科新高考地区专用版题组训练过关:第8章 考点3 8-1弱电解质的电离平衡
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
题组训练过关
强弱电解质的图象分析
1.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是 ( )
【解析】选C。因盐酸为强酸、醋酸为弱酸,故pH都等于2的盐酸和醋酸溶液中,c(HCl)=0.01 mol·L-1,而c(CH3COOH)>0.01 mol·L-1,1 L溶液中n(HCl)=
0.01 mol,n(CH3COOH)>0.01 mol。A项,相同时间内pH变化较大的应为HCl,错误;B项,产生H2的速率大的应为CH3COOH,错误;D项,相同时间内c(H+)变化较大的为HCl,错误。
2.(2019·佛山模拟)已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是 ( )
A.曲线Ⅰ为次氯酸稀释时pH的变化曲线
B.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C.a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D.b点溶液中水的电离程度比c点溶液中水的电离程度小
【解析】选B。常温下Ka(HClO)
v1>v3
【解析】选D。HCl、H2SO4是强电解质,完全电离,CH3COOH是弱电解质,部分电离,由三种酸溶液中的浓度知,它们的大小关系为a2=2a1,a1大于a3,A项错误;等浓度等体积的盐酸、硫酸、醋酸三种溶液分别与过量NaOH溶液反应生成盐的物质的量的大小关系为b1=b2=b3,B项错误;分别用三种酸溶液中和一定量的NaOH溶液生成正盐,若需要酸溶液的体积分别为V1、V2、V3,则其大小关系为V1=V3=2V2,C项错误;硫酸中[H+]为0.2 mol·L-1,盐酸中[H+]为0.1 mol·L-1,醋酸中[H+]小于
0.1 mol·L-1,分别与Zn反应,开始时生成H2的速率的大小关系为v2>v1>v3,D项正确。
4.为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:________________________________________。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? _________________。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变__________(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质?________(填“能”
或“否”),并说明原因:
________________________________________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: ________________________________。
【解析】(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为
0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-21,则HA为弱酸
与同浓度的盐酸比较导电性
导电性和盐酸相同时为强酸,比盐酸弱时为弱酸
与同浓度的盐酸比较和锌反应的快慢
反应速率相同时为强酸,比盐酸反应慢时为弱酸
(2)从是否存在电离平衡的角度判断
在水溶液中,强电解质不存在电离平衡,弱电解质存在电离平衡,
在一定条件下电离平衡会发生移动。据此有以下判断HA是强酸还是弱酸的方法:
①从一定pH的HA溶液稀释前后pH的变化判断。如将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为强酸,若pH<5,则为弱酸。
②从升高温度后pH的变化判断。若升高温度,溶液的pH明显减小,则是弱酸。因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH变化幅度小。
③从等体积等pH的HA溶液与盐酸分别与过量的锌反应生成H2的量判断:用排水法收集H2,若两种溶液生成H2的量相等,则HA为强酸;若HA溶液与锌反应生成H2的量多,则HA为弱酸。
(3)从酸根离子是否能发生水解的角度判断
强酸根离子不水解,弱酸根离子易发生水解。据此可以判断HA是强酸还是弱酸。如判断CH3COOH为弱酸可用以下两种方法:①配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。
②用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:测得pH>7。
【加固训练】
1.某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是 ( )
A.a点导电能力比b点强
B.b点的Kw值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点的c(H+)相等
【解析】选D。选项A,根据图示可知,a点对应的曲线为NaOH溶液稀释曲线,b、c点对应的曲线为氨水的稀释曲线,a点溶液中离子浓度小于b点溶液中离子浓度,a点导电能力更弱;选项B,Kw值只与温度有关,b、c两点Kw值相等;选项C,NH3·H2O的物质的量大于NaOH,稀释过程中溶质总量不变,所以c点消耗盐酸多;选项D,a、c两点溶液pH相等,则c(H+)相等。
2.下列说法中正确的是 ( )
A.加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B.室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C.氨水加水稀释后,溶液中c(NH3·H2O)/c(N)的值增大
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
【解析】选B。A、加水稀释,促进醋酸电离,但溶液中氢离子浓度减小,溶液中c(H+)·c(OH-)不变,所以c(OH-)增大,A错误;B、溶液中的c(H+)=0.1 mol·L-1
×0.1%=1.0×10-4 mol·L-1,则pH=4,B正确;C、加水稀释,弱碱溶液的电离平衡正向移动,的值减小,C错误;D、盐酸抑制了水的电离,铵根离子水解促进了水的电离,D错误。
关闭Word文档返回原板块