- 2021-07-02 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习苏教版炔、苯及其同系物的性质教案
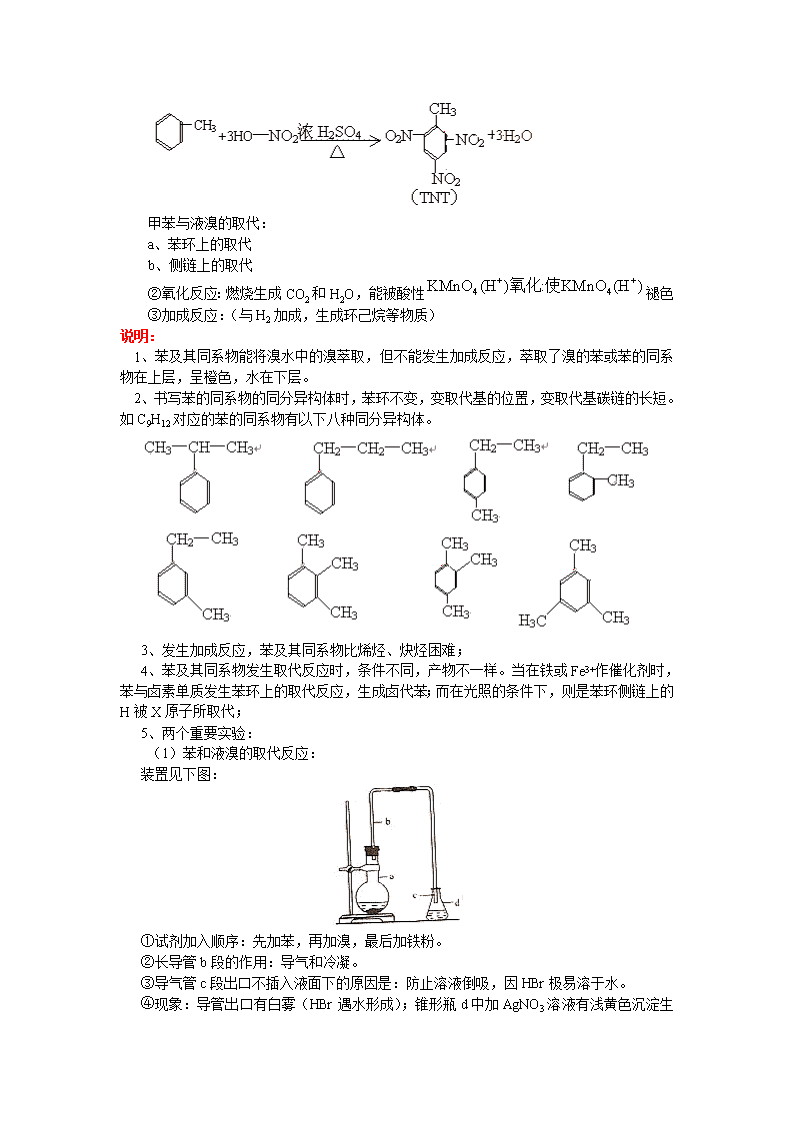
年 级 高三 学 科 化学 版 本 苏教版 内容标题 高三第一轮复习:炔、苯及其同系物的性质 【本讲教育信息】 一. 教学内容: 炔、苯及其同系物的性质 二、教学目标 了解乙炔的组成与结构,掌握乙炔的性质及用途;了解炔烃的结构与性质; 了解苯的组成和结构特征,掌握苯及其同系物的化学性质。 三、教学重点、难点 炔烃的性质,苯及其同系物的结构与性质 四、教学过程: (一)乙炔、炔烃: 乙炔是一种无色无味的气体,密度比空气小,不溶于水。乙炔分子中C原子以sp杂化方式与其他原子形成共价键,因此,乙炔的结构式为:H-C≡C-H,分子中每个原子都处于同一条直线上,键角为180°。但乙炔分子中C≡C小于三倍的C-C单键的键能之和,也小于单键和双键的键能之和,因此乙炔的性质也比较活泼,能与X2、HX等物质发生加成反应,也能被酸性KMnO4溶液等强氧化剂所氧化。 乙炔的化学性质: ①与X2、HX和H2O等物质的加成反应 ②燃烧与酸性KMnO4溶液作用使其褪色 ③在一定条件下,乙炔还能发生聚合反应:如三聚可得到苯,或发生加聚反应,生成高分子化合物聚乙炔等 乙炔的实验室制法: 说明: 1、炔烃的结构与乙炔的结构相似,分子中都存在C≡C,C≡C含一个键和2个π键,与C≡C直接相连的原子处于同一条直线上,其不饱和度为2; 2、C=C与H2加成时,完全加成的物质的量之比为1:1,而C≡C与H2加成时,完全加成时的物质的量之比为1:2; 3、二烯烃(含两个C=C)与炔烃的通式相同,两者互为同分异构体。二烯烃与X2、H2加成时,有多种可能,可以加成一个C=C,也可以加成两个C=C;若是共轭二烯,则还可以发生1,4加成等; 4、实验室制取乙炔时,为得到平缓的乙炔气流,用块状电石代替粉末状电石,用饱和食盐水代替水,并用分液漏斗向锥形瓶(或烧瓶)内逐滴加入;生成的乙炔中由于含有H2S、PH3等气体而带有特殊难闻的气味,可通过CuSO4溶液除去。 [例1]描述分子结构的下列叙述中,正确的是: A、6个碳原子有可能都在一条直线上 B、6个碳原子不可能都在一条直线上 C、6个碳原子有可能都在同一平面上 D、6个碳原子不可能都在同一平面上 解析:C=C属于平面型结构,与C=C所直接相连的原子处于同一平面上,C≡C属于直线型结构,与之直接相连的原子处于同一条直线上。同时,由于单键可以旋转,因此CH3、CF3上各有一个H或F原子与双键处于同一平面,因此该结构中肯定共面的原子有8个,其中有6个是碳原子,可能共面的原子有10个;而共线的原子只有4个。故本题的答案为:BC 答案:BC [例2]1mol某烃最多能与2mol氯化氢发生加成反应,生成氯代烃。1mol该氯代烃能和6mol氯气发生取代反应,生成只含碳元素和氯元素的氯代烃。求该烃的分子式及可能的结构简式。 解析:设该有机物的化学式为CxHy,则有: CxHy+2HCl→CxHy+2Cl2;CxHy+2Cl2+6Cl2→CxCl8+6HCl,由此可得: 2x+2=8,2+y=6,解得:x=3,y=4,则该烃的化学式为:C3H4, 结构简式为:CH3-C≡CH 答案:C3H4、CH3-C≡CH (二)苯及其同系物: 1、苯的结构:分子式:C6H6,最简式CH,结构简式:(凯库勒式) 结构特点:苯分子为平面结构,碳碳键的键长、键角均相等,键角120°,键长介于单、双键之间,苯分子中的键是一种独特的键,由一个大π键和6个键组成。 2、苯的性质 物理性质:苯是一种无色、有特殊香味、易挥发的液体,熔点5.5℃、沸点80.5℃,当温度较低时凝结成无色晶体。比水轻,难溶于水,是常用的有机溶剂,苯是重要的有机化工原料。 苯的化学性质:苯分子的特殊结构决定了苯分子稳定性,常温下苯不与溴水发生加成反应,也不能被酸性KMnO4溶液所氧化,在一定条件下,苯能与Cl2、溴单质、浓硝酸等发生反应。 ⑴取代反应(与卤素单质、浓硝酸的取代): ⑵燃烧反应: ⑶加成反应(与H2加成) 3、苯的同系物: 苯分子中的H原子被烷基取代后的生成物,其分子通式为:CnH2n-6(n≥6),而芳香烃是指分子中有苯环的烃,它可以含有1个或多个苯环,苯的同系物属于芳香烃。芳香族化合物是指分子里含有一个或多个苯环的化合物,它包括芳香烃和它们的衍生物。 苯的同系物的物理性质:苯的同系物一般为无色液体,具有特殊气味,有毒,难溶于水,密度比相对分子质量相近的烷烃及烯烃的大,但小于1,其中甲苯、二甲苯常用作有机溶剂. 苯的同系物的化学性质 苯的同系物中含苯环和烷基,二者共同影响,使苯的同系物的性质不是苯和烷烃的性质的简单相加。苯的同系物的化学性质与苯相似。 ①取代(比苯更容易,侧链对苯环的影响) 甲苯与液溴的取代: a、苯环上的取代 b、侧链上的取代 ②氧化反应:燃烧生成CO2和H2O,能被酸性褪色 ③加成反应:(与H2加成,生成环己烷等物质) 说明: 1、苯及其同系物能将溴水中的溴萃取,但不能发生加成反应,萃取了溴的苯或苯的同系物在上层,呈橙色,水在下层。 2、书写苯的同系物的同分异构体时,苯环不变,变取代基的位置,变取代基碳链的长短。如C9H12对应的苯的同系物有以下八种同分异构体。 3、发生加成反应,苯及其同系物比烯烃、炔烃困难; 4、苯及其同系物发生取代反应时,条件不同,产物不一样。当在铁或Fe3+作催化剂时,苯与卤素单质发生苯环上的取代反应,生成卤代苯;而在光照的条件下,则是苯环侧链上的H被X原子所取代; 5、两个重要实验: (1)苯和液溴的取代反应: 装置见下图: ①试剂加入顺序:先加苯,再加溴,最后加铁粉。 ②长导管b段的作用:导气和冷凝。 ③导气管c段出口不插入液面下的原因是:防止溶液倒吸,因HBr极易溶于水。 ④现象:导管出口有白雾(HBr遇水形成);锥形瓶d中加AgNO3 溶液有浅黄色沉淀生成。 ⑤烧瓶的橡胶塞用锡箔包住的原因:防溴蒸气腐蚀胶塞。 ⑥把反应后圆底烧瓶中混合液分离开的方法:把混合液倒入盛水的烧杯,底部有褐色不溶于水的液体(这是溶有溴单质的溴苯),再向其中加入NaOH溶液洗涤(除Br2)后用分液漏斗分液即可,纯净的溴苯是无色不溶于水的液体。 ⑦苯的用量不可太多,因苯、溴苯、溴相互溶解,当反应混合物倒入水中时不会在烧杯底部看到褐色液体。 (2)苯的硝化反应: ①试剂加入顺序是先加浓HNO3再加浓H2SO4,冷却后再加入苯,因为若先把浓HNO3加到浓H2SO4中易发生液体飞溅;两种酸混合时放出大量的热,易使HNO3分解,使苯挥发并会出现其他副反应。 ②用水浴加热,温度计水银球应插入水浴中。水浴加热的好处:a受热均匀,b温度易控制。测水浴温度,应把水银球放入水浴中。要与实验室制乙烯时温度计的位置区别开来。 ③硝基苯是无色、有毒、有苦杏仁味的油状液体,密度比水大。生成的硝基苯有黄色,原因是溶解了NO2。可通过加NaOH溶液的方法除去,然后分液。 [例1]能说明苯分子平面正六边形结构中碳碳键不是单双键相交替的事实是: A、苯的一元取代物没有同分异构体 B、苯的间位二元取代物只有一种 C、苯的邻位二元取代物只有一种 D、苯的对位二元取代物只有一种 解析:如果苯分子是单、双键交替组成的环状结构,则苯分子的结构应为,那么苯的邻 位二元取代物存在两种结构,即 但是实际上苯的邻位二元取代物不存在同分异构体,说明苯分子中的碳碳键都是完全等同的。 答案:C [例2]在沥青蒸汽里含有多种稠环芳香烃,其中一些可视为同系物,如A,B,C……所示。它们都含有偶数个苯环结构。 (1)该系列化合物中,相邻两化合物间递增的值中的n和m 的数值分别是:n= ,m= ,其等差数列的公差为 。 (2)该系列化合物的通式为 。 (3)该系列化合物中第25个分子式是 。 (4)该系列化合物分子中所含C、H原子数的最大比值最接近于 (5)该系列化合物中所含碳元素的最大质量分数是 。 解析:(1)根据上述三种化合物的结构简式,可知其分子式分别为C10H8、C16H10、C22H12,从而可知这个等差数列的公差为C6H2,其中n=6,m=2。 (2)求通式要在分析前后两个分子式之差的基础上进行,令n=1时分子式为C10H8,因等差数列的公差为C6H2,则通式为C6n+4H2n+6(n=1,2,3……) 或者根据其分子式分别为C10H8、C10+6H8+2、C10+6+6H8+2+2可知,每增加两个苯环,分子中就增加6个碳原子(故碳原子是6n倍增加),增加2个氢原子(故氢原子是2n倍增加),则通式为C6n+4H2n+6。 (3)当n=25时,则分子式为。 (4)该系列化合物分子中所含C、H原子数的最大比值可通过该化合物的通式求极限求得: (5)该系列化合物中碳的最大质量分数为 当时,的极大值为 答案:(1)n=6,m=2; (2)C6n+4H2n+6(n=1,2,3……); (3) (4) (5) [例3]二甲苯苯环上的一溴代物有六种同分异构体,可以用还原法制得三种二甲苯,它们的熔点分别如下: 六种溴二甲苯的熔点/℃ 234 206 213 204 214 205 对应还原二甲苯的熔点/℃ 13 -54 -27 -54 -27 -54 由此可推断熔点为234℃的分子的结构简式为 ,熔点为-54℃的分子的结构简式为 。 解析:对于数据题首先应该分析数据,找出规律。本题中第一行给出六种物质的熔点,而还原后只有3个熔点数据,其中熔点为206℃、204℃、205℃的三种溴二甲苯还原后得到同一种二甲苯,其熔点为-54℃;熔点为213℃和214℃的两种二甲苯还原后也得到同一种熔点为-27℃ 的二甲苯,由此说明,有一种二甲苯的苯环上的一溴代物有三种,有一种二甲苯的一溴代物有两种,当然剩下的一种二甲苯的一溴代物只有一种。这样就把问题转化成了判断二甲苯的一溴化物的同分异构体数目。二甲苯有三种:邻二甲苯,间二甲苯,对二甲苯,它们对应的一溴二甲苯的结构简式如下: 所以,有三种一溴二甲苯的是间二甲苯,只有一种一溴二甲苯的是对二甲苯。 答案: [例4]实验室用如图所示装置进行苯与溴反应的实验,请回答下列问题。 (1)若装置中缺洗气瓶,则烧杯中产生的现象无法说明苯与溴的反应是取代反应,理由是: (2)反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢。可通过以下操作除去:①水洗;②碱洗;③水洗;④干燥;⑤……。其中,操作②碱洗的目的是 完成操作④干燥后,接下来的操作⑤是 (填操作名称) (3)如果省略(2)中的操作①,一开始就进行碱洗,会对后面的操作造成什么影响?(简要说明理由) 解析:若装置中缺洗气瓶,则挥发出的溴蒸气进入AgNO3溶液中生成AgBr沉淀,无法确定溴与苯反应有HBr生成。粗溴苯中含溴、FeBr3、HBr,苯等杂质,所以水洗目的是除去FeBr3、HBr,用碱洗的目的是除去溴及未除净的HBr,再水洗的目的是除去生成的NaBr、NaBrO,接下来干燥是除去其中的水分,再接下来是除去苯,所需操作为蒸馏。很显然,一开始用碱洗的后果会生成Fe(OH)3沉淀,而使分离较难。 答案:(1)溴与AgNO3溶液反应生成AgBr沉淀,无法确定溴与苯反应有HBr生成 (2)除去粗溴苯中的溴和溴化氢;蒸馏(或分馏) (3)先用碱洗,溴化铁与碱反应生成Fe(OH)3沉淀,很难分离。查看更多