- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习常见金属元素及其化合物作业(全国通用)
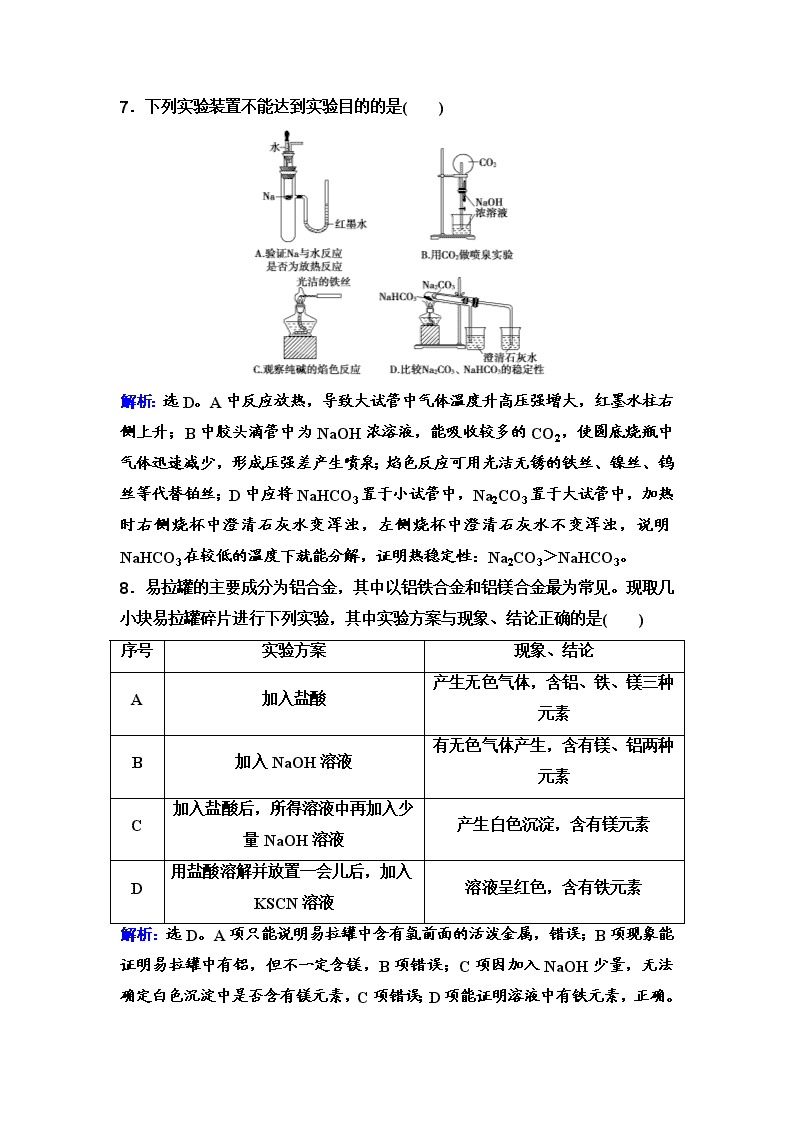
2019届二轮复习 常见金属元素及其化合物 1.下列有关物质性质及应用的说法正确的是( ) A.过量的铜与浓硝酸反应可生成NO B.Fe在O2中的燃烧产物可用于制红色涂料 C.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 解析:选A。铜与浓硝酸反应生成NO2,过量的铜与浓硝酸反应会使硝酸变稀,可生成NO,A正确;制红色涂料的主要成分是三氧化二铁,Fe在O2中的燃烧产物是四氧化三铁,故B错误;Al是活泼性较强的金属,用电解冶炼法得到,故C错误;Fe2+、SO2都能使酸性高锰酸钾溶液褪色,都表现出还原性,故D错误。 2.下列制备金属单质的方法或原理正确的是( ) A.在高温条件下,用H2还原MgO制备单质Mg B.在通电条件下,电解熔融Al2O3制备单质Al C.在通电条件下,电解饱和食盐水制备单质Na D.加强热,使CuO在高温条件下分解制备单质Cu 解析:选B。Mg的活泼性强,不能用H2还原法制备Mg,而应该用电解熔融MgCl2的方法制备,电解饱和食盐水得到NaOH而不是Na;CuO强热分解生成Cu2O而不是Cu。 3.金属材料在日常生活以及生产中有着广泛的应用。下列关于金属的一些说法不正确的是( ) A.合金的性质与其成分金属的性质不完全相同 B.工业上金属Mg、Cu都是用热还原法制得的 C.金属冶炼的本质是金属阳离子得到电子变成金属原子 D.越活泼的金属越难冶炼 解析:选B。合金的化学性质与成分金属的化学性质相似,物质性质略有不同,A正确;Mg在工业上用电解法冶炼,Cu用热还原法冶炼,B错误;金属冶炼的实质是Mn++ne-===M,C正确;金属越活泼,则金属离子的氧化性越弱,越难被还原,D正确。 4.常温下,下列物质与NaOH溶液、稀H2SO4、H2O2溶液均能发生反应的是( ) A.Fe(NO3)2 B.SiO2 C.Al(OH)3 D.CuSO4 解析:选A。A.Fe(NO3)2中的亚铁离子具有还原性,能够被双氧水氧化,能够与氢氧化钠反应生成氢氧化亚铁沉淀,含有硝酸根离子,加入稀硫酸,能够将亚铁离子氧化,故选A;B.SiO2不能与稀硫酸反应,故不选;C.Al(OH)3不能被双氧水氧化,故不选;D.CuSO4与双氧水和稀硫酸均不反应,故不选。 5.有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( ) A.相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强 B.常温时水溶性:Na2CO3>NaHCO3 C.在酒精灯加热的条件下,前者不分解,后者分解 D.将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀 解析:选D。A.碳酸根离子水解能力强于碳酸氢根离子,所以相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强,正确;B.常温时水溶性:Na2CO3>NaHCO3,正确;C.NaHCO3不稳定,加热易分解:2NaHCO3Na2CO3+CO2↑+H2O,碳酸钠受热不易分解,较稳定,正确;D.Na2CO3和NaHCO3都能与澄清的石灰水反应生成沉淀,错误。 6.分别向CuSO4溶液和FeSO4溶液中加入等量的金属钠,下列说法一定正确的是( ) A.两溶液中均有金属单质析出 B.CuSO4溶液中最终有蓝色沉淀生成 C.FeSO4溶液中最终有白色沉淀生成 D.钠在CuSO4溶液中的反应更剧烈 解析:选B。钠是活泼的金属,投入溶液中首先与水反应生成氢氧化钠和氢气,因此两溶液中均没有金属单质析出,A错误;CuSO4溶液中最终有蓝色沉淀氢氧化铜生成,B正确;FeSO4溶液中首先产生氢氧化亚铁白色沉淀,最终转化为红褐色沉淀氢氧化铁,C错误;钠在溶液中反应的剧烈程度与溶液中氢离子浓度有关系,不能确定溶液中氢离子的浓度,因此不能比较反应的剧烈程度,D错误。 7.下列实验装置不能达到实验目的的是( ) 解析:选D。A中反应放热,导致大试管中气体温度升高压强增大,红墨水柱右侧上升;B中胶头滴管中为NaOH浓溶液,能吸收较多的CO2,使圆底烧瓶中气体迅速减少,形成压强差产生喷泉;焰色反应可用光洁无锈的铁丝、镍丝、钨丝等代替铂丝;D中应将NaHCO3置于小试管中,Na2CO3置于大试管中,加热时右侧烧杯中澄清石灰水变浑浊,左侧烧杯中澄清石灰水不变浑浊,说明NaHCO3在较低的温度下就能分解,证明热稳定性:Na2CO3>NaHCO3。 8.易拉罐的主要成分为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是( ) 序号 实验方案 现象、结论 A 加入盐酸 产生无色气体,含铝、铁、镁三种元素 B 加入NaOH溶液 有无色气体产生,含有镁、铝两种元素 C 加入盐酸后,所得溶液中再加入少量NaOH溶液 产生白色沉淀,含有镁元素 D 用盐酸溶解并放置一会儿后,加入KSCN溶液 溶液呈红色,含有铁元素 解析:选D。A项只能说明易拉罐中含有氢前面的活泼金属,错误;B项现象能证明易拉罐中有铝,但不一定含镁,B项错误;C项因加入NaOH少量,无法确定白色沉淀中是否含有镁元素,C项错误;D项能证明溶液中有铁元素,正确。 9.将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( ) 解析:选A。假定含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1 mol,反应顺序:开始滴加NaOH发生为Al3++3OH-===Al(OH)3↓,沉淀逐渐增大,当Al3+沉淀完全时需加入6 mol OH-,生成Al(OH)3 2 mol,达最大值;再发生NH+OH-===NH3·H2O;NH完全反应时需2 mol OH-,该过程中沉淀氢氧化铝的量不变;最后继续加NaOH,发生反应Al(OH)3+OH-===AlO+2H2O,直到2 mol Al(OH)3溶解,需再加入2 mol NaOH。三段过程消耗NaOH的物质的量之比为6 mol∶2 mol∶2 mol=3∶1∶1,三阶段消耗NaOH溶液的体积比为3∶1∶1。A.从图像可知,开始滴加NaOH,即生成沉淀,达最大后,(铝离子完全反应)继续加NaOH,铵根离子开始反应,沉淀不变,当铵根离子反应完毕,氢氧根使氢氧化铝沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3∶1∶1,图像A符合,故正确;B.图为先与铵根离子反应,离子反应的顺序错误,故错误;C.未考虑铵根离子的反应、氢氧化铝溶解消耗的氢氧化钠的物质的量不相符,故错误;D.三阶段消耗NaOH溶液的体积比为3∶1∶1,图中比例为2∶1∶2不符合,故错误。 10.用已被部分氧化的金属屑A制备某工业常用的无水盐C的步骤如下: C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变成红褐色,下列判断正确的是( ) A.过滤所得的残渣中一定没有金属A B.滤液可能是CuSO4溶液或MgSO4溶液 C.水合盐B可能是FeSO4·7H2O D.无水盐C可能是Fe2(SO4)3 解析:选C。无水盐C中有Fe2+,没有Fe3+,D错误;A为部分氧化的金属屑,说明A含有Fe2O3和Fe,由于最终无Fe3+,故Fe过量,A、B错误。 11.铅的单质、氧化物、盐在现代工业中有着重要用途。 Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为________________________________________________________________________。 Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下: (2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1 mol PbSO4转移电子的物质的量为________ mol。 (3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示: ②粗品PbO中所含杂质不溶于NaOH溶液。 综合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量________(填“35%”或“10%”)的NaOH溶液中,加热至110 ℃,充分溶解后,________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。 (4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液, 电解Na2PbCl4溶液生成Pb的装置如图所示。 ①阴极的电极反应式为________________________________________________________________________。 ②电解一段时间后,Na2PbCl4浓度大大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________________________________________________________ ________________________________________________________________________。 解析:Ⅰ.(1)由题目信息可知Pb3O4中铅的化合价为+2、+4两种价态,组成相当于2PbO·PbO2,由于PbO2是酸性氧化物,故它不能与硝酸反应,PbO是碱性氧化物,它与硝酸发生非氧化还原反应,生成Pb(NO3)2,由此可写出对应的化学方程式:Pb3O4+4HNO3===2Pb(NO3)2+PbO2+2H2O。Ⅱ.(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4和水,反应方程式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,根据方程式中Pb元素的化合价变化可知,每生成2 mol PbSO4,转移电子2 mol,则生成1 mol PbSO4转移电子的物质的量为1 mol。(3)根据PbO的溶解度曲线特点可知,在浓度高的NaOH溶液及较高的温度下,PbO的溶解度大,因此将粗品PbO溶解在一定量35%的NaOH溶液中,加热至110 ℃,充分溶解后,在高温下趁热过滤除去杂质,将滤液冷却结晶,过滤、洗涤并干燥即可得到高纯PbO固体。(4)①根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为PbCl+2e-===Pb+4Cl-。②电解一段时间后,Na2PbCl2的浓度大大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO粗品。 答案:(1)Pb3O4+4HNO3===2Pb(NO3)2+PbO2+2H2O (2)1 (3)35% 趁热过滤 (4)①PbCl+2e-===Pb+4Cl- ②继续向阴极区加PbO粗品 12.镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线: 已知:(NH4)2SO4在350 ℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。 (1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________________________________________________________________。 (2)“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。 (3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍。 (4)“浸出液”中c(Ca2+)=1.0×10-3 mol·L-1,当除钙率达到99%时,溶液中c(F-)=________ mol·L-1。[已知Ksp(CaF2)=4.0×10-11] (5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。 解析:(1)混合研磨,增大接触面积,加快反应速率,使反应更充分;(2)SiO2不溶于水,Ca2+和SO生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒,n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+)/n(Fe3+)=0.5;(4)除钙后溶液中c(Ca2+)=1.0×10-3×1% mol·L-1=1.0×10-5 mol·L-1,Ksp=c(Ca2+)×c2(F-),c(F-)=2.0×10-3 mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25。 答案:(1)增大接触面积,加快反应速率,使反应更充分 (2)SiO2、CaSO4 (3)0.5 (4)2.0×10-3 (5)0.25 13.工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下: (1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为________和________(填离子符号)。 (2)写出氧化过程中MnO2与SO2反应的化学方程式: ________________________________________________________________________。 (3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是________。 (4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是________________________________________________________________________ ________________________________________________________________________。 (5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:________________________________________________________________________。 解析:(1)“浸锰”操作时MnO2被SO2还原为Mn2+,则过滤Ⅰ所得滤液中主要存在的两种金属阳离子为Mn2+和Fe2+;(2)氧化过程中MnO2被还原为Mn2+, SO2被氧化为SO,发生反应的化学方程式为MnO2+SO2===MnSO4;(3)由图示可知温度在90 ℃左右时,锰的浸出率最高,此时MnS2O6的生成率最低,则“浸锰”的适宜温度是90 ℃;(4)因NH4HCO3稳定性差,受热易分解,向过滤Ⅱ所得的滤渣中加入NH4HCO3溶液时温度不宜太高的原因是防止NH4HCO3受热分解,提高原料利用率;(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,此气体应为CO2,发生反应的离子方程式为Mn2++2HCO===MnCO3↓+CO2↑+H2O。 答案:(1)Mn2+ Fe2+ (2)MnO2+SO2===MnSO4 (3)90 ℃ (4)原因是防止NH4HCO3受热分解,提高原料利用率 (5)Mn2++2HCO===MnCO3↓+CO2↑+H2O查看更多