- 2021-07-02 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版盖斯定律及其应用学案
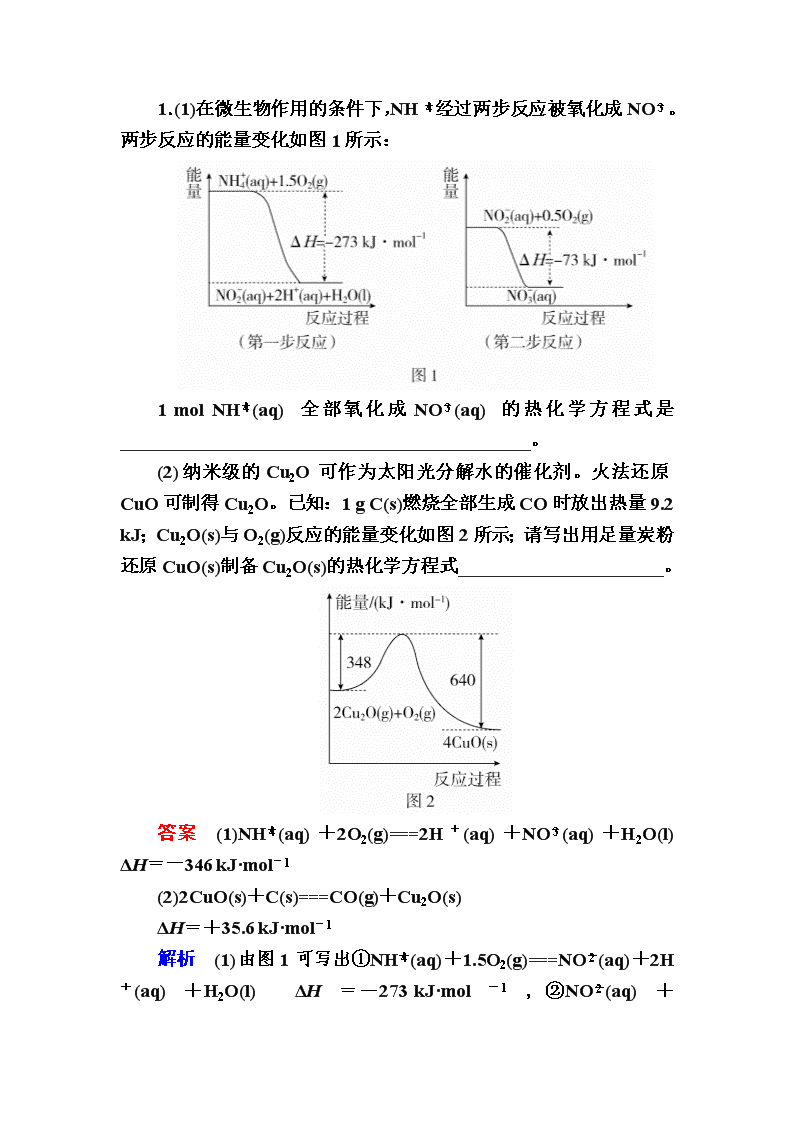
第2节 盖斯定律及其应用 考试说明 理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 命题规律 盖斯定律的应用是高考的常考考点,主要是盖斯定律应用于未知反应反应热的计算和未知反应的热化学方程式的书写,以填空题型出现。 考点 盖斯定律及其应用 1.盖斯定律 (1)内容:对于一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的。即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。如: (2)意义:间接计算某些反应的反应热。 已知在25 ℃、101 kPa时: ①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1, ②2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1, 则CO(g)+O2(g)===CO2(g)的ΔH为-283_kJ·mol-1。 2.利用盖斯定律书写热化学方程式的步骤 (1)化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。 (2)应用盖斯定律常用以下两种方法: ①热化学方程式相加或相减,如由 C(s)+O2(g)===CO2(g) ΔH1; C(s)+O2(g)===CO(g) ΔH2; 可得2CO(g)+O2(g)===2CO2(g) ΔH=2(ΔH1-ΔH2) ②合理设计反应途径,如甲,则ΔH=ΔH1+ΔH2。 题组一 利用盖斯定律书写热化学方程式 1.(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化如图1所示: 1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是____________________________________________。 (2)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O。已知:1 g C(s)燃烧全部生成CO时放出热量9.2 kJ;Cu2O(s)与O2(g)反应的能量变化如图2所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式______________________。 答案 (1)NH(aq)+2O2(g)===2H+(aq)+NO(aq)+H2O(l) ΔH=-346 kJ·mol-1 (2)2CuO(s)+C(s)===CO(g)+Cu2O(s) ΔH=+35.6 kJ·mol-1 解析 (1)由图1可写出①NH(aq)+1.5O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ·mol-1,②NO(aq)+0.5O2(g)??NO(aq) ΔH=-73 kJ·mol-1,利用盖斯定律①+②可得所求结果。 (2)1 mol C燃烧全部生成CO放出的热量为12 g×9.2 kJ·g-1=110.4 kJ,C与O2反应生成CO的热化学方程式为2C(s)+O2(g)===2CO(g) ΔH=-220.8 kJ·mol-1;由图2可知,Cu2O与O2反应的热化学方程式为2Cu2O(s)+O2(g)===4CuO(s) ΔH=-292 kJ·mol-1;第一个热化学方程式减去第二个热化学方程式,然后除以2,即得热化学方程式:2CuO(s)+C(s)===CO(g)+Cu2O(s) ΔH=+35.6 kJ·mol-1。 2.(1)已知:Al2O3(s)+3C(s)===2Al(s)+3CO(g) ΔH1=+1344.1 kJ·mol-1 2AlCl3(g)===2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ·mol-1 由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 ______________________________________________________。 (2)已知:25 ℃、101 kPa时, Mn(s)+O2(g)===MnO2(s)ΔH=-520 kJ·mol-1 S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1 Mn(s)+S(s)+2O2(g)===MnSO4(s)ΔH=-1065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________________________________。 (3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。温度为T时,该反应的热化学方程式为_____________________________。已知温度为T时: CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165 kJ·mol-1 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 (4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。 已知25 ℃,101 kPa时: 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1648 kJ·mol-1 C(s)+O2(g)===CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1480 kJ·mol-1 FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______________________________________________________。 答案 (1)Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+174.9 kJ·mol-1 (2)MnO2(s)+SO2(g)===MnSO4(s)ΔH=-248 kJ·mol-1 (3)CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206 kJ·mol-1 (4)4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1 解析 (1)根据盖斯定律,由题中第一个热化学方程式减去第二个热化学方程式可得Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g) ΔH=+1344.1 kJ·mol-1-1169.2 kJ·mol-1=+174.9 kJ·mol-1。 (2)设所给热化学方程式依次为①②③,根据盖斯定律,由③-②-①可得:MnO2(s)+SO2(g)===MnSO4(s) ΔH=-1065 kJ·mol-1+297 kJ·mol-1+520 kJ·mol-1=-248 kJ·mol-1。 (3)将题中两个已知的热化学方程式依次编号为①、②,根据盖斯定律,由②-①可得CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206 kJ·mol-1。 (4)由盖斯定律,将题中已知的第二个热化学方程式乘以4与第一个热化学方程式相加,再减去2倍的第三个热化学方程式,即得:4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1。 题组二 反应热的计算 3.在298 K、101 kPa时,已知: ①2H2O(g)===O2(g)+2H2(g) ΔH1 ②H2(g)+Cl2(g)===2HCl(g) ΔH2 ③2H2O(g)+2Cl2(g)===4HCl(g)+O2(g) ΔH3 则ΔH3与ΔH1、ΔH2之间的关系正确的是( ) A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2 C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2 答案 A 解析 分析题给三个热化学方程式,根据盖斯定律,由①+②×2可得③2H2O(g)+2Cl2(g)===4HCl(g)+O2(g),则有ΔH3=ΔH1+2ΔH2。 4.设NA为阿伏加德罗常数的值。已知反应: ①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-a kJ·mol-1 ②CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2=-b kJ·mol-1 其他数据如下表: 下列说法正确的是( ) A.ab,A错误;根据反应热与键能的关系可知,反应②的反应热ΔH2=(413 kJ·mol-1×4+2x kJ·mol-1)-(798 kJ·mol-1×2+463 kJ·mol-1×4)=-b kJ·mol-1 ,则有x=,B正确;根据盖斯定律,由①×-②×可得H2O(g)===H2O(l),则有ΔH=- kJ·mol-1,C错误;当有4NA个C—H键断裂时,反应中消耗1 mol CH4(g),若生成H2O(l)则放出a kJ热量,若生成H2O(g)则放出b kJ热量,D错误。 1.反应热的计算 (1)主要依据 热化学方程式、键能、盖斯定律及燃烧热、中和热等。 (2)主要方法 ①根据热化学方程式计算 反应热与反应物和生成物各物质的物质的量成正比。 ②根据反应物和生成物的总能量计算 ΔH=E生成物-E反应物 ③依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算 ΔH=E反应物的总键能-E生成物的总键能 ④根据物质燃烧热数值计算 Q(放)=n(可燃物)×|ΔH| ⑤根据比热公式进行计算 Q=c·m·Δt 2.反应热的比较 (1)根据反应物的本性比较 等物质的量的不同物质与同一种物质反应时,性质不同,其反应热不同,一般情况,等物质的量的不同金属或非金属与同一物质发生反应,金属或非金属越活泼,反应就越容易,放出的热量就越多,ΔH越小。 如:①2K(s)+H2O(l)===2KOH(aq)+H2(g) ΔH1 2Na(s)+H2O(l)===2NaOH(aq)+H2(g) ΔH2 ΔH1<ΔH2 ②H2(g)+Cl2(g)===2HCl(g) ΔH3 H2(g)+Br2(g)===2HBr(g) ΔH4 ΔH3<ΔH4 (2)依据反应物或产物的状态比较 同一反应,反应物或生成物状态不同时要考虑A(g)A(l)A(s),或者从三种状态自身的能量比较:E(g)>E(l)>E(s),可以判断反应热的大小。(或利用盖斯定律得三态变化的热效应,从而判断ΔH大小) 如:①S(s)+O2(g)===SO2(g) ΔH1 S(g)+O2(g)===SO2(g) ΔH2 ΔH1>ΔH2 ②2H2(g)+O2(g)===2H2O(g) ΔH3 2H2(g)+O2(g)===2H2O(l) ΔH4 ΔH3>ΔH4 (3)依据反应进行的程度比较 对于燃烧反应,燃烧越充分放出的热量就越多,ΔH越小。 如:2C(s)+O2(g)===2CO(g) ΔH1 2C(s)+2O2(g)===2CO2(g) ΔH2 ΔH1>ΔH2 1.[2017·江苏高考]通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( ) ①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1 ②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1 ③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1 ④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1 A.反应①、②为反应③提供原料气 B.反应③也是CO2资源化利用的方法之一 C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1 D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1 答案 C 解析 A对:反应③的反应物是反应①、②的产物,所以反应①、②为反应③提供原料气。B对:反应③是CO2与H2反应制取甲醇,是CO2资源化利用的方法之一。C错:该反应产物H2O为气态时,ΔH= kJ·mol-1才能成立。D对:根据盖斯定律,反应②×2+③×2+④可得反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1。 2.[2016·江苏高考]通过以下反应均可获取H2。下列有关说法正确的是( ) ①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g) ΔH2=131.3 kJ·mol-1 ③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·mol-1 答案 D 解析 A项,反应①是光能转化为化学能,错误;B项,反应②的焓变为正值,属于吸热反应,错误;C项,催化剂不会改变反应的焓变,错误;D项,根据盖斯定律,③-②得所求反应,其焓变为:206.1 kJ·mol-1-131.3 kJ·mol-1=+74.8 kJ·mol-1,正确。 3.[2017·高考题组](1)[全国卷Ⅰ]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________、________________________,制得等量H2所需能量较少的是________。 (2)[全国卷Ⅱ]已知: As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1 H2(g)+O2(g)===H2O(l) ΔH2 2As(s)+O2(g)===As2O5(s) ΔH3 则反应As2O5(s)+3H2O(l)===2H3AsO4(s)的ΔH= ________________。 答案 (1)H2O(l)===H2(g)+O2(g) ΔH=286 kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=20 kJ·mol-1 系统(Ⅱ) (2)2ΔH1-3ΔH2-ΔH3 解析 (1)令题干中的四个热化学方程式分别为: ①H2SO4(aq)===SO2(g)+H2O(l)+O2(g) ΔH1=327 kJ·mol-1 ②SO2(g)+I2(s)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH2=-151 kJ·mol-1 ③2HI(aq)===H2(g)+I2(s) ΔH3=110 kJ·mol-1 ④H2S(g)+H2SO4(aq)===S(s)+SO2(g)+2H2O(l) ΔH4=61 kJ·mol-1 根据盖斯定律,①+②+③可得,系统(Ⅰ)中的热化学方程式: H2O(l)===H2(g)+O2(g) ΔH=ΔH1+ΔH2+ΔH3=327 kJ·mol-1-151 kJ·mol-1+110 kJ·mol-1=286 kJ·mol-1 同理,②+③+④可得,系统(Ⅱ)中的热化学方程式: H2S(g)===H2(g)+S(s) ΔH=ΔH2+ΔH3+ΔH4=-151 kJ·mol-1+110 kJ·mol-1+61 kJ·mol-1=20 kJ·mol-1 由所得两热化学方程式可知,制得等量H2所需能量较少的是系统(Ⅱ)。 (2)令:①As(s)+H2(g)+2O2(g)===H3AsO4(s) ΔH1 ②H2(g)+O2(g)===H2O(l) ΔH2 ③2As(s)+O2(g)===As2O5(s) ΔH3 根据盖斯定律,将反应①×2-②×3-③可得:As2O5(s)+3H2O(l)===2H3AsO4(s) ΔH=2ΔH1-3ΔH2-ΔH3。 4.[高考集萃](1)[2016·全国卷Ⅱ]联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题: ①2O2(g)+N2(g)===N2O4(l) ΔH1 ②N2(g)+2H2(g)===N2H4(l) ΔH2 ③O2(g)+2H2(g)===2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4=________,联氨和N2O4可作为火箭推进剂的主要原因为_______________。 (2)[2016·全国卷Ⅲ]已知下列反应: SO2(g)+2OH-(aq)===SO(aq)+H2O(l) ΔH1 ClO-(aq)+SO(aq)===SO(aq)+Cl-(aq) ΔH2 CaSO4(s)===Ca2+(aq)+SO(aq) ΔH3 则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=________。 (3)[2015·广东高考]用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如右所示的催化循环实现。其中,反应①为2HCl(g)+CuO(s)??H2O(g)+CuCl2(s) ΔH1 反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为___________________________________________________ (反应热用ΔH1和ΔH2表示)。 (4)[2015·海南高考]已知:①Fe2O3(s)+3C(s)===2Fe(s)+3CO(g) ΔH=+494 kJ·mol-1 ②CO(g)+O2(g)===CO2(g) ΔH=-283 kJ·mol-1 ③C(s)+O2(g)===CO(g) ΔH=-110 kJ·mol-1 则反应Fe2O3(s)+3C(s)+O2(g)===2Fe(s)+3CO2(g)的ΔH=________kJ·mol-1。 理论上反应________放出的热量足以供给反应________所需要的热量。(填上述方程式序号) 答案 (1)2ΔH3-2ΔH2-ΔH1 反应放热量大,产生大量气体 (2)ΔH1+ΔH2-ΔH3 (3)4HCl(g)+O2(g)??2Cl2(g)+2H2O(g) ΔH=2(ΔH1+ΔH2) (4)-355 ②③ ① 解析 (1)根据盖斯定律,由③×2-②×2-①可得④,则ΔH4=2ΔH3-2ΔH2-ΔH1;联氨和N2O4反应释放出大量热、产物无污染、产生大量气体等,故联氨和N2O4可作为火箭推进剂。 (2)给三个反应依次编号为①、②、③,根据盖斯定律,由①+②-③可得:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq) ΔH=ΔH1+ΔH2-ΔH3。 (3)据图示写出反应②CuCl2(s)+O2(g)??CuO(s)+Cl2(g) ΔH2,由(①+②)×2可写出总反应的热化学方程式。 (4)由已知方程式①+3×②可得Fe2O3(s)+3C(s)+O2(g)===2Fe(s)+3CO2(g),根据盖斯定律,ΔH=(+494-283×3)kJ·mol-1=-355 kJ·mol-1,理论上②③两反应放出的热量足以供给①。 5.(1)[2016·四川高考]工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25 ℃、101 kPa时: CaO(s)+H2SO4(l)===CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1 5CaO(s)+3H3PO4(l)+HF(g)===Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1 则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 _________________________________________________。 (2)[2016·浙江高考]催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下: CO2(g)+3H2(g)??CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1 Ⅰ CO2(g)+H2(g)??CO(g)+H2O(g) ΔH2 Ⅱ 已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1。 ②H2O(l)===H2O(g) ΔH3=+44.0 kJ·mol-1 反应Ⅱ的ΔH2=________kJ·mol-1。 答案 (1)Ca5(PO4)3F(s)+5H2SO4(l)===5CaSO4(s)+3H3PO4(l)+HF(g) ΔH=-418 kJ·mol-1 (2)+41.2 解析 (1)由已知反应CaO(s)+H2SO4(l)===CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1①,5CaO(s)+3H3PO4(l)+HF(g)===Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1②,根据盖斯定律,①×5-②可得Ca5(PO4)3F(s)+5H2SO4(l)===5CaSO4(s)+3H3PO4(l)+HF(g) ΔH=5×(-271 kJ·mol-1)-(-937 kJ·mol-1)=-418 kJ·mol-1。 (2)利用已知①可写出两个热化学方程式:CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1③、H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1④,再结合②H2O(l)===H2O(g) ΔH3=+44.0 kJ·mol-1,依据盖斯定律,由④-③+②可得:CO2(g)+H2(g)??CO(g)+H2O(g) ΔH2=(-285.8 kJ·mol-1)-(-283.0 kJ·mol-1)+44.0 kJ·mol-1=+41.2 kJ·mol-1。 时间:45分钟 满分:100分 一、选择题(每题7分,共77分) 1.[2017·河北武邑中学调研]已知反应: ①H2(g)+O2(g)===H2O(g) ΔH1 ②N2(g)+O2(g)===NO2(g) ΔH2 ③N2(g)+H2(g)===NH3(g) ΔH3 则反应2NH3(g)+O2(g)===2NO2(g)+3H2O(g)的ΔH为( ) A.2ΔH1+2ΔH2-2ΔH3 B.ΔH1+ΔH2-ΔH3 C.3ΔH1+2ΔH2-2ΔH3 D.3ΔH1+2ΔH2+2ΔH3 答案 C 解析 根据盖斯定律,由①×3+②×2-③×2可得2NH3(g)+O2(g)===2NO2(g)+3H2O(g) 则有ΔH=3ΔH1+2ΔH2-2ΔH3,C项正确。 2.已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸、强碱稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1,则NH3·H2O在水溶液中电离的ΔH等于( ) A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1 答案 D 解析 由题给条件可先写出NH3·H2O(aq)+H+(aq)===NH(aq)+H2O(l) ΔH=-12.1 kJ·mol-1①,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1②,根据盖斯定律,由①-②即可得到NH3·H2O(aq)??NH(aq)+OH-(aq) ΔH=+45.2 kJ·mol-1,D正确。 3.[2017·河南洛阳期中]已知: ①Fe2O3(s)+C(s)===CO2(g)+2Fe(s) ΔH1=+234.1 kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1 则2Fe(s)+O2(g)===Fe2O3(s)的ΔH是( ) A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1 C.-744.7 kJ·mol-1 D.-159.4 kJ·mol-1 答案 A 解析 分析题给两个热化学方程式,根据盖斯定律,由×②-①可得:2Fe(s)+O2(g)===Fe2O3(s),则有ΔH=×ΔH2-ΔH1=×(-393.5 kJ·mol-1)-(+234.1 kJ·mol-1)≈-824.4 kJ·mol-1。 4.已知下列四个热化学方程式(ΔH的单位均为kJ/mol): NH4Cl(s)===NH3(g)+HCl(g) ΔH1=a(ⅰ) Ba(OH)2·8H2O(s)===BaO(s)+9H2O(l) ΔH2=b(ⅱ) 2NH4Cl(s)+Ba(OH)2·8H2O(s)===BaCl2(aq)+2NH3(g)+10H2O(l) ΔH3=c(ⅲ) BaO(s)+2HCl(aq)===BaCl2(aq)+H2O(l) ΔH4=d(ⅳ) 其中a、b、c均大于0,HCl气体溶解于水,溶液温度升高。由此可知下列判断一定正确的是( ) A.d<0 B.c<2a+b+d C.c=2a+b+d D.c>2a+b+d 答案 B 解析 通过给出的信息无法判断反应(ⅳ)是放热反应还是吸热反应,A错误;根据题目提示信息可得:HCl(g)===HCl(aq) ΔH5=e,由盖斯定律可确定c=2a+b+d+2e,因e<0,故c-(2a+b+d)<0,即c<2a+b+d,B正确,C、D错误。 5.Mg2Ni是一种储氢合金,已知: ①Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5 kJ·mol-1 ②Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1 ③Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3则ΔH3等于( ) A.-84.6 kJ·mol-1 B.+84.6 kJ·mol-1 C.-138.9 kJ·mol-1 D.+138.9 kJ·mol-1 答案 B 解析 根据盖斯定律,由②-①×2可得Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s),则有ΔH3=ΔH2-2ΔH1=(-64.4 kJ·mol-1)-(-74.5 kJ·mol-1)×2=+84.6 kJ·mol-1。 6.已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2 2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4 3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是( ) A.ΔH1>0, ΔH3<0 B.ΔH2>0,ΔH4>0 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 答案 C 解析 C与O2生成CO2的反应是放热反应,ΔH1<0,CO2与C生成CO的反应是吸热反应,ΔH2>0,CO与O2生成CO2的反应是放热反应,ΔH3<0,铁与氧气的反应是放热反应,ΔH4<0,A、B项错误;前两个方程式相减得:2CO(g)+O2(g)===2CO2(g) ΔH3=ΔH1-ΔH2,即ΔH1=ΔH2+ΔH3,C项正确;由4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4和6CO(g)+2Fe2O3(s)===6CO2(g)+4Fe(s) 2ΔH5相加,得2CO(g)+O2(g)===2CO2(g) ΔH3=(ΔH4+2ΔH5)/3,D项错误。 7.[2017·江西南昌摸底调研]已知: ①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1 则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为( ) A.+131.3 kJ·mol-1 B.-131.3 kJ·mol-1 C.+373.1 kJ·mol-1 D.-373.1 kJ·mol-1 答案 A 解析 根据盖斯定律,由①×-③×可得C(s)+H2O(g)===CO(g)+H2(g),则有ΔH=(-221.0 kJ·mol-1)×-(-483.6 kJ·mol-1)×=+131.3 kJ·mol-1。 8.已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1 H—H、O===O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( ) A.-332 B.-118 C.+350 D.+130 答案 D 解析 根据盖斯定律由题给的两个热化学方程式可得:2H2O(g)===2H2(g)+O2(g) ΔH=+(2a+220) kJ·mol-1,则有:4×462 kJ·mol-1-2×436 kJ·mol-1-496 kJ·mol-1=(2a+220) kJ·mol-1,解得a=+130,故选项D正确。 9.[2018·北京朝阳统考]联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料。已知: ①N2H4(l)+N2O4(l)===N2(g)+2H2O(l) ΔH=-546.45 kJ·mol-1 ②H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 则2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g)的ΔH是( ) A.-916.9 kJ·mol-1 B.-458.45 kJ·mol-1 C.+916.9 kJ·mol-1 D.+458.45 kJ·mol-1 答案 A 解析 根据盖斯定律,由①×2-②×4可得2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g),则有ΔH=(-546.45 kJ·mol-1)×2-(-44.0 kJ·mol-1)×4=-916.9 kJ·mol-1。 10.在1200 ℃时,天然气脱硫工艺中会发生下列反应: H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1 2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2 H2S(g)+O2(g)===S(g)+H2O(g) ΔH3 2S(g)===S2(g) ΔH4 则ΔH4的正确表达式为( ) A.ΔH4=(ΔH1+ΔH2-3ΔH3) B.ΔH4=(3ΔH3-ΔH1-ΔH2) C.ΔH4=(ΔH1+ΔH2-3ΔH3) D.ΔH4=(ΔH1-ΔH2-3ΔH3) 答案 A 解析 首先找到②式中含有S2(g)、③式中含有S(g),②×-③×2得2S(g)+SO2(g)+H2O(g)===H2S(g)+S2(g)+O2(g),然后再加①×得2S(g)===S2(g),所以ΔH4=ΔH2×+ΔH1×-ΔH3×2。 11.[2018·兰州一中高三月考]已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是( ) A.H2(g)的燃烧热为142.9 kJ·mol-1 B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 C.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1 D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1 答案 B 解析 根据燃烧热的定义可知,H2(g)的燃烧热为285.8 kJ·mol-1,A项错误;2 mol (即4 g) H2(g)完全燃烧放出571.6 kJ的热量,2 mol(即64 g) CH3OH(l)完全燃烧放出1452 kJ的热量,故单位质量的H2(g)放出的热量多,B项正确;H++OH-===H2O和Ba2++SO===BaSO4↓都是放热的,所以反应ΔH<-57.3 kJ·mol-1,C项错误;将题干中的热化学方程式依次编号为①②③,根据盖斯定律,由,可得热化学方程式:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,D项错误。 二、非选择题(共23分) 12. (12分)现利用如图装置进行中和热的测定,请回答下列问题: (1)该图中有两处未画出,它们是_______、________________。 (2)把温度为15.0 ℃,浓度为0.5 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1) ,生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下: 反应物 起始温度 t1/℃ 终止温度 t2/℃ 中和热 HCl+NaOH 15.0 18.4 ΔH1 HCl+ NH3·H2O 15.0 18.1 ΔH2 ①试计算上述两组实验测出的中和热ΔH1=______,ΔH2=________。 ②两组实验结果差异的原因是___________________________。 ③写出HCl+NH3·H2O的热化学方程式:___________________。 答案 (1)环形玻璃搅拌棒 烧杯上方的泡沫塑料盖 (2)①-56.8 kJ·mol-1 -51.8 kJ·mol-1 ②NH3·H2O是弱碱,在中和过程中NH3·H2O发生电离,要吸热,因而总体放热较少 ③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l) ΔH=-51.8 kJ·mol-1 解析 (2)①根据题目给出的酸、碱的物质的量,酸为0.025 mol,碱为0.0275 mol,碱是过量的,应根据酸的量进行计算,即反应生成了0.025 mol H2O。根据实验数据算出生成1 mol H2O所放出的热量,即得出两组实验测出的中和热数值:ΔH1=-[4.18×(50+50)×(18.4-15.0)×10-3]÷0.025=-56.8 kJ·mol-1,ΔH2=-[4.18×(50+50)×(18.1-15.0)×10-3]÷0.025=-51.8 kJ·mol-1。 13.[2017·四川绵阳诊断](11分)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。 Ⅰ.已知:①2CO(g)+O2(g)===2CO2(g) ΔH1=-566.0 kJ·mol-1 ②N2(g)+O2(g)===2NO(g) ΔH2=+180.5 kJ·mol-1 ③2NO(g)+O2(g)===2NO2(g) ΔH3=-116.5 kJ·mol-1 (1)CO的燃烧热为______________。 若1 mol N2(g)、1 mol O2(g)分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g)分子中化学键断裂时需吸收的能量为________。 (2)CO将NO2还原为单质的热化学方程式为____________________________________________________________ ________________________________________________________。 Ⅱ.利用水煤气合成二甲醚的总反应为: 3CO(g)+3H2(g)===CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1 (3)它可以分为两步,反应分别如下: ①2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1 ②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=________。 (4)已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:_____________________________________。 若二甲醚燃烧生成的CO2恰好能被100 mL 0.2 mol·L-1 NaOH溶液吸收生成Na2CO3,则燃烧过程中放出的热量为________。 答案 (1)283.0 kJ·mol-1 631.75 kJ (2)2NO2(g)+4CO(g)===N2(g)+4CO2(g) ΔH=-1196 kJ·mol-1 (3)-41.3 kJ·mol-1 (4)CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(l) ΔH1=-1455 kJ·mol-1 7.275 kJ 解析 (1)由①可知,2 mol CO(g)完全燃烧生成CO2(g)时放出566.0 kJ热量,则CO(g)的燃烧热为283.0 kJ·mol-1。由②可知,1 mol N2(g)和1 mol O2(g)反应生成2 mol NO(g)吸收180.5 kJ热量,根据反应热与键能的关系可得946 kJ·mol-1+498 kJ·mol-1-2×E(氮氧键)=180.5 kJ·mol-1,则有E(氮氧键)=631.75 kJ·mol-1。 (2)CO将NO2还原为单质的反应为2NO2(g)+4CO(g)===N2(g)+4CO2(g),分析题给三个热化学方程式,根据盖斯定律,由①×2-②-③可得2NO2(g)+4CO(g)===N2(g)+4CO2(g) ΔH=(- 566.0 kJ·mol-1)×2-(+180.5 kJ·mol-1)-(-116.5 kJ·mol-1)=-1196 kJ·mol-1。 (3)根据盖斯定律,由总反应减去反应①可得反应②,则ΔH2=ΔH-ΔH1=(-246.4 kJ·mol-1)-(-205.1 kJ·mol-1)=-41.3 kJ·mol-1。 (4)n(NaOH)=0.1 L×0.2 mol·L-1=0.02 mol,可与0.01 mol CO2反应生成Na2CO3,则有Q= kJ·mol-1×0.01 mol=7.275 kJ。查看更多