- 2021-07-02 发布 |
- 37.5 KB |
- 54页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学常用计量课件(54张)(全国通用)
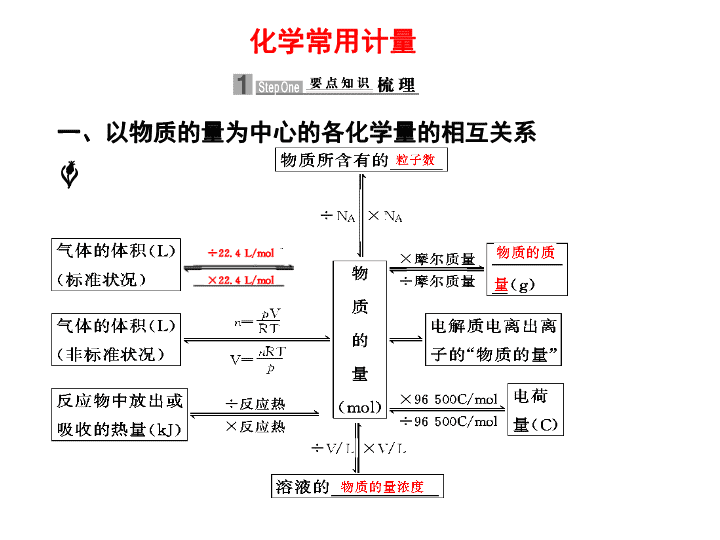
化学常用计量 一、以物质的量为中心的各化学量的相互关系 二、物质的量浓度与 w 、 S 的相互关系 1. 物质的量浓度与溶质质量分数的换算 c = (ρ 的单位为 g/cm 3 ) 2. 物质的量浓度与溶解度的换算 c = (ρ 的单位为 g/cm 3 ) 3. 标准状况下 V L (摩尔质量为 M g/mol )的气体完 全溶于 V L 水(密度为 1 g/cm 3 )中,所得溶液密 度为 ρ(g/cm 3 ): c = = 解析 本题由 n= =c · V 进行计算: B 项, =1∶1, =14∶1;C 项, 由 n = c · V , V 未知,故 n 无法求知。 【例 1 】 下列说法中正确的是 ( ) A. 磷酸的摩尔质量与 6.02×10 23 个磷酸分子的质量 相等 B.6.02×10 23 个氮分子和 6.02×10 23 个氢分子的质 量比等于 14∶1 C.0.5 mol/L 的 CuCl 2 溶液中含有 3.01×10 23 个 Cu 2+ D. 常温常压下, 0.5×6.02×10 23 个一氧化碳分子所 占的体积为 11.2 L 考点一 以物质的量为核心的计算 B 以物质的量为中心的计算需注意的问题 1.“ 一个中心”:必须以物质的量为中心。 2.“ 两个前提”:在应用 V m =22.4 L·mol -1 时,一定要有“标准状况”和“气体状态”两个前提条件(混合气体也适用)。 3.“ 三个关系”: (1) 直接构成物质的粒子与间接构成物质的粒子(原子、电子等)间的关系; (2) 摩尔质量与相对分子质量间的关系; (3)“ 强、弱、非”电解质与溶质粒子(分子或离子)数之间的关系。 4.“ 七个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关)。 在 a L Al 2 (SO 4 ) 3 和( NH 4 ) 2 SO 4 的混合溶液中加入 b mol BaCl 2 ,恰好使溶液中的 SO 离子完全沉淀; 如加入足量强碱并加热可得到 c mol NH 3 ,则原溶液 中的 Al 3+ 离子浓度( mol/L )为 ( ) A. B. C. D. 2- 4 解析 由于产生 c mol NH 3 , 则必定有 NH c mol, 使 SO 完全沉淀需 Ba 2+ b mol, 因此 SO 有 b mol 。根据电荷守恒: 2 c (SO )= c (NH )+3 c (Al 3+ ) ,则 3 c (Al 3+ )=(2× ) mol/L c (Al 3+ )= mol/L + 4 2- 4 2- 4 答案 C 考点二 阿伏加德罗常数的应用 【例 2 】 用 N A 表示阿伏加德罗常数的值。下 列叙述正确的是 ( ) A. 常温常压下的 33.6 L 氯气与 27 g 铝充分反 应,转移电子数为 3 N A B. 标准状况下, 22.4 L 己烷中共价键数目为 19 N A + 4 2- 4 C. 由 CO 2 和 O 2 组成的混合物中共有 N A 个分子,其中 的氧原子数为 2 N A D.1 L 浓度为 1 mol/L 的 Na 2 CO 3 溶液中含有 N A 个 CO 2- 3 解析 A 项中“常温常压下的 33.6 L Cl 2 ” 不足 1.5 mol, 故充分反应后转移电子数要小于 3 N A , 故错误; B 项中标准状况下己烷是液态烃, 22.4 L 不是 1 mol ,故含共价键数目不等于 19 N A (1 mol 己烷含共价键数为 19 N A ) ,故错误; C 项中因为 1 个 CO 2 分子和 1 个 O 2 分子中都含有 2 个氧原子,故 N A 个混合物分子必含 2 N A 个氧原子,正确; D 项中因为 CO 要水解消耗,故含 1 molNa 2 CO 3 的溶液中 n (CO )< N A ,故错误。 2- 3 2- 3 答案 C 有关阿伏加德罗常数的应用问题,实质上是以物质的量为中心的各物理量间的换算,需要特别注意的是准确掌握有关概念的内涵。主要有: 1. 状态问题,如标准状况下 SO 3 为固态,戊烷为液态。标准状况下的气体适用气体摩尔体积 ( 22.4 L/mol ) , 相同状况下的气体适用阿伏加德罗定律。 2. 特殊物质的摩尔质量,如 D 2 O 、 18 O 2 等。 3. 物质分子中的原子个数,如 O 3 、白磷、稀有气 体等。 4. 某些物质中的化学键,如 SiO 2 、 P 4 、 CO 2 等。 5. 物质中某些离子或原子团发生水解,如 Na 2 CO 3 中的 CO 、 AlCl 3 中的 Al 3+ 。 6. 常见可逆反应,如 2NO 2 N 2 O 4 ,弱电解质不完全电离等。 7. 应用 22.4 L/mol 时,物质是否为气体,气体是否处于标准状况。 8. 某些反应中电子转移的数目,如: 2- 3 N A 为阿伏加德罗常数,下列说法正确的是 ( ) A.10 g 甲烷所含有的电子数目为 10 N A B. 常温常压下, 4 g 氦气所含有的中子数目为 4 N A C. 标准状况下, 22.4 L 单质溴所含有的原子数目为 2 N A D. 电解食盐水若产生 2 g 氢气,则转移的电子数目 为 2 N A 解析 本题主要考查物质的量、气体摩尔体积、摩尔质量等内容。 1 mol CH 4 含 10 N A 个电子,则 10 g CH 4 所含电子数目为 ×10 N A < 10 N A ,A 不正确 ; 1 mol He 含有( 4-2 ) mol=2 mol 中子, 4 g 氦气所含中子数目为 2N A , B 不正确;标准状 况下,单质溴为液态, 2.24 L 液态溴的物质的量 远大于 1 mol ,故 C 不正确;由 2NaOH+Cl 2 ↑+H 2 ↑ 知产生 2 g H 2 即 1 mol H 2 时转 移 2 N A 个电子, D 正确。 答案 D 考点三 溶液的物质的量浓度、溶质质量分数、 溶解度、溶液的密度之间的关系 【例 3 】 在一定温度下,某饱和氢氧化钠溶液体积 为 V mL ,溶液密度为 d g/cm 3 ,质量分数为 w % , 物质的量浓度为 c mol/L ,溶液中含氢氧化钠质量 为 m g 。 ( 1 )用 w 来表示该温度下氢氧化钠的溶解度( S ) 为 。 ( 2 )用 m 、 V 表示溶液中溶质的物质的量浓度( c ) 为 。 ( 3 )用 w 、 d 表示溶液中溶质的物质的量浓度( c ) 为 。 ( 4 )用 c 、 d 表示溶液中溶质的质量分数为 。 解析 溶液中溶质质量分数与物质的量浓度之间的相互换算,一定要通过溶液密度这个桥梁来进行。 答案 ( 1 ) S= ×100 g ( 2 ) c = mol/L ( 3 ) c =0.25dw mol/L ( 4 ) w %= % 1. 溶液浓度的计算 ( 1 )物质的量浓度的计算 ① 溶质的质量、溶液的体积和物质的量浓度之间的计算。可运用公式: n = m / M , c = n / V 或运用“倍数关系”算出 1 L 溶液中所含溶质的物质的量。 ② 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的物质的量浓度。应先运用 n = V /22.4 L/mol, 求出溶质的物质的量,运用 V =m/ρ 求出溶液的体积。 ③ 计算溶液中的离子浓度,需要根据溶质的电离方程式,算出离子的物质的量。 ( 2 )溶液中溶质的质量分数与物质的量浓度之间的换算 c = ( c 为溶质的物质的量浓度,单位是 mol/L;ρ 为溶液的密度,单位是 g/cm 3 , w 为溶质的质量分数, M 为溶质的摩尔质量,单位是 g/mol), 按此公式换算即可。 2. 有关同溶质的溶液混合后溶液质量分数的计算规律 ( 1 )溶质相同的两溶液等质量混合时,混合溶液的质量分数为两溶液质量分数和的一半。 ( 2 )溶质相同的两溶液等体积混合时: ① 对于密度小于 1 g/cm 3 的溶液,如氨水、乙醇的水溶液,等体积混合时质量分数小于两溶液质量分数和的一半; ② 对于密度大于 1 g/cm 3 的溶液,如硫酸溶液、氯化钠溶液,等体积混合时质量分数大于两溶液质量分数和的一半。 某结晶水合物的化学式为 R· n H 2 O ,其相对分子质 量为 M 。 25℃ 时,将 a g 该晶体溶于 b g 水中恰好可 形成 V mL 饱和溶液。下列关系正确的是 ( ) A. 饱和溶液的物质的量浓度 c = mol/L B. 饱和溶液中溶质的质量分数 w = % C.25℃ 时 R 的溶解度 S = g D. 饱和溶液的密度 ρ= g/L 解析 本题主要考查溶质质量分数、溶解度、物质的量浓度等有关概念及其相互求算关系。 A 项,晶体的物质的量等于无水物的物质的量, c(R )= = B 项, w = C 项, ,S= D 项, , 因此只有选项 C 正确。 答案 C 考点四 一定物质的量浓度的溶液的配制及误差 分析 【例 4 】 实验室配制 500 mL 0.5 mol/L 的 NaCl 溶 液,有如下操作步骤: ① 把称量的 NaCl 晶体放入小烧杯中, 加适量蒸馏水溶解。 ② 把 ① 所得溶液小心转入 500 mL 容 量瓶中。 ③ 继续向容量瓶中加蒸馏水至液面距刻度 2~3 cm 处,改用胶头滴管小心滴加蒸馏水至溶液凹液面 底部与刻度线相切。 ④ 用少量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。 ⑤ 将容量瓶塞塞紧,充分摇匀。 请填写下列空白: ( 1 )操作步骤的正确顺序为 (填序号)。 ( 2 )本实验用到的基本实验仪器有 。 ( 3 )某同学观察液面的情况如上图所示,对所配溶 液浓度将有何影响? (填“偏高”、“偏低”或“无影响”)。 ( 4 )若出现如下情况,对所配溶液浓度将有何影响?没有进行操作步骤 ④ ;加蒸馏水时不慎超过了刻度 (填“偏高”、“偏低”或“无影响”)。 ( 5 )若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度 。向容量瓶中转移溶液时(操作步骤 ② )溶液流到容量瓶外面 。 解析 ( 2 )为防止仪器的遗漏,可根据步骤进行选取。( 3 )根据 c = , V 偏小, c 偏高。 ( 4 )加蒸馏水超过刻度, V 偏大, c 偏低这种情况下配制的溶液浓度不是 0.5 mol/L ,因此要重配。 答案 ( 1 ) ①②④③⑤ (2)500 mL 容量瓶、托盘天平、烧杯、胶头滴管、玻璃棒 ( 3 )偏高 ( 4 )偏低 偏低 ( 5 )重配 重配 配制一定物质的量浓度溶液的误差分析 根据 c = 进行分析: 1. 若称量固体溶质时,操作无误,但所用砝码生锈, m 偏大,结果偏高。 2. 若没有洗涤烧杯内壁,使 n 减小,结果偏低。 3. 若容量瓶中有少量蒸馏水,则对结果无影响 ; 定容后反复摇匀发现液面低于刻度,又加蒸馏水至刻度线 , 则结果偏低。 4. 俯视、仰视对结果的影响: (1) 仰视刻度线:由于操作时以刻 度线为基准 , 故加水量增多 , 导致溶液体积偏大 , c 偏低。 (2) 俯视刻度线 : 加水量减少 , 溶液体积变小 , c 偏高。 高考失分警示 1. 在运用气体摩尔体积时应把握 22.4 L/mol 的使用条件是标准状况下的气体。如 SO 3 、 CHCl 3 、苯、辛烷等,在标准状况下为非气体,命题者常把这些容易忽视的液态或固态物质作为气体来命题 , 让考生落入陷阱。而有些物质虽是气体 , 但给出的气体数值没有指明是否在标准状况下 , 也不能直接利用 22.4 L/mol( 换算其物质的量 ) 。 2. 一些物质变化具有一定的隐蔽性,有时需要借助方程式分析才能挖掘出其隐含的变化情况。如 NO 2 存在与 N 2 O 4 的化学平衡, NH 、 Al 3+ 、 CO 等存在水解平衡。考生若不注意挖掘隐含变化,往往会误入歧途 + 4 2- 3 3. 在计算溶液的物质的量浓度时,溶液的体积要用溶液的质量除以溶液的密度求得,并且要把溶液的体积单位换算为“ L” 而不是“ mL” 。在计算溶质的质量分数时 , 氨水的溶质以 NH 3 计算 , 而不是 NH 3 · H 2 O; 硫酸铜溶液的溶质是 CuSO 4 ,而不是 CuSO 4 ·5H 2 O 等。 4. 由于容量瓶只有一个刻度(标线),所以配制 80 mL 溶液应选 100 mL 的容量瓶,应以配制 100 mL 溶液的标准计算溶质的量,并且指明所需仪器为 100 mL 的容量瓶。 1. 下列叙述正确的是 ( ) A.48 g O 3 气体含有 6.02×10 23 个 O 3 分子 B. 常温常压下, 4.6 g NO 2 气体含有 1.81×10 23 个 NO 2 分子 C.0.5 mol/LCuCl 2 溶液中含有 3.01×10 23 个 Cu 2+ D. 标准状况下, 33.6 L H 2 O 含有 9.03×10 23 个 H 2 O 分子 解析 A 项中 O 3 的分子数为 ×6.02×10 23 个 /mol =6.02×10 23 个,故 A 正确; B 项中常温常压下, 4.6g NO 2 含有的原子个数约为 1.81×10 23 个,而分子个数由于存在 2NO 2 N 2 O 4 的转化,无法计算出其中 NO 2 的具体分子数, B 错; C 项因不知其体积,只知道浓度 , 无法计算 Cu 2+ 的个数, C 错; D 项中标准状况下水不是气体, D 错。 A 2. 在两个密闭容器中,分别充有质量相同的甲、乙两 种气体,若两容器的温度和压强均相同,且甲的密 度大于乙的密度,则下列说法正确的是 ( ) A. 甲的分子数比乙的分子数多 B. 甲的物质的量比乙的物质的量少 C. 甲的摩尔体积比乙的摩尔体积小 D. 甲的相对分子质量比乙的相对分子质量小 解析 由公式 m = V 得出 , 甲 V 甲 = 乙 V 乙 = ,因为 > ,则 V 甲 < V 乙 ,同温条件下, n 乙 > n 甲 。 由 M 甲 = , M 乙 = 得 M 乙 < M 甲 ,因此 B 正确。 B 3.20℃ 时,饱和 KCl 溶液的密度为 1.174 g/cm 3 ,物 质的量浓度为 4.0 mol/L, 则下列说法中不正确的 是 ( ) A.25℃ 时,饱和 KCl 溶液的浓度大于 4.0 mol/L B. 此溶液中 KCl 的质量分数为 C.20℃ 时,密度小于 1.174 g/cm 3 的 KCl 溶液是不 饱和溶液 D. 将此溶液蒸发部分水,再恢复到 20℃ 时,溶液 密度一定大于 1.174 g/cm 3 解析 KCl 的溶解度随着温度增大而增大,因而 25℃ 时,饱和 KCl 溶液的浓度大于 4.0 mol/L ;将饱和 KCl 溶液蒸发部分水,再恢复到 20℃ 时,溶液仍为饱和,密度还是 1.174 g/cm 3 。 D 4. t ℃ 时,将 100 g 某物质 A 的溶液蒸发掉 10 g 水,恢复 至 t ℃ ,析出 2.5 g 晶体;再蒸发掉 10 g 水,恢复至 t ℃ ,又析出 7.5 g 晶体。下列说法中正确的是 ( ) A.t ℃ 时,原溶液可能是饱和溶液 B. 由于缺少条件,无法求出 t ℃ 时 A 的溶解度 C. t ℃ 时, A 的溶解度一定为 75 g D. t ℃ 时,原溶液的质量分数为: 解析 先后蒸发掉等质量( 10 g )的水,析出晶体质量前少后多,说明原溶液在 t ℃ 时是不饱和的,故 A 项不正确;因未知析出晶体中是否含有结晶水,而不能求算 t ℃ 时 A 的溶解度,故 B 项正确, C 项不正确 ; 同样的理由也不能计算原溶液的质量分数 , 故 D 项不正确。 B 5. 一定质量的液态化合物 XY 2 ,在一定质量的 O 2 中恰 好完全燃烧,反应方程式为: XY 2 (l)+3O 2 (g) XO 2 (g)+2YO 2 (g), 冷却后,在标准状况下测得生成 物的体积是 672 mL ,密度是 2.56 g/L ,则: ( 1 )反应前 O 2 的体积是 。 ( 2 )化合物 XY 2 的摩尔质量是 。 ( 3 )若 XY 2 分子中 X 、 Y 两元素的质量比是 3∶16 , 则 X 、 Y 两元素分别为 和 (写 元素符号)。 解析 ( 1 )由反应 XY 2 ( l)+3O 2 XO 2 (g)+2YO 2 (g) 可知 , 反应前后气体的体积变化为 0, 故 V ( O 2 ) =672 mL 。 ( 2 )由 m = V , 生成物的质量 m =0.672L×2.56g/L =1.72 g , XY 2 + 3O 2 XO 2 +2YO 2 , 0.01 mol 0.03 mol 所以 M ( XY 2 ) = =76 g/mol; (3) 由 = , X+2Y=76 得 x =12,Y=32, 则 X 为 C , Y 为 S 。 答案 ( 1 ) 672 mL ( 2 ) 76 g/mol ( 3 ) C S 1. 只给出下列甲和乙中对应的量,不能求出物质的量 的是 ( ) A B C D 甲 物质的粒子数 标准状况下的气体摩尔体积 固体的体积 溶液中溶质的物质的量浓度 乙 阿伏加德罗常数 标准状况时的气体体积 固体的密度 溶液的体积 C 2. 设 N A 代表阿伏加德罗常数的值,下列说法正确的 是 ( ) A. 将 2 mol NO 和 1 mol O 2 混合后,体系中的原子 总数为 6 N A B.0.01 mol Mg 在 CO 2 中完全燃烧,转移电子数为 0.01 N A C. 标准状况下, 3.2 g Cu 与足量的浓硝酸反应生成 气体的分子数为 0.2 N A D.7.8 g Na 2 O 2 含有的阴离子数为 0.2 N A 解析 Mg 与 CO 2 的反应为 2Mg+CO 2 2MgO+C, 故转移电子数为 0.02 N A , B 项错误; Cu 与浓硝酸的反应为 Cu+4HNO 3 ( 浓 ) Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O,3.2 g Cu 反应时生成气体的分子数为 ×2× N A =0.1 N A ,C 项错误; Na 2 O 2 中的阴离子为 O ,故 7.8 gNa 2 O 2 中阴离子数为 0.1 N A ,D 项错误。 点燃 答案 A 2- 2 3. 下图是某学校实验室从化学试剂商店买回的硫酸试 剂标签上的部分内容。据此下列说法正确的是( ) 硫酸 化学纯( CP )( 500 mL ) 品名:硫酸 化学式: H 2 SO 4 相对分子质量: 98 密度: 1.84 g/cm 3 质量分数: 98% A. 该硫酸的物质的量浓度为 9.2 mol/L B.1 mol Zn 与足量的该硫酸反应产生 2 g 氢气 C. 配制 200 mL 4.6 mol/L 的稀硫酸需取该硫酸 50 mL D. 等质量的水与该硫酸混合所得溶液的物质的量浓 度大于 9.2 mol/L 解析 本题考查有关溶液浓度的知识。由 c = 可算出该硫酸的物质的量浓度为 18.4 mol/L; 该硫酸是浓硫酸不和 Zn 反应生成 H 2 ;由稀释定律,可得出所用硫酸体积为 50 mL ;等质量的硫酸和水,硫酸的密度大,硫酸的体积远小于水,两者等质量混合,硫酸的浓度小于一半, D 不正确。 答案 C 4. 实验室里需用 480 mL 0.1 mol/L 的硫酸铜溶液, 现选取 500 mL 容量瓶进行配制,以下操作正确 的是 ( ) A. 称取 7.68 g 硫酸铜,加入 500 mL 水 B. 称取 12.0 g 胆矾配成 500 mL 溶液 C. 称取 8.0 g 硫酸铜,加入 500 mL 水 D. 称取 12.5 g 胆矾配成 500 mL 溶液 解析 首先应以 500 mL 来计算胆矾或硫酸铜的质量,计算得出应用 12.5 g 胆矾或 8.0 g 硫酸铜,因 此 A 、 B 项错误;由于配制 500 mL 溶液,故 C 加水 500 mL 应是错误的,而应加水稀释至 500 mL 。 D 5. 已知某饱和溶液的 ① 体积, ② 密度, ③ 溶质和溶剂 的质量比, ④ 溶质的摩尔质量,要根据溶质的溶解 度计算该溶液的物质的量浓度,上述条件中必不可 少的是 ( ) A.②④ B.①④ C.①②③ D.①②③④ 解析 给出溶质的溶解度,既可知 100 g H 2 O 中溶解溶质的质量,也可知溶液的质量为( 100+S ) g ,由 c B = 知,只要知道溶液的密度 ② 和溶质的摩尔质量 ④ ,即可计算该溶液的物质的量浓度,故选择 A 。 A 6. 在 1 L K 2 SO 4 、 CuSO 4 的混合溶液中, c (SO )= 2mol/L ,用石墨作电极电解此溶液,当通电一段 时间后,两极均收集到 22.4 L 气体(标准状况), 原溶液中 c (K + ) 为 ( ) A.0.5 mol/L B.1 mol/L C.1.5 mol/L D.2 mol/L 解析 电解 K 2 SO 4 和 CuSO 4 的混合溶液,根据离子的放电顺序,在阳极上发生反应: 4OH - -4e - 2H 2 O+O 2 ↑ 当阳极上收集到 1 molO 2 时,转移的电子的物质的量为 4 mol 。 2- 4 在阴极上先发生反应: Cu 2+ +2e - Cu 再发生反应: 2H + +2e - H 2 ↑ 当阴极上收集到 1 mol H 2 时,转移电子的物质的量为 2 mol ,则另 2 mol 的电子是由溶液中的 Cu 2+ 获得,即 CuSO 4 为 1 mol 。因 c (SO )=2 mol/L, 故 K 2 SO 4 亦为 1 mol, c (K + )= 。 2- 4 答案 D 7. 下列叙述正确的是 ( ) A. 同温同压下,相同体积的物质,它们的物 质的量必相等 B. 任何条件下,等物质的量的乙烯和一氧化碳 所含的分子数必相等 C.1 L 一氧化碳气体一定比 1 L 氧气的质量小 D. 等体积、等物质的量浓度的强酸中所含的 H + 数一 定相等 解析 A 项未指明物质的存在状态,即固态、液态还是气态,所以 A 无法确定物质的量是否相等,故 A 错误; B 项中物质的量相等的乙烯和一氧化碳,不论条件如何,其所含的分子数总是相等的,故 B 正确; C 项未指明温度和压强,无法确定其质量大小,所以 C 错误; D 项中强酸未指明是几元强酸,无法确定 H + 数目的多少,所以 D 项错误。 答案 B 8. 已知质量分数为 25% 的氨水的密度为 0.91 g/cm 3 , 质量分数为 5% 的氨水的密度为 0.98 g/cm 3 ,若将 上述两溶液等体积混合,所得氨水溶液的质量分数 是 ( ) A. 等于 15% B. 大于 15% C. 小于 15% D. 无法估算 解析 由于氨水是浓度越大密度反而越小的溶液,故等体积混合的 w <= =15% 。 c 9. 下列叙述中正确的是 ( ) ① 在标准状况下, 0.2 mol 任何物质的体积均为 4.48 L ② 当 1 mol 气体的体积为 22.4 L 时,它一定处于标 准状况下 ③ 标准状况下, 1 L HCl 和 1 L H 2 O 的物质的量 相同 ④ 标准状况下, 1 g H 2 和 14 g N 2 的体积相同 ⑤28 g CO 的体积为 22.4 L ⑥ 两种物质的物质的量相同,则它们在标准状况 下的体积也相同 ⑦ 在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧ 同温同压下,气体的密度与气体的相对分子质量成正比 A.①②③④ B.②③⑥⑦⑧ C.⑤⑥⑦⑧ D.④⑦⑧ 解析 ① 错在不是任何物质,只能是气体。 ② 结论太片面, 1 mol 气体在温度和压强符合一定关系时,也能使体积占有 22.4 L 。 ③ 错在标准状况下水不是气体。 ⑤ 错在没有标明标准状况。 ⑥ 错在没有说明物质是否为气态。 答案 D 10. 下列说法正确的是 ( ) A. 同温同压下,相同数目的分子必占有相同的体 积 B. 质量相等、密度不等的 N 2 和 C 2 H 4 所含有的分子 数一定相等 C. 不同的气体,若体积不等,则它们所含的分子 数一定不等 D. 一定温度、压强下,气体体积由其分子的大小 决定 解析 本题主要考查阿伏加德罗定律及其推论。 A 中的“分子”不一定是气体,故 A 错; B 中因为 M ( N 2 ) =M ( C 2 H 4 ) =28 g/mol , 所以同质量的 N 2 、 C 2 H 4 所含的分子数一定相等, 故 B 对,“不同密度”为干扰项,要注意抓住本 质,排除干扰;只有在同温同压下,不同的气 体,若体积不等,则它们所含的分子数才一定不 等,故 C 错; D 中温度、压强一定,则气体分子间 的平均距离一定,则气体体积由其物质的量的多 少决定,而不是由其分子的大小决定,故 D 错。 答案 B 11. 设 N A 表示阿伏加德罗常数的值,下列有关 N A 的叙述中正确的有 ( ) ①0.25 mol Na 2 O 2 中含有的阴离子数为 0.5 N A ②7.5 g SiO 2 晶体中含有的硅氧键数为 0.5 N A ③1 mol 氨基乙酸(甘氨酸)分子中存在 10 N A 对 共用电子 ④250 mL 2 mol/L 的氨水中含有 NH 3 ·H 2 O 的分子数为 0.5 N A ⑤3.0 g 淀粉和葡萄糖混合物中共含碳原子数为 0.1 N A ⑥18 g D 2 O( 重水 ) 完全电解,转移 N A 个电子 ⑦ 标准状况下, 2.24 L CHCl 3 含有的分子数为 0.1 N A ⑧ 电解精炼铜时,当阳极溶解 32 g 铜时,转移的电子数为 N A 个 A.2 个 B.3 个 C.4 个 D.5 个 解析 ① 中含 O 0.25 N A ; ④ 中 NH 3 · H 2 O 要发生电离 和分解; ⑤ 中淀粉中的葡萄糖单元的组成为 C 6 H 10 O 5 , 与葡萄糖分子组成不同; ⑦ 中标准状况下 CHCl 3 为液体; ⑧ 粗铜中有比铜更易失电子的金属 杂质;故只有 ②③ 两项正确。 2- 2 答案 A 12. 某化工厂生产的氨水的物质的量浓度为 20 mol/L, 实验室若需用 80 mL 浓度为 5 mol/L 的氨水时, 需量取 20 mol/L 的氨水 mL ;配制该溶液 时,除用到 100 mL 容量瓶外,还需要的玻璃仪 器有 。 25.0 玻璃棒、胶头滴管、烧杯、量筒 13. 实验室要配制 250 mL 0.8 mol/L 的 NaOH 溶液。( 1 )需称取 NaOH 固体 g 。 ( 2 )某同学用托盘天平称量一个烧杯的质量,用 “ ↓” 表示在天平托盘上放上砝码,用“ ↑” 表示从 托盘上取下砝码,称量过程如下: 砝码质量 /g 50 20 20 10 5 取用砝码情况 ↓↑ ↓ ↓↑ ↓ ↓↑ 此时天平平衡,则烧杯的质量为 g ,右盘再放 g 砝码,将游码移至 g 位置,继续称量 NaOH 质量。 ( 3 )配制方法:设计五步操作 ① 向盛有 NaOH 固体的烧杯中加入 30 mL 蒸馏水使其溶解,冷却至室温; ② 继续向容量瓶中加水至液面离刻度 1~2 cm ; ③ 将 NaOH 溶液沿玻璃棒注入 250 mL 容量瓶中; ④ 在烧杯中加入少量蒸馏水,小心洗涤 2~3 次,并将洗涤液一并注入容量瓶中; ⑤ 改用胶头滴管加水至刻度线,加盖摇匀。 以上操作正确的顺序是 (填序号,下同)。 ( 4 )以下操作,会使实验结果偏高的是 。 ① 定容时俯视刻度线; ② 定容时仰视刻度线; ③ 所用容量瓶事先用 NaOH 溶液润洗; ④ 称量 NaOH 时,称量时间太长; ⑤ 摇匀后,将所配溶 液装入用蒸馏水洗净的试剂瓶中。 答案 ( 1 ) 8.0 (2)31.2 5 4.2 (3)①③④②⑤ (4)①③ 14. 三农问题是政府和社会关注的问题,化肥是土地 的营养品。某农资商店出售一种化肥,其有效成 分为氯化铵,现欲测定该种化肥中氮元素的质量 分数,设计实验步骤如下(杂质中不含氮元素, 且杂质均不与盐酸或氢氧化钠溶液反应): ① 配制 1.00 mol/L 的 HCl 溶液和 1.00 mol/L 的 NaOH 溶液; ② 每次取 1.00 g 此化肥样品,溶于 20 mL 蒸馏水中 ③ 加入 30.00 mL 1.00 mol/L 的 NaOH 溶液,将反应后的溶液加热煮沸约 1 分钟,冷却至常温; ④…… ⑤ 重复 ②③④ 步操作 1~2 次; ⑥ 记录整理实验所得数据,计算该化肥中氮元素的质量分数。 请回答下列问题: ( 1 )写出步骤 ④ 中的实验内容 , 写出实验步骤 ④ 中的离子方程式: 。 ( 2 )下列仪器中,配制盐酸和氢氧化钠溶液都能用 到的是 (填字母选项)。 A. 玻璃棒 B. 托盘天平 C. 烧杯 D. 漏斗 ( 3 )步骤 ⑤ 的实验目的是 。 ( 4 )配制本实验所需的 1.00 mol/L 的盐酸和 1.00 mol/L 的 NaOH 溶液从节约化学药品的角度出 发,最好应选用的容量瓶规格分别为 (填字 母选项)。 A.50 mL,50 mL B.150 mL,100 mL C.100 mL,150 mL D.250 mL,500 mL ( 5 )若以 V x ( mL )表示实验所测定消耗盐酸数据 的平均值,该化肥样品中氮元素的质量分数计算表 达式为 。(不需要化简) 答案 ( 1 )以酚酞为指示剂,用 1.00 mol/L 的 HCl 溶液滴定,达到滴定终点用去 V ( mL ) OH - +H + H 2 O ( 2 ) AC (3) 减小误差,提高实验结果的准确度。 ( 4 ) C ( 5 )( 0.03×1- V x ×1×10 -3 ) ×14×100% 15. 向 100 mL 某二价金属 M 的氢氧化物澄清溶液中加 入过量的 NaHCO 3 溶液生成了 MCO 3 沉淀。过 滤,将沉淀置于足量的盐酸中,在标准状况下收 集到 4.48 L 气体;将滤液加水稀释到 250 mL ,取 出 25 mL 恰好与 20 mL 盐酸完全反应,标准状况 下收集到 1.12 L 气体。 ( 1 ) M 的氢氧化物与 NaHCO 3 反应的化学方程式 为: 。 ( 2 )要计算 M 的相对原子质量,你认为还必须提 供下列哪项数据 (选填字母序号)。 A.M 的氢氧化物溶液的物质的量浓度 ( 设为 2 mol/L) B.M 的碳酸盐的质量(设为 39.4 g ) C. 与 M 的碳酸盐反应的盐酸的物质的量浓度(可设为 0.1 mol/L ) D. 题设数据充足,不需要补充数据根据你的选择, 试列式计算金属 M 的相对原子质量。 ( 3 )求与滤液反应的盐酸的物质的量浓度。 答案 ( 1 ) M ( OH ) 2 +2NaHCO 3 MCO 3 ↓+ Na 2 CO 3 +2H 2 O ( 2 ) B 由 C 守恒可知: n ( MCO 3 ) = n ( CO 2 ) =4.48 L÷22.4 L/mol=0.2 mol M ( MCO 3 ) =39.4 g÷0.2 mol=197 g/mol M 的相对原子质量为: 197-60=137 (3)5.0 mol/L 返回查看更多