- 2021-07-01 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试 化学
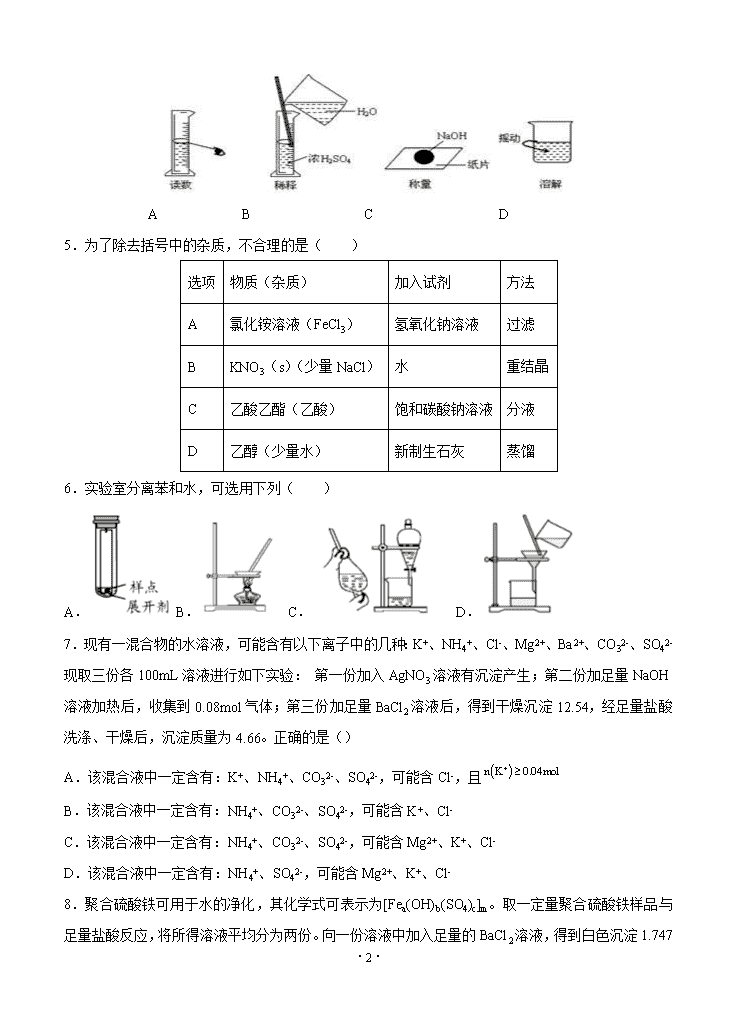
2019-2020东北育才学校高中部化学高三一模 考试时间:90分钟 可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Mg:24 Al:27 Cl:35.5 Cr:52 Fe:56 Co: 59 Cu:64 I:127 Ba:137 Ca:40 第I卷(单项选择题,各3分) 1.下列事实中,不能说明化学是具有实用性的科学的是( ) A.制造化学肥料,提高粮食产量 B.研制药物,治疗疾病 C.合成食品添加剂 D.提出更完善的化学理论 2.化学成为一门科学并较快发展,始于( ) A.舍勒发现氧气 B.质量守恒定律的发现 C.原子—分子学说的问世 D.中国湿法冶金技术的推广 3.举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( ) A.往母液中加入食盐的主要目的是使NaHCO3更多的析出 B.从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水 C.沉淀池中反应的化学方程式: D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升 4.下图分别表示四种操作,其中有两个明显错误的是 ·9· A B C D 5.为了除去括号中的杂质,不合理的是( ) 选项 物质(杂质) 加入试剂 方法 A 氯化铵溶液(FeCl3) 氢氧化钠溶液 过滤 B KNO3(s)(少量NaCl) 水 重结晶 C 乙酸乙酯(乙酸) 饱和碳酸钠溶液 分液 D 乙醇(少量水) 新制生石灰 蒸馏 6.实验室分离苯和水,可选用下列( ) A. B. C. D. 7.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl2溶液后,得到干燥沉淀12.54,经足量盐酸洗涤、干燥后,沉淀质量为4.66。正确的是() A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且 B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- 8.聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 ·9· 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( ) A.1∶1 B.2∶1 C.3∶1 D.2∶5 9.关于反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4的说法正确的是 A.P既是氧化剂又是还原剂,CuSO4只是还原剂 B.Cu3P既是氧化产物又是还原产物 C.1 mol CuSO4可以氧化1/5 mol P D.若有11 mol P参加反应,转移电子的物质的量为60 mol 10.已知氢化钠(NaH)可由氢气和钠在高温下化合形成,其使用需要惰性环境,遇水放出易燃气体,下列说法不正确的是( ) A.氢化钠与水反应产生的气体,通过盛有碱石灰的干燥管,用向下排空气法可以收集得到一定量的H2 B.氢化钠与水反应产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定含有H2 C.氢化钠在无水条件下除去钢铁表面铁锈的反应方程式为3 NaH+Fe2O3═2Fe+3NaOH D.锌和盐酸反应后的气体经浓硫酸干燥后,与钠在高温下反应得到纯净的NaH 11.某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( ) A.该反应中Cl-为还原产物 B.氧化剂与还原剂物质的量比为3:2 C.消耗1 mol还原剂,转移6 mol电子 D.氧化性:ClO-比 N2强 12.设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,4.48L Cl2通入水中,转移电子数为0.2NA B.28g乙烯与丙烯混合物中含有C-H键的数目为4NA C.1L 0.1mol/L Na2SO4溶液中含有的氧原子数为0.4NA D.1mol⋅L-1 CH3COOH与1mol⋅L-1 CH3COONa溶液等体积混合,溶液中CH3COOH和CH3COO-的 ·9· 总数为2NA 13.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是 A. B. C. D.=1000Vρ/(17V+22400) 14.NA为阿伏伽德罗常数的值。下列说法正确的是 A.c(H2CO3)和c(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA B.5g 21H和31H的混合物发生热核聚变反应:21H+31H →42He+10n,净产生的中子(10n)数为NA C.1L 0.1mol/L乙醇溶液中存在的共价键总数为0.8NA D.56g 铁与足量氯气反应,氯气共得到3NA个电子 15下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是 ( ) 纯净物 混合物 强电解质 弱电解质 非电解质 A 盐酸 水煤气 硫酸 醋酸 HD B 胆矾 石灰水 硫酸钡 HNO2 NH3 C 火碱 蔗糖溶液 氯化钠 氨水 三氧化硫 D 冰醋酸 福尔马林 苛性钾 氯化氢 乙醇 16.向含有c(FeCl3)=0.2 mol·L-1、c(FeCl2)=0.1 mol·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是( ) A.该分散系的分散质为Fe2O3 B.该分散系属于溶液 C.加入NaOH时发生的反应可能为Fe2++2Fe3++8OH-=Fe3O4+4H2O D.可用过滤的方法将黑色金属氧化物与Na+分离开 17.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列有关叙述错误的是() ·9· A.雾和霾的分散质不同分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 18.下列对碱金属的叙述,其中完全不正确的组合是 ( ) ①K通常保存在煤油中,以隔绝与空气的接触 ②碱金属常温下呈固态,取用时可直接用手拿 ③碱金属中还原性最强的是钾 ④碱金属阳离子,氧化性最强的是Li+ ⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大 ⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越低 A.②③⑥ B.②③④ C.④⑤⑥ D.①③⑤ 19.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下: 下列说法不正确的是() A.装置②中试剂可以是NaOH溶液 B.装置③的作用是干燥O2 C.收集氧气应选择装置a D.装置②、③之间应增加盛澄清石灰水的洗气瓶 20.下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( ) X Y Z 物质转化关系 A Cu CuO Cu(OH)2 B Si SiO2 H2SiO3 ·9· C NaHCO3 Na2CO3 NaOH D FeCl2 FeO FeCl3 第II卷(非选择题) 21(7分).(1)某学习小组通过实验研究Na2O2与水的反应。 操作 现象 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a 向溶液a中滴入两滴酚酞 ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 ①Na2O2的电子式为 ,它与水反应的离子方程式是 。 ②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂______ (填化学式),有气体产生。 (2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验: ①测知溶液显酸性; ②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色; ③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成; ④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀; ⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。 由此可以推断: 溶液中肯定存在的离子有 。溶液中不能确定是否存在的离子有 。 22(7分).下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下: ·9· 回答下列问题: (1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。 (2)写出反应①②③的化学反应方程式: ①:____________________________________; ②:____________________________________; ③:____________________________________; 23(16分).某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示: 已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O. 相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下: 金属离子 Mn2+ Fe2+ Fe3+ Al3+ 开始沉淀的pH 8.1 6.3 1.5 3.4 沉淀完全的pH 10.1 8.3 2.8 4.7 (1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。 ·9· (2)净化包含三步: ①加入少量MnO2,添加少量MnO2的作用是___________________________________。 发生反应的离子方程式为___________。 ②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。 生成的沉淀主要是____________________。 ③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。 (3)碳化结晶中生成MnCO3的离子方程式为________________________________。 24(10分).过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下: 请回答下列问题: (1)三颈烧瓶中发生的主要反应的化学方程式为________________; (2)支管B的作用是_________________________; (3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________; A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液 (4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙_____________的性质; A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌 ·9· (5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如右上图所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体),使用分析天平准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为_________(保留4位有效数字) 2019-2020东北育才学校高中部化学高三一模 1D 2C 3B 4B 5A 6C 7A 8B 9C 10D 11C 12B 13A 14D 15B 16C 17C 18A 19C 20C 21.(1)①;2Na2O2+2H2O=4Na++4OH-+O2↑; ②MnO2(Cu2+、Fe3+也可); (2)H+、NH4+、I-、Ba2+;K+、Cl- 22.Na Cl2 HCl CO2 2Na+2H2O=2NaOH+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2NaHCO3Na2CO3+CO2↑+H2O 23.(1)500℃ 温度过高,NH4Cl分解导致与MnCO3的反应不彻底(或MnCO3分解发生其他副反应;或MnCl2挥发导致Mn损失;或高温下锰被氧化成高价态造成浸取率低;或高温使固体烧结,固体表面积减小等) (2)①将Fe2+氧化为Fe3+ MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O ②4.7 Fe(OH)3、Al(OH)3 ③F-与H+ 结合形成弱电解质HF,CaF2(s)Ca2+(aq)+F-(aq)平衡向右移动 (3)Mn2++HCO3-+NH3=MnCO3↓+NH4+ 24.(1)CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl (2)平衡气压,便于恒压滴液漏斗中的液体能够顺利滴下 (3)A (4)ABD (5)43.20%或0.4320 ·9·查看更多