- 2021-06-01 发布 |
- 37.5 KB |
- 23页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
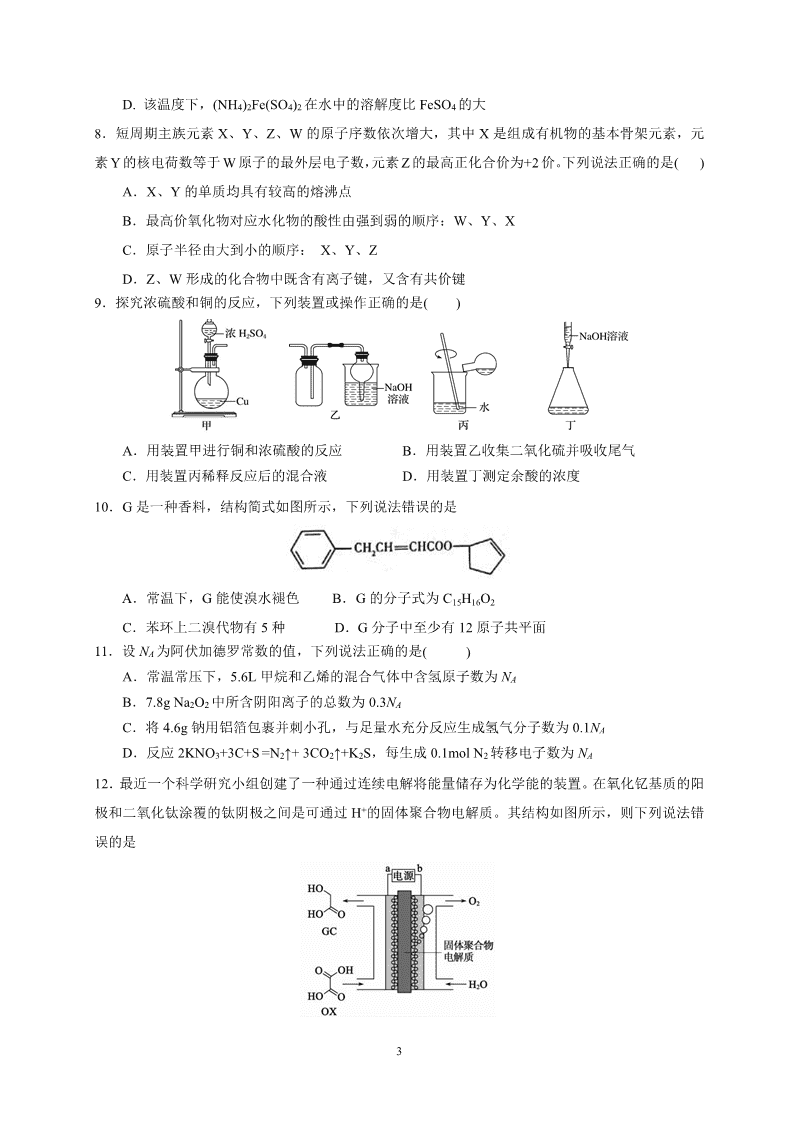
山西省大同市第一中学2020届高三3月月考 理科综合试题(PDF版)
1 大同一中 2020 届高三年级 3 月月考 理综试卷 H 1 C 12 O 16 F 19 Na 23 Mg 24 Al 27 Si 28 P 31 S 32 Cl 35.5 K 39 Ca 40 I 127 As 75 Cu 64 Zn 65 一、选择题:本题共 13 小题,每小题 6 分。每小题给出的四个选项中,只有一项是符合题目要求的。 1.如图曲线 a 和 b 不能用于表示( ) A.质壁分离过程中植物细胞液浓度和吸水能力的变化 B.萌发的植物种子在出土之前有机物种类和干重的变化 C.动物细胞体积与细胞物质运输效率的变化 D.细胞分化程度和全能性高低的变化 2.下列有关细胞中“一定”的说法正确的有几项( ) ①光合作用一定在叶绿体中进行 ②有氧呼吸一定在线粒体中进行 ③没有细胞结构的生物一定是原核生物 ④以 RNA 为遗传物质的生物一定是原核生物 ⑤所有生物的蛋白质一定是在核糖体上合成的 ⑥有中心体的生物一定不是高等植物 ⑦有 H2O 生成或有 H2O 参与的呼吸过程一定不是无氧呼吸 A.一项 B.两项 C.三项 D.四项 3.研究人员向肿瘤细胞中导入单纯疱疹病毒胸苷激酶基因(HSV-TK),可将某种无毒性前体药物磷酸 化,引起肿瘤细胞内一系列代谢变化,最终诱导肿瘤细胞的“自杀”。相关分析错误的是( ) A.该治疗方法属于基因治疗,HSV-TK 能遗传给后代 B.在将 HSV-TK 导入肿瘤细胞前,需要构建基因表达载体 C.肿瘤细胞因导入 HSV-TK 发生的“自杀”属于细胞凋亡 D.肿瘤细胞具有无限增殖和糖蛋白减少易扩散转移等特征 4.伤寒是由伤寒杆菌引起的急性传染病,症状包括高烧、腹痛、严重腹泻、头痛、身体出现玫瑰色 斑等;A16 型肠道病毒可引起手足口病,多发生于婴幼儿,可引起手、足、口腔等部位的疱疹,个别 患者可引起心肌炎等并发症;某人虽已提前注射了流感疫苗但在冬季来临后多次患流感;关于上述致 2 病病原体的叙述不正确...的是( ) A.伤寒杆菌含 8 种核苷酸,病毒含 4 种碱基,两者遗传信息的传递都遵循中心法则 B.上述病原体都营寄生生活;都可用营养齐全的合成培养基培养 C.病原体蛋白质的合成所需要的核糖体、氨基酸等不都由宿主细胞提供 D.灭活的病毒仍具有抗原特异性,可以制成疫苗 5.下列说法中正确的有几项( ) ①乙烯只能由植物体内成熟的部位合成 ②植物激素的合成受基因的控制,植物激素也能调节基因的表达 ③植物没有神经系统,其生命活动的调节方式只有激素调节 ④太空中,根失去向地性是因为生长素不能进行极性运输 ⑤小麦、玉米在即将成熟时,如果经历一段时间的干热以后又遇到大雨的天气,种子就容易在穗上发 芽,这种现象与脱落酸的分解有关 A.2 项 B.3 项 C.4 项 D.5 项 6.下列关于生态系统相关的说法,正确的有几项( ) ①生态系统的结构包括非生物的物质和能量、生产者、消费者、分解者 ②所有生态系统必须有生产者、消费者及分解者才能维持其稳定 ③自然界中的 C、H、O、N 等元素,不断在无机环境和生物群落之间进行循环的过程,叫生态系统的 物质循环 ④任何生态系统都需要不断得到来自系统外的能量补充,以便维持生态系统的正常功能 ⑤植物生长素对植物生长的调节属于生态系统的信息传递中的化学信息 ⑥信息传递对于个体、种群、群落、生态系统的稳定都有重要作用 A.一项 B.两项 C.三项 D.四项 7.硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( ) A. 碱式硫酸铁水解能产生 Fe(OH)3 胶体,可用做净水剂 B. 为防止 NH4HCO3 分解,生产 FeCO3 需在较低温度下进行,该反应的离子方程式为: Fe2++2HCO3 -= FeCO3+ CO2↑+H2O C. 可用 KSCN 溶液检验(NH4)2Fe(SO4)2 是否被氧化 3 D. 该温度下,(NH4)2Fe(SO4)2 在水中的溶解度比 FeSO4 的大 8.短周期主族元素 X、Y、Z、W 的原子序数依次增大,其中 X 是组成有机物的基本骨架元素,元 素 Y 的核电荷数等于 W 原子的最外层电子数,元素 Z的最高正化合价为+2 价。下列说法正确的是( ) A.X、Y 的单质均具有较高的熔沸点 B.最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X C.原子半径由大到小的顺序: X、Y、Z D.Z、W 形成的化合物中既含有离子键,又含有共价键 9.探究浓硫酸和铜的反应,下列装置或操作正确的是( ) A.用装置甲进行铜和浓硫酸的反应 B.用装置乙收集二氧化硫并吸收尾气 C.用装置丙稀释反应后的混合液 D.用装置丁测定余酸的浓度 10.G 是一种香料,结构简式如图所示,下列说法错误的是 A.常温下,G 能使溴水褪色 B.G 的分子式为 C15H16O2 C.苯环上二溴代物有 5 种 D.G 分子中至少有 12 原子共平面 11.设 NA 为阿伏加德罗常数的值,下列说法正确的是( ) A.常温常压下,5.6L 甲烷和乙烯的混合气体中含氢原子数为 NA B.7.8g Na2O2 中所含阴阳离子的总数为 0.3NA C.将 4.6g 钠用铝箔包裹并刺小孔,与足量水充分反应生成氢气分子数为 0.1NA D.反应 2KNO3+3C+S =N2↑+ 3CO2↑+K2S,每生成 0.1mol N2 转移电子数为 NA 12.最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳 极和二氧化钛涂覆的钛阴极之间是可通过 H+的固体聚合物电解质。其结构如图所示,则下列说法错 误的是 4 A. 电源的 b 极为正极 B. 在能量转换过程中,固体电解质中 H+由阳极向阴极移动 C. 阴极电极反应式为:OX+4H++4e-=GC+H2O D. 为增强阳极电解液导电性,可在水中添加适量盐酸或 NaCl 13.下列实验方案中,可以达到实验目的的是 选项 实验目的 实验方案 A 除去苯中混有的苯酚 加入适量的溴水充分反应后过滤 B 制取 Fe(OH)3 胶体 向沸水中滴加 FeCl3 饱和溶液,继续加热至红 褐色,停止加热 C 验证酸性: CH3COOH>HClO 使用 pH 试纸分别测定相同温度下相同浓度的 CH3COONa 溶液和 NaClO 溶液的 pH D 检验溶液中含有 I- 向某溶液中加入 CCl4,振荡后静置,液体分层, 下层呈紫红色 二、选择题(本题共 8 小题,每题 6 分。在每小题给出的选项中,第 14~17 题只有一项符合题目要 求,第 18~21 题有多项符合题目要求。全部选对的得 6 分,选对但不全的得 3 分,有选错的得 0 分) 14.用图示装置研究光电效应现象,光阴极 K 与滑动变阻器的中心抽头 c 相连,当滑动头 P 从 a 移到 c 的过程中,光电流始终为零.为了产生光电流,可采取的措施是( ) A. 增大入射光的强度 B. 增大入射光的频率 C. 把 P 向 a 移动 D. 把 P 从 c 向 b 移动 15.如图所示,A、D 分别是斜面的顶端、底端,B、C 是斜面上的两个点,AB=BC=CD,E 点在 D 点 的正上方,与 A 等高.从 E 点以一定的水平速度抛出质量相等的两个小球,球 1 落在 B 点,球 2 落在 C 点。则关于球 1 和球 2 从抛出到落在斜面上的运动过程( ) A. 球 1 和球 2 运动的时间之比为 2∶1 B. 球 1 和球 2 动能增加量之比为 1∶3 C. 球 1 和球 2 抛出时初速度之比为 2 2 ∶1 D. 球 1 和球 2 运动时的加速度之比为 1∶2 16 . 如 图 所 示 , 一 理 想 变 压 器 的 原 、 副 线 圈 匝 数 之 比 为 n1∶n2 =10∶1 , 原 线 圈 接 入 电 压 的交流电源,交流电压表和电流表对电路的影响可忽略不计,定值电阻 R0=10 Ω, 可变电阻 R 的阻值范围为 0~10 Ω。则( ) 5 A. 副线圈中交变电流的频率为 100 Hz B. t=0.02 s 时,电压表的示数为 0 C. 调节可变电阻 R 的阻值时,电流表示数的变化范围为 1.1~2.2 A D. 当可变电阻阻值为 10 Ω时,变压器的输入电功率为 24.2 W 17.如图所示,A、B 两木块靠在一起放在光滑的水平面上,A、B 的质量分别为 mA=2.0 kg、mB=1.5 kg.一个质量为 mC=0.5 kg 的小铁块 C 以 v0=8 m/s 的速度滑到木块 A 上,离开木块 A 后最终与木块 B 一起匀速运动.若木块 A 在铁块 C 滑离后的速度为 vA=0.8 m/s,铁块 C 与木块 A、B 间存在摩擦.则 摩擦力对 B 做的功为( ) A. 0.6J B. 1.2J C. 0.45J D. 2.435J 18.在一个边界为等边三角形的区域内,存在一个方向垂直于纸面向里的匀强磁场,在磁场边界上的 P 点处有一个粒子源,发出比荷相同的三个粒子 a、b、c(不计重力)沿同一方向进入磁场,三个粒 子通过磁场的轨迹如图所示,用 ta、tb、tc 分别表示 a、b、c 通过磁场的时间;用 ra、rb、rc 分别表 示 a、b、c 在磁场中的运动半径,则下列判断正确的是( ) A. ta=tb>tc B. tc>tb>ta C. rc>rb>ra D. rb>ra>rc 19.在地面附近,存在着一个有界电场,边界 MN 将空间分成上下两个区域 I、II,在区域 II 中有竖 直向上的匀强电场,在区域 I 中离边界某一高度由静止释放一个质量为 m 的带电小球 A,如图甲所示, 小球运动的 v-t 图像如图乙所示,不计空气阻力,则( ) A.小球受到的重力与电场力之比为 3:5 B.在 t=5s 时,小球经过边界 MN C.在小球向下运动的整个过程中,重力做的功大于电场力做功 D.在 1 s~4s 过程中,小球的机械能先减小后增大 20.A、B 两块正对的金属板竖直放置,在金属板 A 的内侧表面系一绝缘细线,细线下端系一带电小 球(可视为点电荷)。两块金属板接在如图所示的电路中,电路中的 R1 为光敏电阻(其阻值随所受光 照强度的增大而减小),R2 为滑动变阻器,R3 为定值电阻。当 R2 的滑片 P 在中间时闭合电键 S,此时 电流表和电压表的示数分别为 I 和 U,带电小球静止时绝缘细线与金属板 A 的夹角为θ。电源电动势 E 和内阻 r 一定,下列说法中正确的是( ) 6 A.若将 R2 的滑动触头 P 向 a 端移动,则θ变小 B.若将 R2 的滑动触头 P 向 b 端移动,则 I 减小,U 减小 C.保持滑动触头 P 不动,用较强的光照射 R1,则小球重新达到稳定后θ变小 D.保持滑动触头 P 不动,用较强的光照射 R1,则 U 变化量与 I 变化量的绝对值的比值不变 21.如图所示,两个倾角分别为 30°和 60°的光滑斜面固定于水平地面上,并处于方向垂直纸面向 里、磁感应强度为 B 的匀强磁场中。两个质量均为 m、带电荷量为+q 的小滑块甲和乙分别从两个斜 面顶端由静止释放,运动一段时间后,两小滑块都将飞离斜面,在此过程中( ) A. 甲滑块飞离斜面瞬间的速度比乙滑块飞离斜面瞬间的速度大 B. 甲滑块在斜面上运动的时间比乙滑块在斜面上运动的时间短 C. 甲滑块在斜面上运动的位移与乙滑块在斜面上运动的位移大小相同 D. 两滑块在斜面上运动的过程中,重力的平均功率相等 三、非选择题:本卷包括必考题和选考题两部分。第 22-32 题为必考题,每个试题考生都必须作答。 第 33-38 题为选考题,考生根据要求作答。 (一)必考题(共 129 分) 22.(6 分)为了探究物体质量一定时加速度与力的关系,甲、乙同学设计了如图所示的实验装置。 其中带滑轮的小车的质量为 M,砂和砂桶的质量为 m, 滑轮的质量为 m0。力传感器可测出轻绳中的拉 力大小。 (1)实验时,一定要进行的操作是________。 A.用天平测出砂和砂桶的质量 B.将带滑轮的长木板右端垫高,以平衡摩擦力 C.小车靠近打点计时器,先接通电源,再释放小车,打出一条纸带,同时记录力传感器的示数 D.为减小误差,实验中一定要保证砂和砂桶的质量 m 远小于小车的质量 M。 (2)甲同学在实验中得到如图所示的一条纸带(两计数点间还有四个点没有画出),已知打点计时器 7 采用的是频率为 50Hz 的交流电,根据纸带可求出小车的加速度为________m/s2(结果保留三位有效 数字)。 (3)甲同学以力传感器的示数 F 为横坐标,加速度 a 为纵坐标,画出的 a-F 图象是一条直线,图线 与横坐标的夹角为θ,求得图线的斜率为 k,则小车的质量为____________。 A. 1 tan B. 0 1 tan m C. 0 2 mk D. 2 m 23、(10 分)如图甲所示,该电路在测量电源电动势和内阻的同时也能完成对未知电阻 RX 的测量。 实验室提供的器材如下: A.待测电阻 RX(约 9 欧姆) B.待测电源 C.电阻箱(0-99.9 欧姆) D.电压表 V1(量程 6V,可以视为理想电表) E.电压表 V2(量程 3V,内阻约 4 千欧姆) (1)如果纵坐标表示两个电压表读数之比,横坐标表示电阻箱的阻值 R,实验结果的图像如图乙所 示。则待测电阻 RX=____Ω(保留两位有效数字)。 (2)在(1)问中,由于电压表 V2 的分流,待测电阻 RX 的测量值比真实值_____(选填“偏大”“偏小” 或“不变”)。 (3)如果纵坐标表示某电压表读数 U,横坐标表示两个电压表读数之差与电阻箱阻值的比值,实验 结果的图像如图丙所示。其中能读出电源电动势和内电阻的是_____(选填“A”或“B”),两图线交点 的横坐标为_____A,纵坐标为_____V(结果均保留两位有效数字)。 24.(12 分)如图所示,与水平面成θ=30°角的两平行倾斜光滑导轨上端分别通过开关连接电动势为 E(未知)、内阻为 r 的电源,定值电阻 R0 。平行导轨处于垂直于导轨平面向下、磁感应强度为 B 的匀 强磁场中。两平行导轨相距 L,在导轨.上放置一电阻为 R、质量为 m 的导体棒 PQ。 (1)只闭合开关 S1,导体棒恰好能够在平行导轨上静止,求电池的电动势; 8 (2)只闭合开关 S2,求出导体棒的最大速度; 25. (19 分)如图所示,倾角为 37°足够长的传送带顺时针转动速度为 v0= 2 m/s,左边是光滑竖直半圆轨 道,半径 R=0.8m,中间是光滑的水平面 AB(足够长),AB 与传送带在 A 点由一段圆弧连接。用轻质细线 连接甲、乙两物体,两物体中间夹一轻质弹簧,弹簧与甲、乙两物体不拴连。甲的质量为 m1=3kg,乙的 质量为 m2=1kg,甲、乙均静止在光滑的水平面上。现固定甲物体,烧断细线,乙物体离开弹簧后在传送 带上滑行的最远距离为 s = 8 m。传送带与乙物体间的动摩擦因数为 0.5,重力加速度 g 取 10 m/s2,甲、 乙两物体可看作质点。(sin37°= 0.6,cos37°= 0. 8) (1)求物体乙刚滑上传送带时的速度。 (2)若固定乙物体,烧断细线,甲物体离开弹簧后进入半圆轨道,求甲物体通过 D 点时对轨道的压力大小。 (3)甲、乙两物体均不固定,烧断细线以后,试通过计算判断甲物体进人半圆轨道后是否会脱离圆弧轨道。 26.(14 分) 亚氯酸钠(NaClO2)是一种重要的消毒剂,可用 ClO2 为原料制取。某化学兴趣小组同学展 开对漂白剂亚氯酸钠(NaClO2)的研究。 已知:饱和 NaClO2 溶液在温度低于 38 ℃时析出的晶体是 NaClO2·3H2O,高于 38 ℃时析出的晶体是 NaClO2,高于 60 ℃时 NaClO2 分解成 NaClO3 和 NaCl。Ba(ClO2)2 可溶于水。 利用下图所示装置进行实验。 9 (1)装置①的作用是 ,装置③的作用是 。 (2)装置②中制备 ClO2 的化学方程式为 ;装置④中反应生 成 NaClO2 的化学方程式为 。 (3)从装置④反应后的溶液中获得 NaClO2 晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过 滤;③ ;④低于 60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致 产品中混有的杂质是 。 (4)设计实验检验所得 NaClO2 晶体是否含有杂质 Na2SO4,操作与现象是取少量晶体溶于蒸馏 水, 。 (5)为了测定 NaClO2 粗品的纯度,取 10.0 g 上述初产品溶于水配成 1 L 溶液,取出 10 mL 溶液于锥 形瓶中,再加入足量酸化的 KI 溶液,充分反应后(NaClO2 被还原为 Cl-,杂质不参加反应),加入 2~3 滴淀粉溶液,用 0.20 mol·L-1 的 Na2S2O3 标准液滴定,重复 2 次,平均消耗 Na2S2O3 溶液 20.00 mL,计 算得 NaClO2 粗品的纯度为 。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。 27.工业上采用酸性高浓度含砷废水(砷主要以亚砷酸 H3AsO3 形式存在)提取中药药剂 As2O3。工艺 流程如下: 回答下列问题: (1)已知砷元素与 N 同一主族,原子比 N 原子多两个电子层,则砷元素的原子序数为________, “沉砷”中所用 Na2S 的电子式为_____________。 (2)已知:As2S3 与过量的 S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33-;“沉砷”中 FeSO4 的作 用是___________________________。 (3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在 的试剂是_________________________________。(写名称) (4)调节 pH=0 时,由 Na3AsO4 制备 As2O3 的离子方程式为:_______________。 (5)一定条件下,用雄黄(As4S4)制备 As2O3 的转化关系如图所示。若反应中,1 mol As4S4(其中 As 元素的化合价为+2 价)参加反应时,转移 28 mol e-,则物质 a 为_______。(填化学式) (6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O AsO33-+I2+2OH-。当 P 池中溶液由 无色变成蓝色时,正极上的电极反应式为______________________________。一段时间后电流计指 10 针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。 28.能源问题是人类社会面临的重大问题,合理的开发利用至关重要。 (1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备 1-丁烯:C4H10(g)=C4H8(g)+H2(g) △H。下表为该反应中所涉及物质的键能数据: 则△H=_______。 (2)甲醇是未来重要的绿色能源之一,常见的合成反应为 CO(g) +2H2(g) CH3OH(g) ∆H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示: 该反应速率的通式为 v 正=k 正 cm(CO)·cn(H2)(k 是与温度有关的速率常数)。由表中数据可确定反应 速率通式中 m 和 n 分别_____________、____________(取正整数)。 (3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制 备:CH4(g)+H2O(g) CO(g)+3H2(g) ∆H>0。向 100 L 刚性密闭容器中充入 1 mol CH4 和 3 mol 水 蒸气进行反应,不同温度和压强下平衡体系中 CH4 的平衡转化率情况如图 1 所示: ①P1____P2(填“<”“>”或“=")。 ②已知压强为 P1,温度为 100°C 时,反应达到平衡所需的时间为 5min,则 0~5min 内用 H2 表示的 平均反应速率为____________;该温度下的平衡常数 K=________mol2·L-2。 (4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图 2 所示。 ①写出 Cu 电极上产生乙烯的电极反应式:________________;如果 Cu 电极上生成 0.17 mol CO 和 0.33 mol HCOOH,则 Pt 电极上产生 O2 的物质的量为__________mol。 ②HCOOH 为一元弱酸,常温下将 0.1 mol·L-1HCOOH 溶液与 0.1 mol·L-1 NaOH 溶液按体积比 a : b 混合(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数为_________________ (用含 a、b 的代数式表示)。 11 29.选取某植物幼苗进行无土栽培实验,下图为该幼苗的光合速率、呼吸速率随温度变化曲线图。请 据图回答: (1)假设上述实验在缺 Mg 的条件下进行,在其他条件相同的情况下,图中的 A 点会向__________ (左、右)移动。 (2)温室栽培该植物,为获得最大经济效益,应控制的最低温度为__________℃。 (3)限制 AB 段 CO2 吸收速率的主要因素是__________;图中__________点光合作用制造的有机物是 呼吸作用消耗有机物的两倍。 (4)为了探究不同条件对植物光合速率和呼吸速率的影响,用 8 株各有 20 片叶片、大小长势相似的 某盆栽植株,分别放在密闭的玻璃容器中,在不同条件下利用传感器定时测定密闭容器中二氧化碳的 含量。实验结果统计如下表: 编号 1 2 3 4 5 6 7 8 温度(℃) 10 10 20 20 30 30 40 40 光照强度(Lx) 1000 0 1000 0 1000 0 1000 0 12 小时后 CO2 量(g) -0.5 +0.1 -1.5 +0.4 -3.0 +1.0 -3.1 +0.8 (注:“+”表示环境中二氧化碳增加;“-”表示环境中二氧化碳减少) ①用编号为__________的装置可构成一个相对独立的实验组合,该实验组合的目的是探究温度对植物 呼吸作用速率的影响。欲探究其细胞呼吸的最适温度,实验设计思路是在 ℃之间缩小温度梯度 做平行实验。 ②由表可知,植物光合最强的是第__________编号组实验。 ③现有一株某植物的叶黄素突变体,将其叶片进行了红光照射光吸收测定,与正常叶片相比,实验结 果是光吸收差异__________(“不”或“非常”)显著。 30.某自花受粉的二倍体植物(2n=10)有多对容易区分的相对性状,部分性状受相关基因控制的情况 如下表。D、d 与 B、b 两对等位基因在染色体上的位置如图所示。请回答下列问题: 12 基因组成 表现型 等位基因 显性纯合 杂合 隐性纯合 A-a 红花 白花 B-b 窄叶 宽叶 D-d 粗茎 中粗茎 细茎 (1)如果要测定该植物的基因组,应该测定_______条染色体上的_______(填“基因”或“DNA”) 序列。 (2)若表中三对等位基因分别位于三对常染色体上,在减数分裂形成配子时遵循__________定律。 基因型为 AaBbDd 与 aabbdd 的两个植株杂交,子代中红花窄叶细茎植株占的比例为_________。 (3)已知电离辐射能使 D、d 基因所在的染色体片段发生断裂,分别随机结合在 B、b 所在染色体的 末端,形成末端易位。仅一条染色体发生这种易位的植株将高度不育,现将上图基因型为 BbDd 的植 株在幼苗时期用电离辐射处理,欲判定该植株是否发生易位及易位的类型,通过观察该植株自交后代 的表现型及比例进行判断。(注:不考虑基因突变和交叉互换) ①若出现__________种表现型的子代,则该植株没有发生染色体易位; ②若_______________,则该植株仅有一条染色体发生末端易位; ③若 D、d 所在染色体片段均发生了易位,且 d 基因连在 b 基因所在的染色体上,D 基因连在 B 基因 所在的染色体上,则后代的表现型及比例为窄叶粗茎:窄叶中粗茎:宽叶细茎=_________________。 31.下图表示人体内生长激素的部分生理作用及分泌过程的调节机制,请据图回答下列问题: (1)在神经调节过程中,多巴胺是一种_______,由突触前膜释放作用于突触后膜上的_______。 (2)据图分析,半胱胺对垂体分泌生长激素起_______(填“促进”或“抑制”)作用。 (3)研究发现,随着 GH 分泌增多,肝细胞释放胰岛素样生长因子的量增多,从而使垂体分泌的 GH 13 减少,这种调节机制称为_______;另外,体内 GH 过多会导致人患“垂体性糖尿病”,据此判断图中 (?)处的作用效果是_______(填“+”或“-”)。 32.某湖泊生活着金鱼藻、浮萍、芦苇等生物,并长期养殖鲫鱼;药物 A 由于某种原因随着污水进入 并影响湖泊生态系统。部分过程如图所示,请回答下列问题: (1)从湖岸到湖心依次生长着芦苇、浮萍和金鱼藻等生物,这体现了群落的________结构。 (2)由于多因素的影响,在夏季该湖泊生态系统水体中的 CO2 含量________(填“大于”或“等于” 或“小于”)冬季。 (3)采用标志重捕法调查鲫鱼的种群密度,若调查期间有些鲫鱼身上的标志丢失,则该种群密度的 估测数值与真实值相比会_____(填“偏大”或“相等”或“偏小”)。大量捕捞鲫鱼后,其 K 值将____ (填“变大”或“变小”或“不变”)。下列属于该区域鲫鱼种群基本特征的有____(填字母)。 a.空间分布 b.迁入率 c.互利共生 d.物种丰富度 e.种群密度 (4)下图表示流经 A 营养级的能量流动示意图,其中 a、b、c1、c2 表示能量值(单位:kJ)。若被 A 摄入的能量为 A KJ,其粪便中的能量为 B KJ,某种鱼以 A 的粪便为食物,则该种鱼获得 A 的能量 为_____KJ。 (二)选考题:共 45 分。请考生从 2 道物理题、2 道化学题、2 道生物题中每科任选一题作答。如果 多做,则每科按所做的第一题计分。 33. 【物理——选修 3-3】(15 分) (1)下列说法正确的是________。 A.松香在熔化过程中温度不变,分子平均动能不变 B.当分子间的引力与斥力平衡时,分子势能最小 C.液体的饱和汽压与饱和汽的体积有关 D.若一定质量的理想气体被压缩且吸收热量,则压强一定增大 E.若一定质量的理想气体分子平均动能减小,且外界对气体做功,则气体一定放热 (2)如图所示,开口向上的汽缸 C 静置于水平桌面上,用一横截面积 S=50 cm2 的轻质活塞封闭了一 14 定质量的理想气体,一轻绳一端系在活塞上,另一端跨过两个定滑轮连着一劲度系数 k=2 800 N/m 的竖直轻弹簧 A,A 下端系有一质量 m=14 kg 的物块 B。开始时,缸内气体的温度 t1=27℃,活塞到 缸底的距离 L1=120 cm,弹簧恰好处于原长状态。已知外界大气压强恒为 p0=1.0×105 Pa,取重力 加速度 g=10 m/s2,不计一切摩擦。现使缸内气体缓慢冷却,求: (ⅰ)当 B 刚要离开桌面时汽缸内封闭气体的温度; (ⅱ)气体的温度冷却到-93℃时 B 离桌面的高度 H。(结果保留两位有效数字) 34.【物理——选修 3-4】(15 分) (1)装有一定量液体的玻璃管竖直漂浮在水中,水面足够大,如图甲所示.把玻璃管向下缓慢按压 4cm 后放手,忽略运动阻力,玻璃管的运动可以视为竖直方向的简谐运动,测得振动周期为 0.5s.竖直 向上为正方向,某时刻开始计时,其振动图象如图乙所示,其中 A 为振幅.对于玻璃管,下列说法正 确的是___ A.回复力等于重力和浮力的合力 B.振动过程中动能和重力势能相互转化,玻璃管的机械能守恒 C.位移满足函数式 D.振动频率与按压的深度有关 E.在 t1~t2 时间内,位移减小,加速度减小,速度增大 (2)如图所示,一装满水的水槽放在太阳光下,将平面镜 M 斜放入水中,调整其倾斜角度,使一束太 阳光从 O 点经水面折射和平面镜反射,然后经水面折射回到空气中,最后射到槽左侧上方的屏幕 N 上,即可观察到彩色光带.如果逐渐增大平面镜的倾角θ,各色光将陆续消失.已知所有光线均在同 一竖直平面. ①从屏幕上最后消失的是哪种色光?(不需要解释) ②如果射向水槽的光线与水面成 30°,当平面镜 M 与水平面夹角θ=45°时,屏幕上的彩色光带恰好 全部消失.求:对于最后消失的那种色光,水的折射率. 35. [化学-选修 3:物质结构与性质]一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 15 (1)基态 Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性 由大到小的顺序是___________________。 (2)甘氨酸(H2N-CH2-COOH)中 N 的杂化轨道类型为______________;甘氨酸易溶于水,试从 结构角度解释___________________________________________。 (3)一水合甘氨酸锌中 Zn2+的配位数为_________。 (4)[Zn(IMI)4](ClO4)2 是 Zn2+的另一种配合物,IMI 的结构为 ,则 1 mol IMI 中含有 ________个σ键。 (5)常温下 IMI 的某种衍生物与甘氨酸形成的离子化合物 为液态而非 固态,原因是________________________________________。 (6)Zn 与 S 形成某种化合物的晶胞如图Ⅰ所示。 ①Zn2+填入 S2-组成的________________空隙中; ②由①能否判断出 S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为 d g/cm3,S2-半径 为 a pm,若要使 S2-、Zn2+相切,则 Zn2+半径为____________________pm(写计算表达式)。 36. [化学-选修 5:有机化学基础]乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活 性,是良好的心脑血管疾病的治疗药物。 16 已知:① ② ③ 请回答: (1)E 中含有的官能团名称为________________; (2)丹皮酚的结构简式为________________; (3)下列说法不正确的是___________; A.乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3 B.物质 B 可能溶于水,且能与盐酸反应生成有机盐 C.D→E 和 G→H 的反应类型均为取代反应 D.物质 C 能使浓溴水褪色,而且 1 mol C 消耗 2 mol Br2 (4)写出 F→G 的化学方程式__________________________。 (5)写出满足下列条件 F 的所有同分异构体的结构简式_______________________。 ①能发生银镜反应;1 mol F 与 2 mol NaOH 恰好反应。 ②1H-NMR 谱显示分子中含有 5 种氢原子;IR 谱显示有-NH2,且与苯环直接相连。 (6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合 理的路线制备阿司匹林( )。______________。(用流程图表示,无机试剂任选) 37.某校生物研究性学习小组的同学欲调查某冷饮店的冰块中大肠杆菌的含量。具体实验步骤如下: 第一步:配置培养基(成分:蛋白胨、氯化钠、乳糖、水、X 和琼脂); 第二步:制作无菌平板; 第三步:设置空白对照组和实验组,对照组接种①,实验组接种②。 第四步:将各组平板置于 37℃恒温箱中培养一段时间,统计各组平板上菌落的平均数。 回答下列问题: (1)培养基中的乳糖可以为大肠杆菌提供________(碳源、氮源、无机盐)。为了方便大肠杆菌的鉴 定,需要在培养基中添加成分 X ________,在该培养基表面,大肠杆菌的菌落呈现 ______(填颜色)。 (2)完善步骤三,①是_______________________ ,②是 ________________________ 。 (3)若该小组在空白对照组的平板上检测到少许菌落,请分析可能的原因:_______________。 (4)将 1mL 冰块水样稀释 100 倍,在 3 个平板上用涂布法分别接入 0.1mL 稀释液;经适当培养后,3 个平板上的菌落数分别为 39、38 和 37,据此可得出每升..水样中的活菌数为 ______________ 。 化学参考答案 7. D 8.B 9.C 10.C 11.B 12.D 13.B 26.(共 14 分) (1)吸收多余的 ClO2 气体,防止污染环境(1 分); 防止倒吸(或作安全瓶等)(1 分) (2)2NaClO3+Na2SO3+H2SO4(浓)= 2ClO2↑+2Na2SO4+H2O;(2 分) 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 (2 分) (3)用 38~60 ℃的温水洗涤(2 分); NaClO3 和 NaCl (2 分) (4)滴加几滴 BaCl2 溶液,若有白色沉淀出现,则含有 Na2SO4,若无白色沉淀出现,则不 含 Na2SO4 (2 分) (5)90.5% (2 分) 27.(14 分)【答案】(1)33(1 分) (2 分) (2)与过量的 S2-结合生成 FeS 沉淀,防止 As2S3 与 S2-结合生成 AsS33-(或与 S2-结合生 成 FeS 沉淀,使平衡左移,提高沉砷效果)(2 分) (3)稀硫酸、铁氰化钾(或稀硫酸、高锰酸钾)(1 分) (4)2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O(2 分) (5)SO2(2 分) (6)AsO43-+H2O+2e- AsO33-+2OH- (2 分) 向 Q 加入 Na3AsO3 固体或加入碱(NaOH 等)(2 分) 偏转方向与起始时相反。 28.(15 分)【答案】(1)+125kJ/mol (2 分) (2)1(1 分) 1(1 分) (3)① < (1 分) ② 0.003 mol/(L·min)(2 分) 1.35×10-4(2 分) (4)①2CO2+12H++12e-=C2H4+4H2O (2 分) 0.25(2 分) ② -7b 10a-b ´ (2 分) 35.(15 分) 【答案】(1)3d10(2 分) O>N>C>H (1 分) (2)sp3 (1 分) 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢 键(2 分) (3)5 (1 分) (4)12NA (2 分) (5)阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低 (2 分) (6)①正四面体(1 分) ②否(1 分) ( 3 3 388 4 AdN´ ×1010-a)pm (2 分) 36.【答案】(1)醚键、羰基(2 分) (2) (2 分) (3) AD (2 分) (4) (2 分) (5) (2 分) (2 分) (6) (3 分)查看更多