- 2021-05-27 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
湖北省武汉市高中物理 第三章 金属及其化合物 3
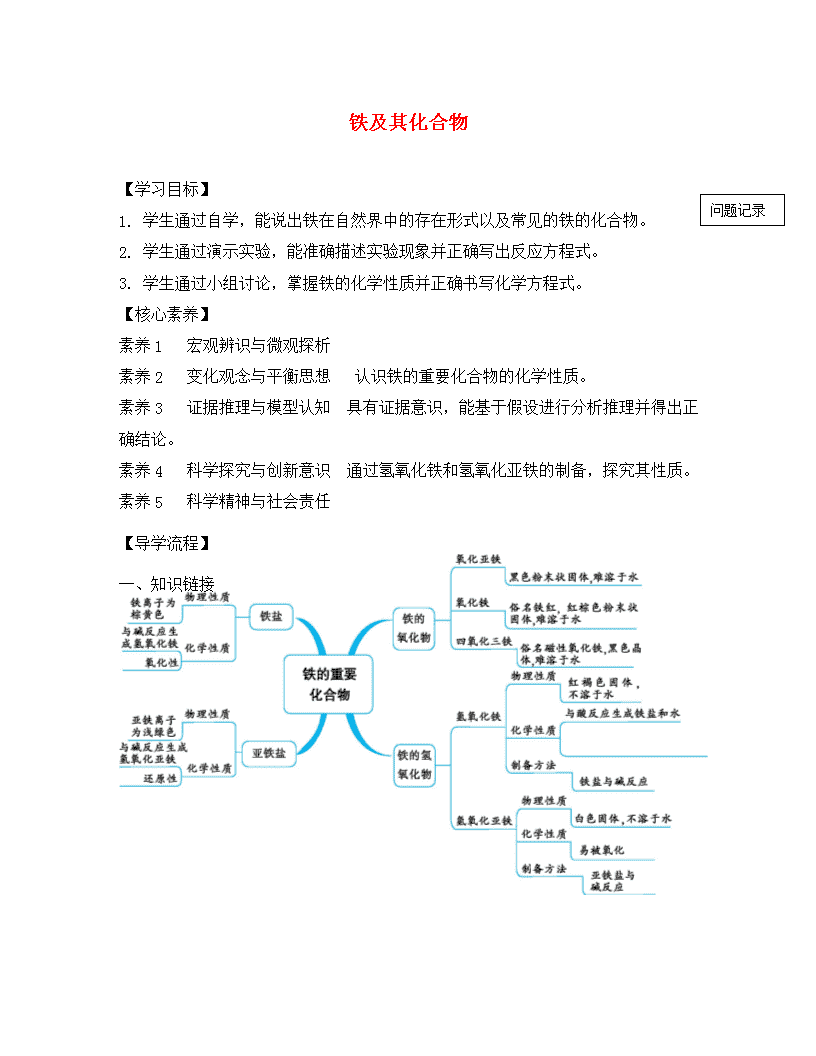
铁及其化合物 问题记录 【学习目标】 1. 学生通过自学,能说出铁在自然界中的存在形式以及常见的铁的化合物。 2. 学生通过演示实验,能准确描述实验现象并正确写出反应方程式。 3. 学生通过小组讨论,掌握铁的化学性质并正确书写化学方程式。 【核心素养】 素养1 宏观辨识与微观探析 素养2 变化观念与平衡思想 认识铁的重要化合物的化学性质。 素养3 证据推理与模型认知 具有证据意识,能基于假设进行分析推理并得出正确结论。 素养4 科学探究与创新意识 通过氢氧化铁和氢氧化亚铁的制备,探究其性质。 素养5 科学精神与社会责任 【导学流程】 一、知识链接 二、基础感知 一、铁的获取 1.存在 (1)含量:铁元素在地壳中的含量居第____位。 (2)形态:主要以________形式存在, 铁单质只有在_________中存在。 2.铁的冶炼 (1)设备:_______________。 (2)原料:___________、___________、_____________、_____________等。 (3)原理:高温下,用__________把铁从铁矿石中还原出来。 (4)主要反应: ①还原剂的生成:________________________,__________________。 ②铁矿石的还原:_______________________________________________________。 ③炉渣的形成:______________________________,__________________________。 (5)铁合金: 含C__________的为生铁,含C____________的为钢。 二.铁的性质及应用 (1)物理性质:________色有________光泽的固体,熔点____, 具有良好的________性、________性、________性,可以被________吸引。 (2)化学性质:①与非金属单质的反应(如Cl2、O2): ________________________________、____________________________________。 ②与稀盐酸、稀硫酸反应的离子方程式:___________________________________。 ③与某些盐的反应(如CuSO4溶液):_______________________________________。 ④钝化:常温下,铁、铝遇到浓HNO3、浓H2SO4时,表面生成________________而发生________,从而阻止内部金属进一步发生反应。 ⑤铁的化合物 a、_______用作颜料;b、______可作净水剂;c、_____作磁性材料。 三.铁的氧化物:有三种:氧化亚铁、氧化铁、四氧化三铁 FeO Fe2O3(铁红) Fe3O4(磁性氧化铁) 化合价 +2 +2 +2、+3 色、态 黑色粉未 红棕色粉未 黑色晶体 水溶性 均不溶于水 和弱氧化性酸反应 FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O 和强氧化性酸反应 3FeO + 10HNO3(稀) = 3Fe(NO3)3 + NO↑+ 5H2O Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O 3 Fe3O4 + 28HNO3 = 9 Fe(NO3)3 + NO↑+14H2O 稳定性 在空气中氧化为Fe3O4 空气中稳定 在空气中稳定 制备 高温熔融,过量的铁与O2反应:2Fe+O2=2FeO 氢氧化铁加热分解 2Fe(OH)3=Fe2O3+3H2O 铁在氧气中燃烧 3Fe + 2O2 = Fe3O4 注意:①FeO与非氧化性酸相遇时,发生复分解反应,生成亚铁盐;但与强氧化性酸相遇,Fe2+被氧化成Fe3+,生成铁盐 ②Fe3O4在三种氧化物中最为稳定,一般不与酸、碱和氧气反应,所以在铁的表面若能形成Fe3O4膜,便能起到保护作用,防止生锈。Fe3O4是一种复杂的氧化物,它不属于碱性氧化物,可以写成FeO·Fe2O3的形式有+2、+3 价 ③FeO、Fe2O3是碱性氧化物 ④空气中:6FeO + O2 = 2Fe3O4 三.深入学习 四.铁的氢氧化物: 氢氧化亚铁(Fe(OH)2) 氢氧化铁- Fe(OH)3 色态 白色固体 红褐色固体 水溶性 难溶于水 与酸反应 Fe(OH)2 + 2H+ = Fe2+ + 2H2O Fe(OH)3 + 3H+ = Fe3+ + 3H2O 与强氧化酸反应 3Fe(OH)2 + 10HNO3 = 3Fe(NO3)3 + NO↑+8H2O Fe(OH)3 + 3H+ = Fe3+ + 3H2O 稳定性 不稳定,易被空气中的氧气氧化,颜色变化:白色→灰绿色→红褐色 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 较稳定空气中久置会部分失水成铁锈受热易分解 制取 新制FeSO4溶液与NaOH溶液隔绝空气反应:Fe2+ + 2OH- = Fe(OH)2↓ 铁盐与可溶性碱反应 Fe3+ + 3OH- = Fe(OH)3↓ 思考:①实验中为什么要用新制的硫酸亚铁溶液?(防止硫酸亚铁被空气中的氧气氧化) ②怎样才能使Fe2+溶液长时间保存? (在配制溶液时,要加入少量铁粉防止氧化,加入少量对应酸抑制水解) ③实验中为什么要将滴管尖端插入试管里溶液底部,慢慢挤出氢氧化钠溶液 (氢氧化亚铁极易被氧化,溶解在水中的少量的氧气都能将它氧化成氢氧化铁,所以按一般强碱与弱酸盐反应制弱碱的操作很难得到。要制得白色溶液必须用加热煮沸过的蒸馏水(以减少溶解在水中的氧气)临时配制硫酸亚铁溶液,最好在溶液中再滴几滴植物油以避免硫酸亚铁溶液与空气接触,准备加入的氢氧化钠溶液也要先加热煮沸,并且滴管尖嘴要伸入硫酸亚铁溶液的底部再慢慢挤,以防止带入氧气) 五、铁盐和亚铁盐的相关实验 1 往FeCl3溶液中逐滴滴加NaOH,观察实验现象记录,并写出化学方程式,离子方程式。 2往FeCl2溶液中缓慢逐滴滴加少量NaOH稀溶液,观察实验现象记录,写出化学方程式。 3 往FeCl3溶液中滴加两滴KSCN溶液,观察实验现象记录下来,并写出化学方程式。 4 往FeCl2溶液中滴加两滴KSCN溶液,观察实验现象 再滴入几滴双氧水(H2O2),观察实验现象 以上操作有什么用途 当堂检测: 1.下列铁的化合物中,铁的质量分数最高的是( ) A.FeS2 B.FeO C.Fe2O3 D.Fe3O4 2.冶炼金属有下列方法:①焦炭法;②水煤气(或H2、CO)法;③活泼金属置换法;④电解法。相应的冶炼法古代有(Ⅰ)火烧孔雀石,(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铁,(Ⅳ)从氯化镁中炼镁。以下对应冶炼方法中,错误的是( ) A.(Ⅰ)① B.(Ⅱ)② C.(Ⅲ)③ D.(Ⅳ)④ 3.下列关于铁的叙述,错误的是( ) A.纯净的铁是光亮的银白色金属 B.铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁场 C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态也有化合态 D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化 4.下列化合物中,不可由两种单质直接化合得到的是( ) A.Fe3O4 B.FeCl2 C.Al2O3 D.CuCl2 5.下列金属中:①铁;②镁;③锰;④钒;⑤铬,可用铝热法制备的是( ) A.①②④ B.①②③⑤ C.①③④⑤ D.①②③④⑤查看更多