- 2021-05-24 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【物理】2019届一轮复习人教版 习题课:气体实验定律和理想气体状态方程的应用学案
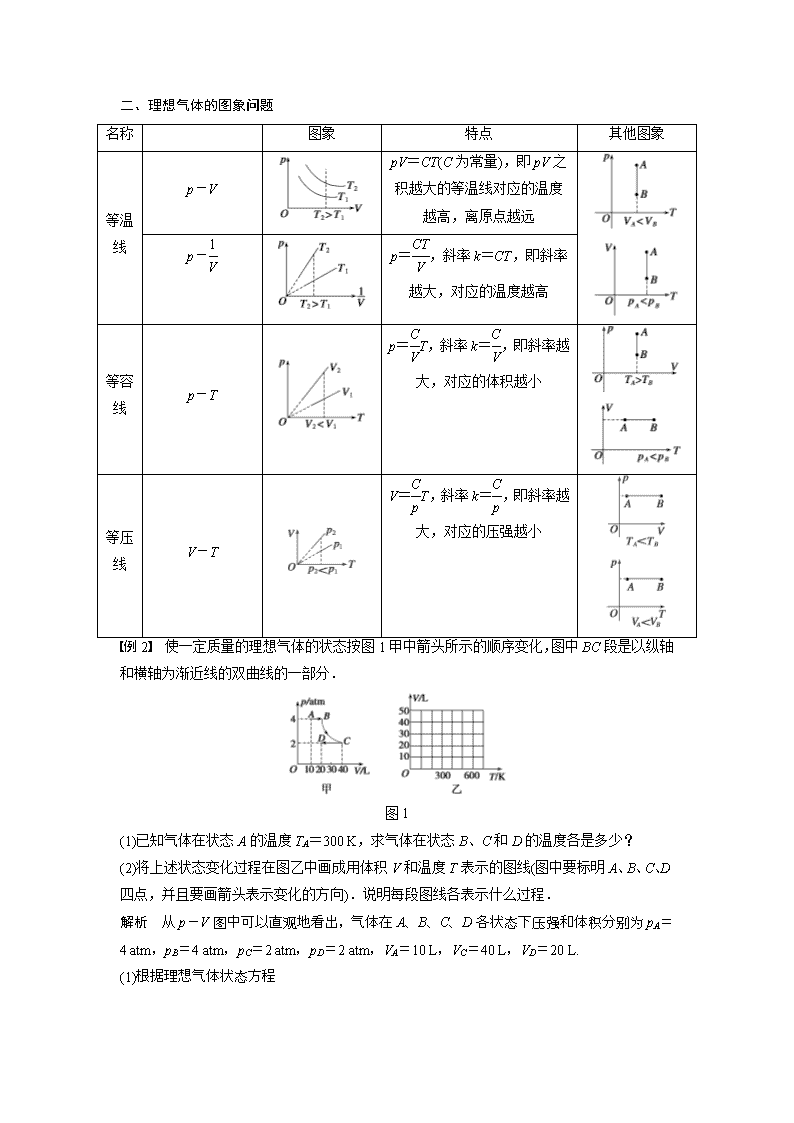
学案 4 习题课:气体实验定律和理想气体状态方程的应用 [考纲定位] 1.会巧妙地选择研究对象,使变质量问题转化为一定质量的气体问题.2.会利用图 象对气体状态、状态变化及规律进行分析,并应用于解决气体状态变化问题.3.会应用气体实 验定律和理想气体状态方程解决综合问题. 一、变质量问题 分析变质量问题时,可以通过巧妙选择合适的研究对象,使这类问题转化为定质量的气体问 题,从而用气体实验定律或理想气体状态方程解决.以常见的两类问题举例说明: 1.打气问题 向球、轮胎中充气是一个典型的变质量的气体问题.只要选择球内原有气体和即将打入的气 体作为研究对象,就可把充气过程看成等温压缩过程. 2.抽气问题 从容器内抽气的过程中,容器内的气体质量不断减小,这属于变质量问题.分析时,将每次 抽气过程中抽出的气体和剩余气体作为研究对象,总质量不变,故抽气过程可看成是等温膨 胀过程. 例 1 氧气瓶的容积是 40 L,其中氧气的压强是 130 atm,规定瓶内氧气压强降到 10 atm 时就要重新充氧.有一个车间,每天需要用 1 atm 的氧气 400 L,这瓶氧气能用几天?假定 温度不变. 解析 用如图所示的方框图表示思路. 由 V1→V2:p1V1=p2V2, V2=p1V1 p2 =130×40 10 L=520 L, 由(V2-V1)→V3:p2(V2-V1)=p3V3, V3=p2V2-V1 p3 =10×480 1 L=4 800 L, 则 V3 400 L =12(天). 答案 12 天 二、理想气体的图象问题 名称 图象 特点 其他图象 等温 线 p-V pV=CT(C 为常量),即 pV 之 积越大的等温线对应的温度 越高,离原点越远 p-1 V p=CT V ,斜率 k=CT,即斜率 越大,对应的温度越高 等容 线 p-T p=C VT,斜率 k=C V ,即斜率越 大,对应的体积越小 等压 线 V-T V=C pT,斜率 k=C p ,即斜率越 大,对应的压强越小 例 2 使一定质量的理想气体的状态按图 1 甲中箭头所示的顺序变化,图中 BC 段是以纵轴 和横轴为渐近线的双曲线的一部分. 图 1 (1)已知气体在状态 A 的温度 TA=300 K,求气体在状态 B、C 和 D 的温度各是多少? (2)将上述状态变化过程在图乙中画成用体积 V 和温度 T 表示的图线(图中要标明 A、B、C、 D 四点,并且要画箭头表示变化的方向).说明每段图线各表示什么过程. 解析 从 p-V 图中可以直观地看出,气体在 A、B、C、D 各状态下压强和体积分别为 pA =4 atm,pB=4 atm,pC=2 atm,pD=2 atm,VA=10 L,VC=40 L,VD=20 L. (1)根据理想气体状态方程 pAVA TA =pCVC TC =pDVD TD , 可得 TC=pCVC pAVA ·TA=2×40 4×10 ×300 K=600 K, TD=pDVD pAVA ·TA=2×20 4×10 ×300 K=300 K, 由题意知 B 到 C 是等温变化,所以 TB=TC=600 K. (2)由状态 B 到状态 C 为等温变化, 由玻意耳定律有 pBVB=pCVC,得 VB=pCVC pB =2×40 4 L=20 L. 在 V-T 图上状态变化过程的图线由 A、B、C、D 各状态依次连接(如图),AB 是等压膨胀过 程,BC 是等温膨胀过程,CD 是等压压缩过程. 答案 (1)600 K 600 K 300 K (2)见解析 三、理想气体的综合问题 1.定性分析液柱移动问题: 定性分析液柱移动问题常使用假设推理法:根据题设条件,假设液柱不动,运用相应的物理 规律及有关知识进行严谨的推理,得出正确的答案. 常用推论有两个: (1)查理定律的分比形式:Δp ΔT =p T 或Δp=ΔT T p. (2)盖—吕萨克定律的分比形式:ΔV ΔT =V T 或ΔV=ΔT T V. 2.定量计算问题: 定量计算问题是热学部分的典型的物理综合题,它需要考查气体、气缸或活塞等多个研究对 象,涉及热学、力学等物理知识,需要灵活、综合地应用知识来解决问题. 解决该问题的一般思路: (1)弄清题意,确定研究对象. (2)分析清楚初、末状态及状态变化过程,依据气体实验定律列出方程;对力学研究对象要 正确地进行受力分析,依据力学规律列出方程进而求出压强. (3)注意挖掘题目中的隐含条件,如几何关系等,列出辅助方程. (4)多个方程联立求解.对求解的结果注意检验它们的合理性. 例 3 如图 3 所示,固定的绝热气缸内有一质量为 m 的 T 型绝热活塞(体积可忽略),距气 缸底部 h0 处连接一 U 形管(管内气体的体积忽略不计).初始时,封闭气体温度为 T0,活塞 距离气缸底部为 1.5h0,两边水银柱存在高度差.已知水银的密度为ρ,大气压强为 p0,气缸 横截面积为 S,活塞竖直部分长为 1.2h0,重力加速度为 g,试问: 图 3 (1)初始时,水银柱两液面高度差多大? (2)缓慢降低气体温度,水银柱两液面相平时温度是多少? 答案 (1)m ρS (2) 4p0T0S 5p0S+5mg 解析 (1)被封闭气体压强 p=p0+mg S =p0+ρgh 初始时,水银柱两液面高度差为 h=m ρS. (2)降低温度直至水银柱两液面相平的过程中,气体先等压变化,后等容变化. 初状态:p1=p0+mg S ,V1=1.5h0S,T1=T0 末状态:p2=p0,V2=1.2h0S,T2=? 根据理想气体状态方程p1V1 T1 =p2V2 T2 , 代入数据得:T2= 4p0T0S 5p0S+5mg 1. (变质量问题)某种喷雾器的贮液筒的总容积为 7.5 L,如图 4 所示,装入 6 L 的药液后再用 密封盖将贮液筒密封,与贮液筒相连的活塞式打气筒每次能压入 300 cm3、1 atm 的空气,设 整个过程温度保持不变,求: 图 4 (1)要使贮液筒中空气的压强达到 4 atm,打气筒应打压几次? (2)在贮液筒中空气的压强达到 4 atm 时,打开喷嘴使其喷雾,直到内外气体压强相等,这时 筒内还剩多少药液? 答案 (1)15 (2)1.5 L 解析 (1)设每打一次气,贮液筒内增加的压强为 p 由玻意耳定律得:1 atm×300 cm3=1.5×103 cm3×p,p=0.2 atm 需打气次数 n=4-1 0.2 =15 (2)设停止喷雾时贮液筒内气体体积为 V 由玻意耳定律得:4 atm×1.5 L=1 atm×V V=6 L 故还剩药液 7.5 L-6 L=1.5 L. 2. (理想气体的图象问题)一定质量的理想气体,经历一膨胀过程,此过程可以用图 5 中的直 线 ABC 来表示,在 A、B、C 三个状态上,气体的温度 TA、TB、TC 相比较,大小关系为( ) 图 5 A.TB=TA=TC B.TA>TB>TC C.TB>TA=TC D.TB<TA=TC 答案 C 解析 由题图中各状态的压强和体积的值:pAVA=pCVC<pBVB,因为pV T =C,可知 TA=TC< TB. 3.(液体移动问题)两端封闭、内径均匀的直玻璃管水平放置,如图 6 所示.V 左查看更多
相关文章
- 当前文档收益归属上传用户