- 2021-05-14 发布 |
- 37.5 KB |
- 11页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学常见气体制备和实验方案设计新人教版必修部分
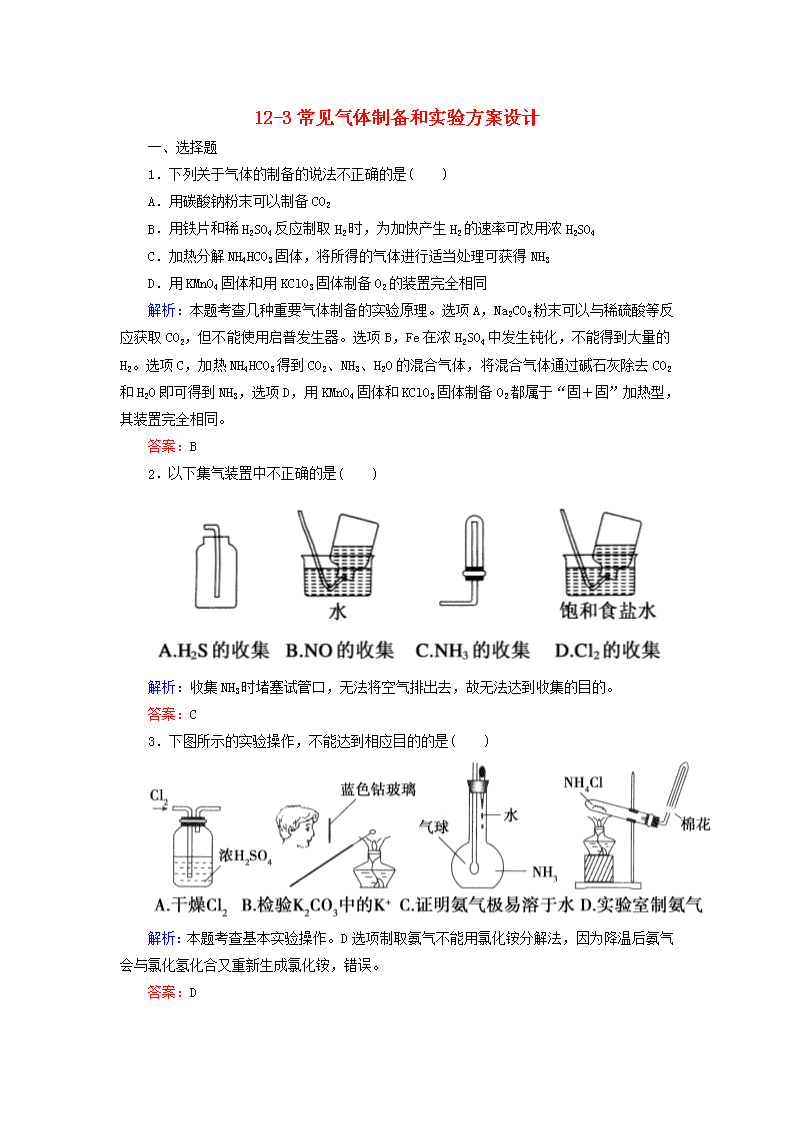
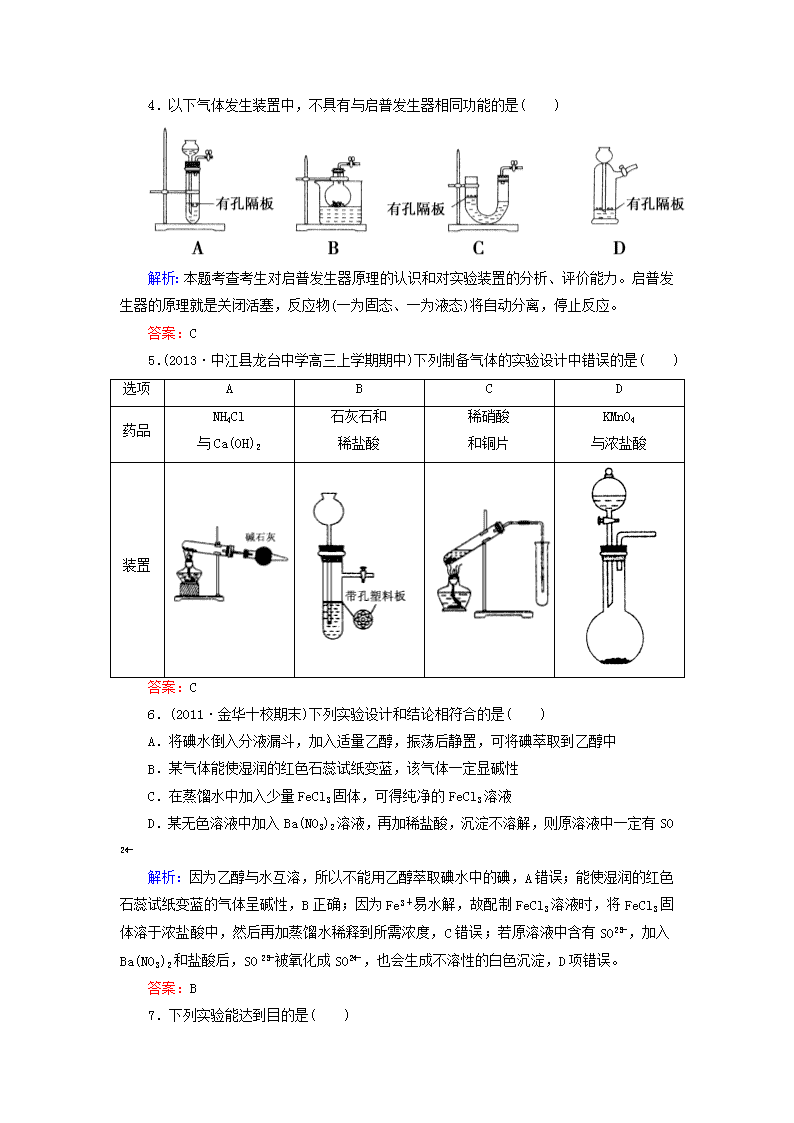
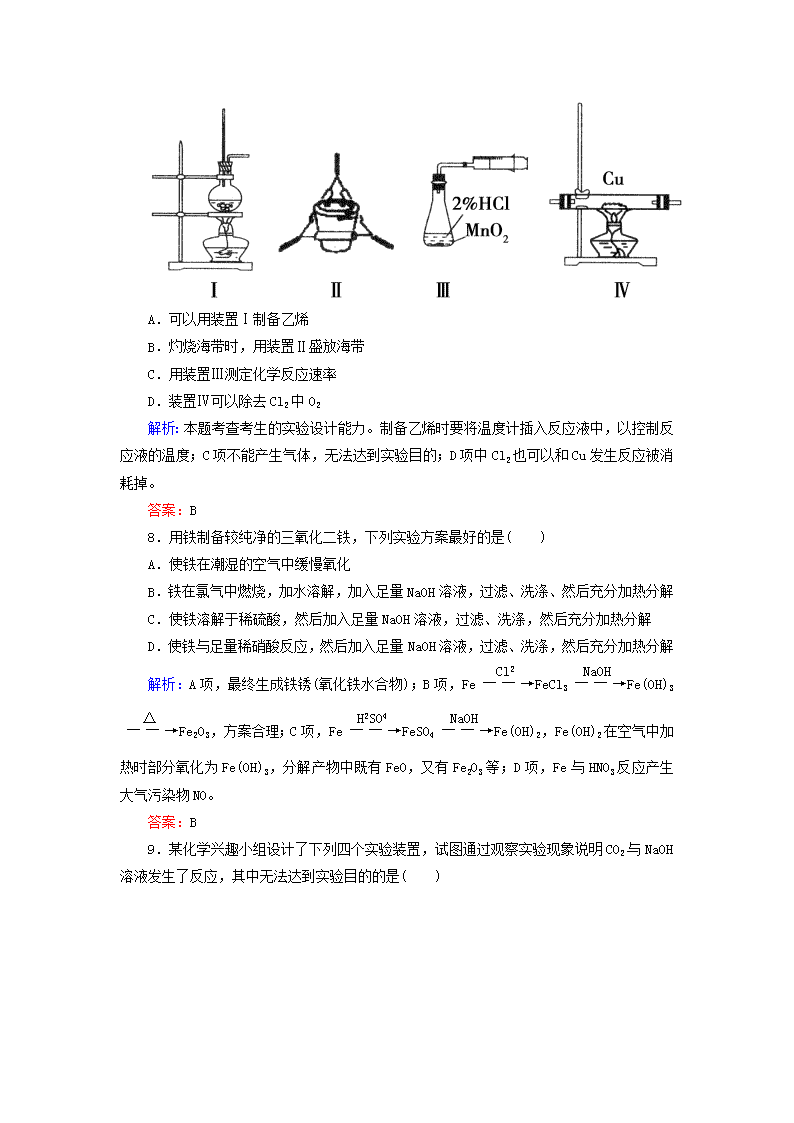
12-3常见气体制备和实验方案设计 一、选择题 1.下列关于气体的制备的说法不正确的是( ) A.用碳酸钠粉末可以制备CO2 B.用铁片和稀H2SO4反应制取H2时,为加快产生H2的速率可改用浓H2SO4 C.加热分解NH4HCO3固体,将所得的气体进行适当处理可获得NH3 D.用KMnO4固体和用KClO3固体制备O2的装置完全相同 解析:本题考查几种重要气体制备的实验原理。选项A,Na2CO3粉末可以与稀硫酸等反应获取CO2,但不能使用启普发生器。选项B,Fe在浓H2SO4中发生钝化,不能得到大量的H2。选项C,加热NH4HCO3得到CO2、NH3、H2O的混合气体,将混合气体通过碱石灰除去CO2和H2O即可得到NH3,选项D,用KMnO4固体和KClO3固体制备O2都属于“固+固”加热型,其装置完全相同。 答案:B 2.以下集气装置中不正确的是( ) 解析:收集NH3时堵塞试管口,无法将空气排出去,故无法达到收集的目的。 答案:C 3.下图所示的实验操作,不能达到相应目的的是( ) 解析:本题考查基本实验操作。D选项制取氨气不能用氯化铵分解法,因为降温后氨气会与氯化氢化合又重新生成氯化铵,错误。 答案:D 4.以下气体发生装置中,不具有与启普发生器相同功能的是( ) 解析:本题考查考生对启普发生器原理的认识和对实验装置的分析、评价能力。启普发生器的原理就是关闭活塞,反应物(一为固态、一为液态)将自动分离,停止反应。 答案:C 5.(2013·中江县龙台中学高三上学期期中)下列制备气体的实验设计中错误的是( ) 选项 A B C D 药品 NH4Cl 与Ca(OH)2 石灰石和 稀盐酸 稀硝酸 和铜片 KMnO4 与浓盐酸 装置 答案:C 6.(2011·金华十校期末)下列实验设计和结论相符合的是( ) A.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,可将碘萃取到乙醇中 B.某气体能使湿润的红色石蕊试纸变蓝,该气体一定显碱性 C.在蒸馏水中加入少量FeCl3固体,可得纯净的FeCl3溶液 D.某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO 解析:因为乙醇与水互溶,所以不能用乙醇萃取碘水中的碘,A错误;能使湿润的红色石蕊试纸变蓝的气体呈碱性,B正确;因为Fe3+易水解,故配制FeCl3溶液时,将FeCl3固体溶于浓盐酸中,然后再加蒸馏水稀释到所需浓度,C错误;若原溶液中含有SO,加入Ba(NO3)2和盐酸后,SO被氧化成SO,也会生成不溶性的白色沉淀,D项错误。 答案:B 7.下列实验能达到目的是( ) A.可以用装置Ⅰ制备乙烯 B.灼烧海带时,用装置Ⅱ盛放海带 C.用装置Ⅲ测定化学反应速率 D.装置Ⅳ可以除去Cl2中O2 解析:本题考查考生的实验设计能力。制备乙烯时要将温度计插入反应液中,以控制反应液的温度;C项不能产生气体,无法达到实验目的;D项中Cl2也可以和Cu发生反应被消耗掉。 答案:B 8.用铁制备较纯净的三氧化二铁,下列实验方案最好的是( ) A.使铁在潮湿的空气中缓慢氧化 B.铁在氯气中燃烧,加水溶解,加入足量NaOH溶液,过滤、洗涤、然后充分加热分解 C.使铁溶解于稀硫酸,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解 D.使铁与足量稀硝酸反应,然后加入足量NaOH溶液,过滤、洗涤,然后充分加热分解 解析:A项,最终生成铁锈(氧化铁水合物);B项,FeFeCl3Fe(OH)3Fe2O3,方案合理;C项,FeFeSO4Fe(OH)2,Fe(OH)2在空气中加热时部分氧化为Fe(OH)3,分解产物中既有FeO,又有Fe2O3等;D项,Fe与HNO3反应产生大气污染物NO。 答案:B 9.某化学兴趣小组设计了下列四个实验装置,试图通过观察实验现象说明CO2与NaOH溶液发生了反应,其中无法达到实验目的的是( ) 解析:D项中a瓶中的导气管应长进短出。 答案:D 10.(2012·天津六校联考)下列实验操作与预期实验目的或所得实验结论一致的是( ) 选项 实验操作 实验目的或结论 A 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间过滤 除去MgCl2溶液中少量FeCl3 B 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 证明溶液中含SO C 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊 证明该溶液中存在CO D 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 FeCl3溶液对H2O2分解速率无影响 解析:FeCl3溶液中存在水解平衡:Fe3++3H2OFe(OH)3+3H+,加入足量Mg(OH)2粉末(不引入新的杂质离子)能使水解平衡正向移动,Fe3+以Fe(OH)3的形式沉淀而析出,从而达到除杂的目的,故A正确;“向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失”,该溶液中可能存在Ag+,故B错;“向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊”,该溶液中还可能存在SO,故C错;FeCl3溶液对H2O2的分解有催化作用,故D错。 答案:A 11.下列实验设计能够成功的是( ) A.检验亚硫酸钠试样是否变质:试样溶液白色沉淀沉淀不溶解 B.除去乙酸乙酯中混有的乙酸: 混合液溶液分层得上层液体 C.证明酸性条件下H2O2氧化性比I2强: NaI溶液溶液变蓝色 D.鉴定盐A的成分是FeBr3: 解析:Na2SO3溶液中加HNO3能将SO氧化生成SO,A错误;乙酸能与Na2CO3反应,故上层是乙酸乙酯,B正确;在NaI溶液中加HNO3酸化,可认为是HNO3氧化I-,C错误;同样,向FeBr2溶液中加HNO3酸化的AgNO3溶液时,Fe2+可被氧化为Fe3+,不能说明盐A溶液中含有Fe3+,故D错误。 答案:B 12.(2012·江西盟校二联)下列实验对应的结论不正确的是( ) A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si C.③说明反应2NO2(g)N2O4(g),ΔH<0 D.④白色沉淀为BaSO4 解析:A项,通过盐桥可形成原电池。B项,HCl不是氯元素最高价氧化物的水化物,不能通过其酸性强弱来比较非金属性强弱。C项,热水中颜色加深,则升高温度时,2NO2(g)N2O4(g)平衡向逆反应方向移动,则正反应是放热反应,即ΔH<0。D项,SO2溶于水生成H2SO3,H+、NO把SO氧化成SO,从而生成BaSO4沉淀。 答案:B 13.为测定碳酸钠的质量分数(设含杂质碳酸氢钠),某学生设计了如下实验方案,下列对实验方案的叙述正确的是( ) A.称量所需要的仪器是托盘天平 B.样品放在蒸发皿中灼烧 C.样品中碳酸钠的质量分数为0.76 D.如果灼烧后的样品放在空气中冷却,会造成实验结果偏大 解析:托盘天平不可能精确到小数点后三位;灼烧应放在坩埚中,而不是蒸发皿中;碳酸氢钠受热分解生成碳酸钠,根据化学反应方程式计算,求出碳酸钠的质量分数为0.892;灼烧后的样品放在空气中冷却,碳酸钠吸水,会造成实验结果偏大。 答案:D 14.(2011·广东高考)某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是( ) A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性 B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 解析:A中稀释浓H2SO4方法错误;B正确;C中过滤时,将Mg(OH)2浊液倒入过滤器中应用玻璃棒引流;D中MgCl2溶液加热蒸干时,Mg2+水解,加热促进水解平衡向正方向移动,最终得不到MgCl2固体。 答案:B 15.(2011·上海高考)草酸晶体(H2C2O4·2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( ) 解析:草酸先熔化后分解,不能用C,有水生成不能用A,而锥形瓶不能用于给固体加热。 答案:D 二、非选择题 16.(2012·济南市2月高考模拟) (1)实验是化学研究的基础,下列有关说法中,正确的是_______。 a.可在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 b.用pH试纸测定溶液的pH时,不需要蒸馏水润湿试纸 c.实验室中不慎将酒精洒在台面上起火,可用湿抹布覆盖灭火 d.实验室取用少量白磷时,可将白磷取出,在空气中用小刀切割 (2)用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示。能用此装置制备的气体有__________。 a.用块状大理石与盐酸反应制取CO2 b.用锌粒与稀硫酸反应制取H2 c.用过氧化钠与水反应制取O2 d.用二氧化锰与浓盐酸反应制取Cl2 解析:本题考查化学实验。难度中等。 (1)a项,石英中的二氧化硅可与氢氧化钠反应,错误;d项,白磷可在空气中自燃,错误。(2)过氧化钠与水的反应太剧烈,不能控制,c项不可;而用二氧化锰与浓盐酸反应制氯气需要加热,d项不可。 答案:(1)bc (2)ab 17.(2012·北京东城二模)某课外活动小组设计下列实验装置(夹持仪器略),验证“二氧化碳与水接触时才能和过氧化钠反应”。 (1)过氧化钠与二氧化碳反应的化学方程式是______________,该反应中,反应物的总能量____________(填“大小”或“小于”)生成物的总能量。 (2)装置Ⅰ中的试剂是________(填序号)。 a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石 (3)实验时,应先打开弹簧夹______(填K1或K2),观察到预期现象后,关闭它,再打开另一个弹簧夹。 (4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。 ①为了观察到木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是________________; ②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是____________________________________。 (5)为进一步达到实验目的,应补充的实验是:最终反应后Ⅲ中所得固体,______________________。 解析:本题是一道以CO2与Na2O2的反应为背景的实验题,考查了实验方案的设计与评价。(1)CO2与Na2O2反应为放热反应,反应物总能量大于生成物总能量。(2)稀盐酸会挥发出HCl气体,对实验产生影响,故选用稀硫酸;稀硫酸与石灰石反应生成微溶物CaSO4会阻止反应进行,故选择小苏打。(3)先关闭K1,打开K2,CO2被浓硫酸干燥,观察干燥的CO2 是否与Na2O2反应,然后再关闭K2,打开K1,观察含水蒸气的CO2与Na2O2的反应现象。(4)①从a中出来的O2中会含有大量未反应的CO2,故在Ⅲ后安装一个盛有碱石灰的干燥管除去CO2;②H2O与Na2O2反应也会产生O2,故通过检验是否有O2生成来达到实验目的也不可靠。(5)CO2与Na2O2反应生成Na2CO3,而水与Na2O2反应生成的是NaOH,故可通过检验反应后固体产物的成分来达到实验目的。 答案:(1)2Na2O2+2CO2===2Na2CO3+O2 大于 (2)bc (3)K2 (4)①除去未反应的CO2 ②水与Na2O2反应生成氧气 (5)加入稀盐酸,将产生的气体通入澄清石灰水(合理答案均给分) 18.(2012·湖南省十二校高三联考(一))下列装置可用于某些气体(或物质)的制备、干燥、性质的验证和尾气的处理(加热及夹持、固定装置均略去),请回答下列问题(仪器装置可任意选用,必要时可重复使用): (1)当圆底烧瓶中盛装锌片,分液漏斗中盛装稀硫酸时,可验证H2的还原性并检验其氧化产物。 ①仪器的连接顺序为A→D→B→B→C,两次使用B装置,其中所盛的药品依次CuO、________,证明H2有还原性的现象是________ ____________________________。 ②检查好装置的气密性后,在加热B之前必须进行的操作是___。 (2)若圆底烧瓶中盛装MnO2、分液漏斗中盛装浓盐酸,B中是纯铁粉,则可选用上述装置制取纯净的FeCl3(FeCl3遇水蒸气产生白雾)。 ①按气流由左向右流动的方向,选择适当的仪器与A相连进行实验,按装置的连接顺序完成下表: 仪器编号 作用 A 制备Cl2 ②装置A中发生反应的离子方程式为___________________。 ③实验过程中,A、B两处均需要加热但不能同时加热,应先加热A一段时间后再点燃B处酒精灯的理由是__________________。 ④设计一种方案,验证实验结束后,B装置内固体中仍存在一定量的铁单质:______________________________________________。 答案:(1)①无水硫酸铜 左侧的硬质玻璃管B中固体由黑色变成红色(或左侧硬质玻璃管中固体由白色变成蓝色) ②检验H2是否纯净或装置中的空气是否排尽 (2)① 仪器偏号 作用 F 除去挥发出来的HCl D 干燥Cl2 B 制备FeCl3 C(或D) 防止水蒸气进入B中导致FeCl3变质 E 吸收没有反应完的Cl2,防止污染空气 (或其他合理答案) ②MnO2+4H++2Cl-Mn2++Cl2↑+2H2O ③先用Cl2排除装置内的空气,防止加热时O2氧化单质铁 ④取出装置B中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现 19.(2012·辽宁省大连市高三一模)Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤: (Ⅰ)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解; (Ⅱ)小心煮沸溶液1~2 min; (Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。 (1)在(Ⅰ)中,刚通入CO2时发生反应的化学方程式为________;而后又发生反应的离子方程式为__________________; 在(Ⅱ)中煮沸溶液的目的是__________________; 在(Ⅲ)中混合另一半NaOH溶液后发生反应的离子方程式是________________________。 (2)按该同学的设计,第(Ⅰ)步实验装置如下: ①装置A使用的试剂是_____(固体)和_____溶液。 ②装置B使用的试剂最好是______(填“水”、“饱和NaOH溶液”、“饱和Na2CO3溶液”或“饱和NaHCO3溶液”),作用是______________________,如果不用装置B,最终得到的Na2CO3溶液中可能存在的杂质有__________。 答案:(1)2NaOH+CO2===Na2CO3+H2O CO+CO2+H2O===2HCO 除去过量的CO2气体,防止NaHCO3分解 OH-+HCO===CO+H2O (2)①石灰石 盐酸 ②饱和NaHCO3溶液 除去CO2中混有的HCl气体 NaCl、NaOH查看更多