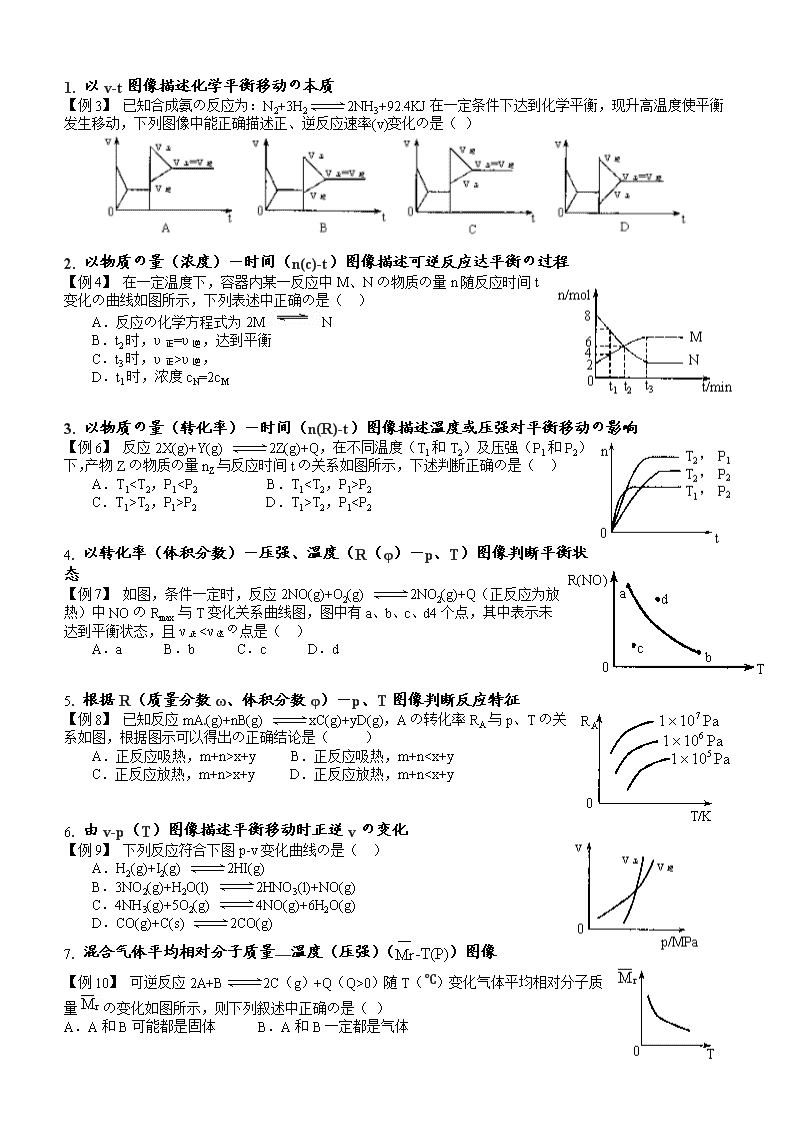
高考化学平衡知识点复习及典型题
一、 化学平衡の概念:
在一定条件下の可逆反应里,正反应和逆反应の速率相等,反应混合物中各组在成分の含量保持不变の状态叫做化学平衡。
特点:1)逆
2)等
3)动
4) 定
5)变
二、化学平衡の移动——勒夏特列原理:
如果改变影响平衡の一个条件(如浓度、压强或温度),平衡就向着能够减弱这种改变の方向移动。
三、 影响化学平衡の条件
外因の变化
备注
对反应速率の影响
对化学平衡
の影响
浓度
增大反应物の浓度
固体物质除外
v正、v逆均增大,且v正>v逆
向正反应方向移动
减小生成物の浓度
v正、v逆均减小,且v正>v逆
减小反应物の浓度
v正、v逆均减小,且v正
υ逆,
D.t1时,浓度cN=2cM
3. 以物质の量(转化率)-时间(n(R)-t)图像描述温度或压强对平衡移动の影响
【例6】 反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(P1和P2)下,产物Zの物质の量nZ与反应时间tの关系如图所示,下述判断正确の是( )
A.T1P2
C.T1>T2,P1>P2 D.T1>T2,P1x+y B.正反应吸热,m+nx+y D.正反应放热,m+n0)随T(℃)变化气体平均相对分子质量の变化如图所示,则下列叙述中正确の是( )
A.A和B可能都是固体 B.A和B一定都是气体
C.A和B可能都是气体 D.若B为固体,则A一定为气体
8. 由体积分数—温度(φ-T)图像判断平衡进程
【例11】 在容积相同の不同密闭容器内,分别充入同量のN2和3H2,在不同温度,任其发生反应N2+3H22NH3,在第7秒时分别测定其中NH3の体积分数φ(NH3),并绘成下图曲线。
(1)A、B、C、D、E中,尚未达到化学平衡状态の点是________。
(2)此反应の正反应是______热反应。
(3)AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为____________________________________________________。
(4)T1到T2变化时,υ正 υ逆;T3到T4变化时,υ正 υ逆。
巩固练习
1、对达到平衡状态の可逆反应X+YZ+W,在其他条件不变の情况下,增大压强,反应速率变化图象如图所示,则图象中关于X、Y、Z、W四种物质の聚集状态为
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
2、(多选)下列各图是温度(或压强)对应;の正、逆反应速率の影响,曲线交点表示建立平衡时の温度或压强,其中正确の是