化学高考真题分类汇编专题12 水溶液中的离子平衡
专题十二 水溶液中的离子平衡
1.【2016 年高考海南卷】向含有 MgCO3 固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的
是( )
A.c(CO32−) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
【答案】A
【名师点睛】难溶电解质的溶解平衡是这几年高考的热点,掌握难溶电解质的溶解平衡及溶解平衡的应用,
并运用平衡移动原理分析、解决沉淀的溶解和沉淀的转化问题,既考查了学生的知识迁移能力、动手
实验的能力,又考查了学生实验探究的能力和逻辑推理能力。本题较基础,只需把握平衡移动原理即
可得到结论。
2.【2016 年高考江苏卷】下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
【答案】A
【考点定位】本题主要是考查化学图像分析,热化学,化学反应速率,溶液中的离子平衡等有关判断
【名师点晴】掌握有关的化学反应原理,明确图像中曲线的变化趋势是解答的关键。注意酶的催化效率与
温度的关系,温度太高或太低都不利于酶的催化。注意电离平衡也是一种动态平衡,当溶液的温度、
浓度以及离子浓度改变时,电离平衡都会发生移动,符合勒·夏特列原理。
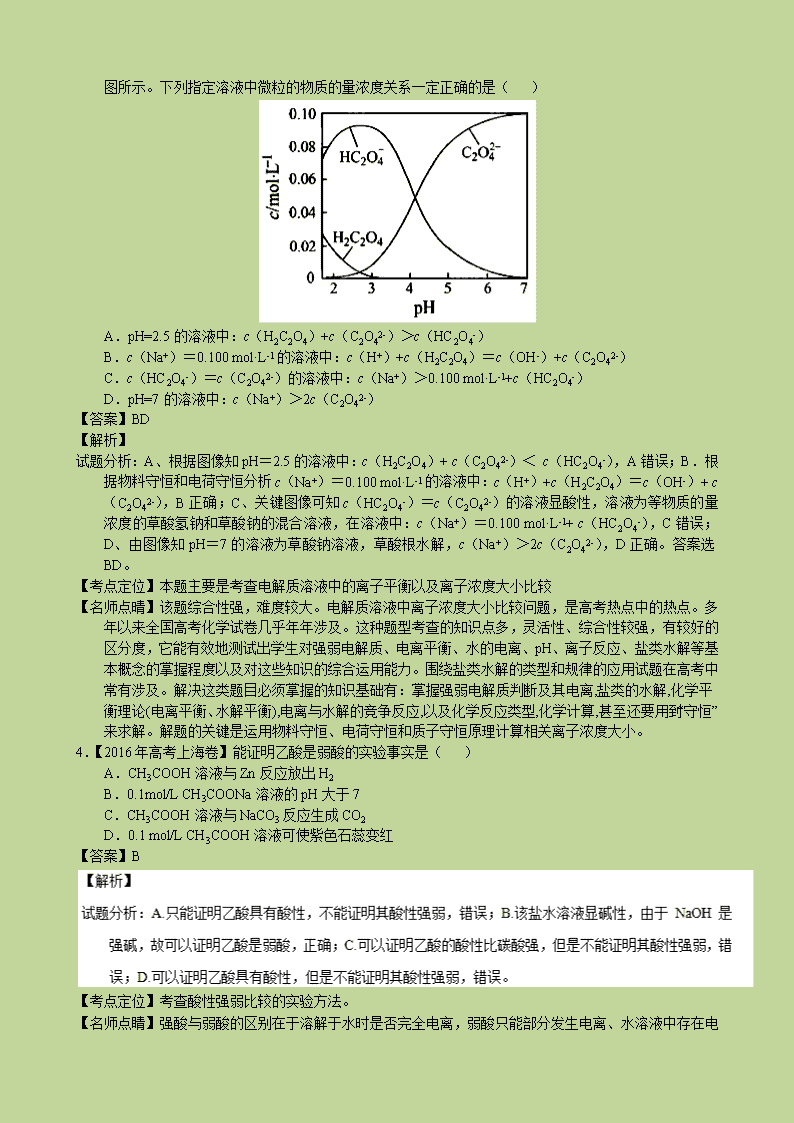
3.【2016 年高考江苏卷】H2C2O4 为二元弱酸。20℃时,配制一组 c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
=0.100 mol·L-1 的 H2C2O4 和 NaOH 混合溶液,溶液中部分微粒的物质的量浓度随 pH 的变化曲线如右
图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
A.pH=2.5 的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.c(Na+)=0.100 mol·L-1 的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O4-)
D.pH=7 的溶液中:c(Na+)>2c(C2O42-)
【答案】BD
【解析】
试题分析:A、根据图像知 pH=2.5 的溶液中:c(H2C2O4)+ c(C2O42-)< c(HC2O4-),A 错误;B.根
据物料守恒和电荷守恒分析 c(Na+)=0.100 mol·L-1 的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c
(C2O42-),B 正确;C、关键图像可知 c(HC2O4-)=c(C2O42-)的溶液显酸性,溶液为等物质的量
浓度的草酸氢钠和草酸钠的混合溶液,在溶液中:c(Na+)=0.100 mol·L -1+ c(HC2O4-),C 错误;
D、由图像知 pH=7 的溶液为草酸钠溶液,草酸根水解,c(Na+)>2c(C2O42-),D 正确。答案选
BD。
【考点定位】本题主要是考查电解质溶液中的离子平衡以及离子浓度大小比较
【名师点晴】该题综合性强,难度较大。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多
年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的
区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基
本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中
常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平
衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”
来求解。解题的关键是运用物料守恒、电荷守恒和质子守恒原理计算相关离子浓度大小。
4.【2016 年高考上海卷】能证明乙酸是弱酸的实验事实是( )
A.CH3COOH 溶液与 Zn 反应放出 H2
B.0.1mol/L CH3COONa 溶液的 pH 大于 7
C.CH3COOH 溶液与 NaCO3 反应生成 CO2
D.0.1 mol/L CH3COOH 溶液可使紫色石蕊变红
【答案】B
【考点定位】考查酸性强弱比较的实验方法。
【名师点睛】强酸与弱酸的区别在于溶解于水时是否完全电离,弱酸只能部分发生电离、水溶液中存在电
离平衡。以 CH3COOH 为例,通常采用的方法是:①测定 0.1mol/LCH3COOH 溶液 pH>1,说明 CH3COOH
没有完全电离;②将 pH=1CH3COOH 溶液稀释 100 倍后测定 3>pH>1,说明溶液中存在电离平衡,
且随着稀释平衡向电离方向移动;③测定 0.1mol/L CH3COONa 溶液的 pH>7,说明 CH3COONa 是强
碱弱酸盐,弱酸阴离子 CH3COO-水解使溶液呈碱性。
5.【2016 年高考四川卷】向 1L 含 0.01molNaAlO2 和 0.02molNaOH 的溶液中缓慢通入二氧化碳,随 n(CO2)
增大,先后发生三个不同的反应,当 0.01mol
c(AlO2-)+c(OH-)
B 0.01 c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C 0.015 c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D 0.03 c(Na+)> c(HCO3-)> c(OH-)>c(H+)
【答案】D
【考点定位】考查电解质溶液中的离子平衡,钠、铝及其化合物的性质
【名师点睛】本题将元素化合物知识与电解质溶液中离子浓度大小比较综合在一起考查,熟练掌握相关元
素化合物知识,理清反应过程,结合相关物质的用量正确判断相关选项中溶液的成分是解题的关键。
电解质溶液中微粒浓度大小比较要抓住两个平衡:电离平衡和盐类的水解平衡,抓两个微弱:弱电解
质的电离和盐类的水解是微弱的,正确判断溶液的酸碱性,进行比较。涉及等式关系要注意电荷守恒
式、物料守恒式和质子守恒式的灵活运用。
6.【2016 年高考天津卷】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达到平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS 可溶而 CuS 不溶,说明 CuS 的溶解度比 ZnS 的小
【答案】D
≤
【考点定位】考查反应热和焓变、金属的腐蚀与防护、原电池原理、难溶电解质的溶解平衡
【名师点晴】本题考查了催化剂对反应热的影响、金属的腐蚀与防护、原电池原理、难溶电解质的溶解平
衡等知识点。考查的知识点均为基础知识。本题的易错选项是 C,原电池中产生电流是因为正负极间
存在电势差,当原电池中的反应达到平衡时,两端就不存在电势差了,也就无法形成电压驱动电子移
动,无法形成电流了。提醒同学们在学习过程中对于其他学科的基础知识要作为常识储备起来,通过
自己的科学素养。
7.【2016 年高考天津卷】室温下,用相同浓度的 NaOH 溶液,分别滴定浓度均为 0.1mol·L -1 的三种酸
(HA、HB 和 HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至 P 点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达 100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】C
【解析】
试题分析:A.根据图像,0.1mol·L-1 的三种酸(HA、HB 和 HD)溶液的起始 pHHA 最小,酸性最强,HD
的 pH 最大,酸性最弱,酸性越强,电离平衡常数越大,三种酸的电离常数关系:KHA>KHB>KHD,正
确;B.滴定至 P 点时溶质为等物质的量浓度的 HB 和 NaB,溶液显酸性,HB 的电离为主,但电离程
度较小,因此 c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) ,正确;C.pH=7 时,三种溶液中阴离子的水解
程度不同,加入的氢氧化钠的体积不同,三种离子浓度分别于钠离子浓度相等,但三种溶液中钠离子
浓度不等,错误;D.此为混合溶液的质子守恒关系式,c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),正
确;故选 C。
【考点定位】考 查中和滴定图像、弱电解质的电离平衡、离子浓度大小比较
8.【2016 年高考新课标Ⅰ卷】298K 时,在 20.0mL 0.10mol 氨水中滴入 0.10 mol 的盐酸,溶液的 pH
与所加盐酸的体积关系如图所示。已知 0.10 mol 氨水的电离度为 1.32%,下列有关叙述正确的是
( )
A.该滴定过程应该选择酚酞作为指示剂
B.M 点对应的盐酸体积为 20.0 mL
C.M 点处的溶液中 c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N 点处的溶液中 pH<12
【答案】D
1L−⋅ 1L−⋅
1L−⋅
【考点定位】考查酸碱中和滴定、弱电解质的电离以及离子浓度大小比较等知识。
【名师点睛】酸碱中和滴定是中学化学的重要实验,通常是用已知浓度的酸(或碱)来滴定未知浓度的碱(或
酸),由于酸、碱溶液均无色,二者恰好反应时溶液也没有颜色变化,所以通常借助指示剂来判断,指
示剂通常用甲基橙或酚酞,而石蕊溶液由于颜色变化不明显,不能作中和滴定的指示剂。酸碱恰好中
和时溶液不一定显中性,通常就以指示剂的变色点作为中和滴定的滴定终点,尽管二者不相同,但在
实验要求的误差范围内。进行操作时,要注意仪器的润洗、查漏、气泡的排除,会进行误差分析与判
断。判断电解质溶液中离子浓度大小时,经常要用到三个守恒:电荷守恒、物料守恒、质子守恒,会
根据相应的物质写出其符合题意的式子,并进行叠加,得到正确的算式。掌握水的离子积常数的计算
方法、离子浓度与溶液的 pH 的关系等是本题解答的关键所在。本题难度适中。
9.【2016 年高考新课标Ⅲ卷】下列有关电解质溶液的说法正确的是( )
A.向 0.1mol CH3COOH 溶液中加入少量水,溶液中 减小
B.将 CH3COONa 溶液从 20℃升温至 30℃,溶液中 增大
C.向盐酸中加入氨水至中性,溶液中
D.向 AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中 不变
【答案】D
1L−⋅
3
(H )
(CH COOH)
c
c
+
3
3
(CH COO )
(CH COOH) (OH )
c
c c
−
−⋅
4(NH ) 1(Cl )
c
c
+
− >
(Cl )
(Br )
c
c
−
−
【考点定位】考查弱电解质的电离平衡,盐类水解平衡,难溶电解质的溶解平衡
【名师点睛】本试题考查影响弱电解质电离平衡移动、盐类水解移动、离子浓度大小比较、难溶电解质的
溶解平衡等知识,属于选修 4 上的知识点,这部分题考查学生对上述知识的运用、分析、审题能力,
平时训练中需要强化这部分知识的练习,因为它是高考的重点。醋酸属于弱电解质,CH3COOH
CH3COO-+H+,影响弱电解质的因素:(1)温度:升高温度促进电离;(2)加水稀释,促进电离;
(3)同离子效应:加入相同离子抑制电离;(4)加入反应离子:促进电离;因为是都在同一溶液,
溶液体积相同,因此看物质的量变化,加水稀释促进电离,n(H+)增大,n(CH3COOH)减小,则比值增
大;影响盐类水解的因素:温度、浓度、加入反应离子、同离子等,依据水解常数的表达式,得出:
=1/K,K 只受温度的影响,盐类水解是中和反应的逆过程,属于吸热反应,
升高温度促进水解,K 增大,则比值变小;离子浓度大小比较中,有“三个守恒”:电荷守恒、物料守
恒、质子守恒,会根据相应的物质写出其符合题意的式子,并进行叠加,得到正确的算式,因为是溶
液显中性,常用电荷守恒的思想解决,即 c(NH4+)+c(H+)=c(OH-)+c(Cl-),溶液显中性则 c(H+)=c(OH
-),即 c(NH4+)=c(Cl-),比值等于 1;依据溶度积的表达式得出:K sp(AgCl)=c(Ag+)×c(Cl-),
Ksp(AgBr)=c(Ag+)×c(Br-),则两式相比得到 c(Cl-)/c(Br-)=Ksp(AgCl)/Ksp(AgBr),溶度积只受温度的
影响,温度不变,则比值不变,溶度积和离子积的关系:Qc=Ksp 溶液达到饱和,Qc>Ksp 溶液过饱和
有沉淀析出,Qc
查看更多